Оглавление:
Каждая группа химической материи характеризуется набором свойств.
Элемент:
1) заряд атома,
2) атомная масса,
3) радиус атома,
4) электронная формула элемента и его принадлежность к определенному семейству,
5) химические свойства: а) окислительно-восстановительная характеристика элемента (металл, неметалл), выражаемая с количественной стороны энергией ионизации, сродством к электрону, электроотрицательностью; б) валентность (спинва-лентность, окислительное число).
Простые соединения-.
1) физические свойства: а) агрегатное состояние простых веществ в нормальных условиях; б) аллотропные формы; в) электропроводность (проводник, полупроводник, изолятор);
2) химические свойства (окислительно-восстановительные свойства простых веществ рассматриваются в двух направлениях): а) отношение простых веществ к водороду, кислороду, галогенам, бору, углероду’, кремнию, азоту с указанием химических форм гидридов, галидов, оксидов; характер химической связи в них и отдельные физические и химические свойства; б) отношение простых веществ к воде, водным растворам щелочей и кислот (окислителей и неокислителей); типичные случаи взаимодействия с учетом активности металлов и неметаллов.
С количественной стороны окислительно-восстановительные свойства простых соединений в водных средах характеризуются стандартными редоксипотенциалами 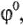 а в твердой и газообразных фазах — стандартными изобарно-изотермическими потенциалами
а в твердой и газообразных фазах — стандартными изобарно-изотермическими потенциалами 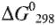 соответствующих соединений (оксидов, гидридов и т.д.).
соответствующих соединений (оксидов, гидридов и т.д.).
Сложные соединения. Из двух групп сложных соединений (дальтонидов и бертоллидов) в химии принято изучать, как правило, свойства дальтонидов. Среди них выделяются три основных класса: гидроксиды элементов (основания, оксикислоты), оксиды и соли.
Химические свойства сложных соединений
Кислотно-основные свойства гидроксидов и оксидов характеризуются соответствующими уравнениями реакций. Для этого определяют характер (кислотный, основной, амфотерный) этих соединений на основе поляризующих свойств центральных атомов (ионов). Кислотно-основные свойства солей заключаются в их способности к гидролизу (запись соответствующих уравнений реакций в молекулярной и ионной форме).
Окислительно-восстановительные свойства
Все сложные соединения подразделяются на три группы:
1) соединения с максимальным окислительным числом;
2) минимальным окислительным числом;
3) промежуточным окислительным числом.
Характеризовать окислительно-восстановительные свойства сложных соединений и определить возможность и направление окислительно-восстановительных реакций с участием сложных соединений можно тремя способами:
1) в водных растворах с помощью редоксопотенциалов;
2) в твердой и газообразной фазах с помощью изобарноизотермических потенциалов 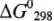 образования химических соединений;
образования химических соединений;
3) на основе общих закономерностей изменения устойчивости соединений по периодической системе.
Для сложных соединений d-элементов, кроме того, отмечаются: способность соединений к комплексообразованию (запись формул важнейших соответствующих комплексных соединений с указанием электролитической диссоциации и прочности комплексного иона), каталитическая способность, окрашенность соединений.
Пример. Описание свойств олова и его простых и сложных соединений. «*
Свойства олова Sn определяются по периодической системе Д.И. Менделеева и таблице электроотрицательностей элементов. Периодическая система дает возможность определить атомную массу элемента и основные координаты элемента: порядковый номер, номер группы, номер периода, принадлежность к подгруппе. Атомная масса Sn — 118,6; порядковый номер — 50; элемент V периода; IV главной подгруппы. На основе этих координат составляется электронная формула элемента: 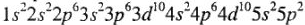 и определяется принадлежность олова к p-семейству.
и определяется принадлежность олова к p-семейству.
Химические свойства элемента Sn:
1) окислительно-восстановительные свойства. Так как олово входит в число 10 p-элементов, обладающих металлическими свойствами, то данный элемент проявляет только восстановительные свойства. С количественной стороны восстановительные свойства олова можно охарактеризовать значением ОЭО, равным 1,96;
2) валентность определяется на основе теории спинвалент-ности: а) валентные электроны 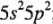 ; б) валентность олова: в невозбужденном состоянии 2, а в возбужденном состоянии 4.
; б) валентность олова: в невозбужденном состоянии 2, а в возбужденном состоянии 4.
Зная химические свойства элемента, определяют окислительные числа олова в его сложных соединениях. Так как для всех связанных атомов металлов окислительные числа имеют только положительные значения, то для олова это соответственно +2 и +4. А на основе закономерности устойчивости сложных соединений главных подгрупп делают вывод, что типичным окислительным числом для олова будет +4.
Простые соединения олова. Физические свойства олова описываются после изучения учебной литературы. Химические свойства олова даются также после изучения учебной литературы, по таблицам редоксипотенциалов ионов, стандартных изобарно-изотермических потенциалов образования соединений по растворимости.
Взаимодействие олова с простыми веществами — водородом, кислородом, галогенами: олово непосредственно с водородом не реагирует, но образует летучий малоустойчивый гидрид 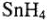 косвенным путем. С кислородом, галогенами, как это следует из значений
косвенным путем. С кислородом, галогенами, как это следует из значений 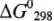 соответствующих соединений, взаимодействуют непосредственно:
соответствующих соединений, взаимодействуют непосредственно:
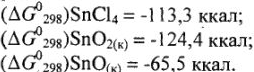
Причем в реакциях образуются оксиды, галиды, отвечающие типичному окислительному числу олова (+4):
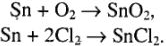
Взаимодействие олова с бором, углеродом, кремнием мало характерно (сравнение значения ОЭО всех атомов).
Сложные соединения олова. На основе химических свойств сложных соединений металла определить состав соединений, получающихся в результате взаимодействия олова с водой, кислотами, водными растворами щелочей.
Кислотно-основные свойства сложных соединений олова. Выписываем оксиды, гидроксиды олова: 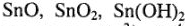 ,
, 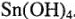 . На основе поляризующих свойств ионов
. На основе поляризующих свойств ионов 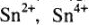 определяем характер оксидов и гидроксидов олова. Согласно теории поляризации
определяем характер оксидов и гидроксидов олова. Согласно теории поляризации 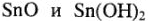 обладают амфотерными свойствами с преобладанием основных свойств, так как ион
обладают амфотерными свойствами с преобладанием основных свойств, так как ион 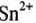 имеет электронную оболочку типа 18+2. A
имеет электронную оболочку типа 18+2. A 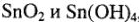 , как и соединения ионов
, как и соединения ионов 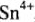 , обладают амфотерными свойствами с преобладанием кислотных свойств. Следовательно, кислотноосновные свойства оксидов и гидроксидов характеризуются 4 реакциями:
, обладают амфотерными свойствами с преобладанием кислотных свойств. Следовательно, кислотноосновные свойства оксидов и гидроксидов характеризуются 4 реакциями:
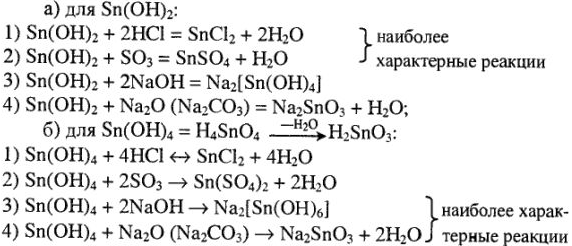
Кислотно-основные свойства солей заключаются в их гидролизе. Исходя из характера гидроксидов  , можно сделать вывод, что устойчивость соли катионного и анионного типов будет различной. Так, ясно, что
, можно сделать вывод, что устойчивость соли катионного и анионного типов будет различной. Так, ясно, что  будет гидролизо-вываться ступенчато:
будет гидролизо-вываться ступенчато:
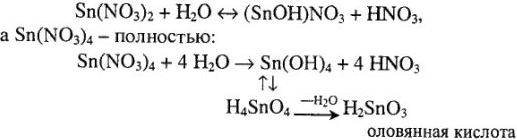
Степень гидролиза 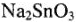 будет меньше степени гидролиза
будет меньше степени гидролиза 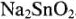 .
.
Окислительно-восстановительные свойства сложных соединений олова в водных растворах характеризуются редокси-потенциалами:
1) окислительно-восстановительные свойства соединений 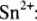
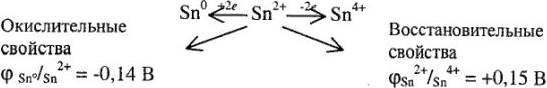
2) окислительные свойства 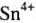 :
:
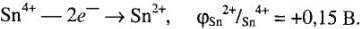
По редоксипотенциалам для соединений 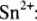 и
и 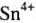 + делаем выводы об их окислительной и восстановительной способностях (так, соединения
+ делаем выводы об их окислительной и восстановительной способностях (так, соединения 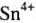 — очень слабые окислители); подбираем соответствующие окислители и восстановители и записываем окислительно-восстановительную реакцию с участием этих соединений:
— очень слабые окислители); подбираем соответствующие окислители и восстановители и записываем окислительно-восстановительную реакцию с участием этих соединений:
1) окислительные свойства 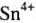 :
:
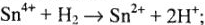
2) восстановительные свойства 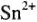 :
:
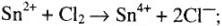
3) окислительные свойства 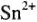 :
:
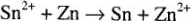
Окислительно-восстановительные свойства соединений в твердой и газообразной фазе определяются по стандартным изобарно-изотермическим потенциалам (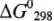 )-
)-
Сведения о взаимодействии олова со сложными веществами (водой, водными растворами щелочей, кислот) даются на основе обзорных лекций и таблиц редоксипотенциалов и растворимости соединений.
По редоксипотенциалам 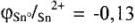 В делается вывод, что олово — металл средней активности:
В делается вывод, что олово — металл средней активности:
1) олово с водой не реагирует. Причина — нерастворимость в воде оксидной пленки;
2) с водными растворами щелочей и простыми кислотами (соляной, разбавленной серной) олово взаимодействует, так как выполняются все требования, обеспечивающие растворимость металла в этих сложных соединениях:
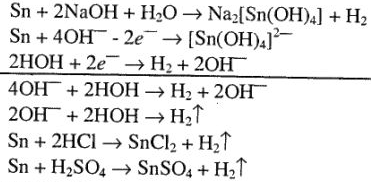
Следует отметить, что в этих случаях соединения  , а не
, а не  , так как образуется восстановительная водородная атмосфера, а в этих условиях устойчивы соединения
, так как образуется восстановительная водородная атмосфера, а в этих условиях устойчивы соединения 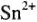 ;
;
3) с кислотами-окислителями (концентрированной серной и концентрированной азотной) взаимодействие олова как металла средней активности идет по реакциям:
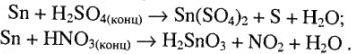
Таким образом, так как здесь нет восстановительной среды (наоборот, присутствует избыток кислот-окислителей), то устойчивы соединения олова с типичным окислительным числом +4. А различная степень гидролиза соединений 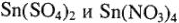 обусловливает различие в типе получающихся соединений
обусловливает различие в типе получающихся соединений 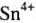 :
: 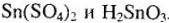 . Концентрированная серная кислота (98 %-я) и в ней
. Концентрированная серная кислота (98 %-я) и в ней 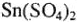 не может гидролизоваться (мало воды), а в случае концентрированной азотной кислоты (63 %-й) гидролиз
не может гидролизоваться (мало воды), а в случае концентрированной азотной кислоты (63 %-й) гидролиз 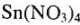 идет полностью до образования
идет полностью до образования 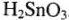 .
.
Жесткость воды и методы ее устранения
По содержанию в природной воде солей двухвалентных металлов судят о ее жесткости.
Природная вода, содержащая большое количество растворенных солей кальция и магния, называется жесткой водой.
Различают жесткость временную и постоянную. Первая обусловливается присутствием в воде гидрокарбонатов двухвалентных металлов 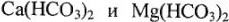 , иногда и
, иногда и 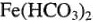 . Временной она называется потому, что может быть устранена кипячением воды: гидрокарбонаты при этом разрушаются, нерастворимые продукты их распада (карбонаты кальция и магния, гидрат оксида железа) оседают на стенках сосуда в виде накипи. По цвету последней можно оценить содержание Ре(НСО3)2 в потребляемой воде: если его вовсе нет, накипь имеет белый цвет, а присутствие значительного его количества — красно-бурый.
. Временной она называется потому, что может быть устранена кипячением воды: гидрокарбонаты при этом разрушаются, нерастворимые продукты их распада (карбонаты кальция и магния, гидрат оксида железа) оседают на стенках сосуда в виде накипи. По цвету последней можно оценить содержание Ре(НСО3)2 в потребляемой воде: если его вовсе нет, накипь имеет белый цвет, а присутствие значительного его количества — красно-бурый.
Постоянная жесткость воды обусловлена присутствием в ней солей, не дающих осадка при кипячении. Наиболее обычны сульфаты и хлориды кальция и магния. Из них особое внимание заслуживает малорастворимый 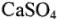 , который при последовательном испарении больших количеств воды оседает в виде очень плотной накипи.
, который при последовательном испарении больших количеств воды оседает в виде очень плотной накипи.
При работе парового котла на жесткой воде его нагреваемая поверхность покрывается накипью, что может привести к взрыву. Жесткая вода оказывается непригодной для проведения технологических процессов ряда отраслей промышленности.
Сумма временной и постоянной жесткости определяет общую жесткость воды. В России жесткость воды выражают числом ионов 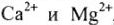 , содержащихся в 1л воды (моль/л). 1 моль/л жесткости отвечает содержанию 20,04 мг/л
, содержащихся в 1л воды (моль/л). 1 моль/л жесткости отвечает содержанию 20,04 мг/л 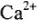 или 12,16 мг/л
или 12,16 мг/л 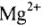 . Общая жесткость:
. Общая жесткость:
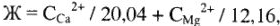
где Ж — жесткость воды, ммоль/кг (или ммоль/л); 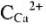 + — концентрация ионов
+ — концентрация ионов 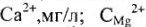 — концентрация ионов
— концентрация ионов 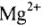 , мг/л.
, мг/л.
Жесткость воды может колебаться в широких пределах. По жесткости вода характеризуется следующим образом: до 4 ммоль/л — мягкая; от 4 до 8 ммоль/л — средней жесткости; от 8 до 12 ммоль/л — жесткая.
Временную жесткость обычно устраняют, прибавляя к воде 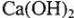 в количестве, строго отвечающем найденному по анализу содержанию гидрокарбонатов. При этом по реакции
в количестве, строго отвечающем найденному по анализу содержанию гидрокарбонатов. При этом по реакции
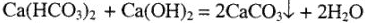
весь гидрокарбонат переходит в нормальный карбонат и осаждается. От постоянной (иначе — некарбонатной) жесткости чаще всего освобождаются добавлением к воде соды, которая вызывает образование осадка по реакции
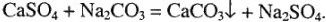
Затем воде дают отстояться и лишь после этого пользуются ею для питания котлов или в производстве. Для умягчения небольшого количества жесткой воды обычно добавляют к ней немного соды и дают отстояться. При этом двухвалентные металлы полностью осаждаются в виде карбонатов, а остающиеся в растворе соли натрия употреблению мыла не мешают.
Содой можно пользоваться для устранения временной и постоянной жесткости, а гидроксидом кальция — только для устранения временной жесткости.
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
| Защита металлов от коррозии в химии |
| Комплексные соединения в химии |
| Полимеры: органические соединения |
| Эквиваленты и количество эквивалентов простых и сложных веществ. Закон эквивалентов |

