Оглавление:






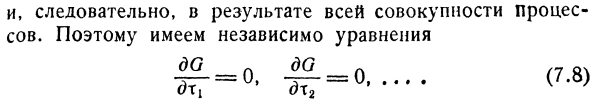

Химическое равновесие.Координация реакции.
- Химическое равновесие Вводятся координаты реакции.Показана формулировка закона массы и принципа Ле Шателье.Обсуждается вопрос о химическом сродстве. Регулировка реакции Ранее мы предполагали, что общая масса любого компонента постоянна, но она может свободно распределяться в разных фазах.
Это предположение обнуляется, когда в системе происходит химическая реакция.Молекулы разбиваются и появляются новые молекулы formed.In в этом случае неизменными остаются только атомы, но наш формальный аппарат вполне пригоден для рассмотрения равновесия относительно внутренних флуктуаций такой системы.Просто введите параметры, которые подходят для новых степеней свободы.
- В химии символические выражения используются для обозначения конкретной реакции. И. П. (7.1) Здесь первая сумма — о компонентах, входящих в реакцию, вторая-о продуктах реакции, где Х-химический символ реакционной молекулы, а v-стехиометрический коэффициент.Например, реакция N2 + 02 = 2K0 (7.2) ’) Если вы выполните еще один шаг, связанный с ядерной реакцией, вы увидите, что атом даже не является неизменным. Входящими в реакцию компонентами являются азот и кислород VNi = vo2 = L. продуктом реакции является оксид азота vN0 = 2 ’)- Чтобы показать, насколько сильно прореагировал исходный материал, введем координату реакции m, которая определяется следующим образом: t-число элементарных реакций.
Фиксированный, но вообще говоря, может быть засчитан из любого состояния. Людмила Фирмаль
Изменение координат реакции приводит к изменению свободной энергии, равной (7.3) Это связано с тем, что изменение числа молекул в общем случае выражается в соответствии с (6.8′): (60) г. i = k =••. = 2 ИГ СП (7,4) г. С другой стороны, в элементарной реакции 6Т — v;6t для реактивных компонентов,-f-v ^ ftt для продуктов реакции、 (7.5) Потому что после реакции 6Т такое количество реакционноспособных компонентов исчезает, и появляется соответствующее количество продуктов реакции. Состояние химического равновесия представлено следующими соотношениями: Св / / второй = СВП / ИС,(7.6) И. П. * )
Разделение реагирующих молекул на» реактивные компоненты «и» продукты реакции » полезно для определения направления реакции слева направо, что часто требуется в этой главе.С учетом соображений симметрии все молекулы можно назвать реагентами, но это неудобно принимать во внимание. Это очень легко запомнить, потому что оно получается путем замены каждого химического символа в стехиометрической формуле (7.1) своим химическим символом potential.
In равновесное состояние, производная свободной энергии или потенциал Гиббса для координат реакции должны быть равны нулю.Подобный этому (7.7) О возможных реакциях.Возможны несколько реакций, но для каждого стехиометрического уравнения (7.1) справедливо условие равновесия (7.6). Полезно рассмотреть несколько примеров, например, азотно-кислородную систему промышленного значения.Уравнение (7.2), являющееся главным реактивным свойством этой системы, уже записано.
Однако, система имеет множество других молекул, таких как значение N0,Н20,N205,n203 определяют, и бесплатно о, n атомов. N2 + 02 = 2N0, координата реакции xv N2-f-202 = 2N02, координата реакции t2、 N + 0 = Нет, координата реакции t3> N2-2N, координаты реакции t4、 02 = 20, координата реакции t5 И так далее. Как полностью изменить количество молекул、 6Nn2 = — 6ти-6t2-6t4-Ф -. 。 。, 6No,= — 6ti-2 6t2-6t5 + …, 6No = 2 6ti + 6t3 + ….(7.4) назначение является 60 = [xn2 6 / VN2-f \ io, W0i+/.ino6 ^ не + … = = — 6ти(Ж. ИО2 + mn2 по-2 [.ИНО) — 6t201yl + 2jxo, −2 ^ NО2)+•
Здесь координаты реакции xv t2, … она независима.Следовательно, в результате всего процесса.Поэтому независимо существует уравнение | 2 — = 0. 4° — = 0 ……….(7.8) с)Т1 dx2
.Согласно определению координат реакций, они обеспечивают сохранение количества атомов N и O в каждой реакции. Людмила Фирмаль
Смотрите также:
| Примеры | Закон действующих масс |
| Электролиты | Химическое сродстово |

