Оглавление:
Влияние химических факторов на равновесие. Молярная доля компонента в растворе
Образующиеся в растворе ионы могут вступать в различные реакции с другими ионами и молекулами.
Поэтому наряду с основной химической реакцией в растворе могут протекать конкурирующие (побочные) реакции. Например, в водном растворе 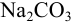 , наряду с диссоциацией соли на ионы
, наряду с диссоциацией соли на ионы 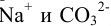 , могут протекать побочные реакции протонирования аниона. Протонирование может осуществляться ионами
, могут протекать побочные реакции протонирования аниона. Протонирование может осуществляться ионами 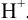 , образующимися в результате диссоциации воды или введенными в раствор с какой-либо кислотой:
, образующимися в результате диссоциации воды или введенными в раствор с какой-либо кислотой:
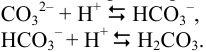
Поэтому в растворе анион присутствует в виде трех частиц с разной равновесной концентрацией: 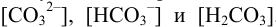 . Общую (аналитическую) концентрацию,
. Общую (аналитическую) концентрацию, 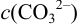 , можно представить как сумму равновесных концентраций всех форм (условие материального баланса):
, можно представить как сумму равновесных концентраций всех форм (условие материального баланса):
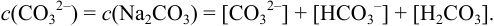
Равновесная концентрация каждой формы связана с общей концентрацией вещества коэффициентом а, называемым молярной долей соответствующей формы. В данном примере для раствора 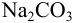 :
:
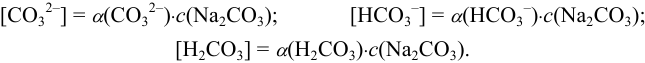
Сумма молярных долей всех форм вещества равна единице (или 100 %). Таким образом, чтобы найти равновесную концентрацию формы, зная общую, необходимо вычислить 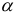 . Для расчета
. Для расчета 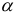 -молярной доли любой формы кислоты
-молярной доли любой формы кислоты 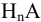 при заданных условиях (заданной концентрации ионов водорода), а также для расчета
при заданных условиях (заданной концентрации ионов водорода), а также для расчета 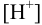 обеспечивающей нужную равновесную концентрацию частицы в растворе, используют общую формулу:
обеспечивающей нужную равновесную концентрацию частицы в растворе, используют общую формулу:
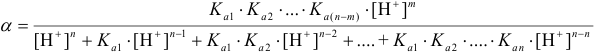
Смысл индекса m (изменяется от 1 до n) понятен из уравнения материального баланса для кислоты 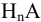 :
:
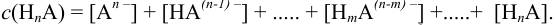
Например, для равновесных форм 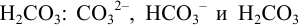 молярные доли вычисляют по формулам, вытекающим из (2.4):
молярные доли вычисляют по формулам, вытекающим из (2.4):
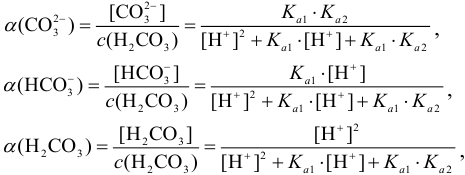
где 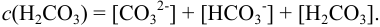 .
.
Если ион в растворе участвует в реакциях комплексообразования и при этом получаются формы с разным количеством лигандов, то расчет молярных долей форм проводят по формулам:
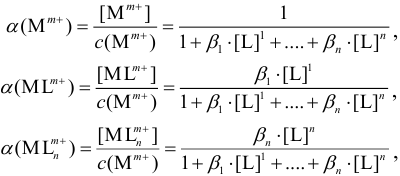
где L — лиганд (для простоты записи — нейтральная частица);
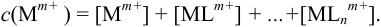
Молярную долю рассчитывают и используют, с одной стороны, для вычисления равновесной концентрации частицы в условиях побочных взаимодействий, а с другой — при определении условий, которые необходимо создать в растворе для маскирования иона и подавления его реакционной способности.
| Решение задач по химии |
Пример 2.4.
Какая из форм серы преобладает в 0,10 М растворе 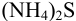 при pH = 6,0? (Ионную силу раствора не учитывать). Определите равновесные концентрации всех серосодержащих форм частиц в растворе.
при pH = 6,0? (Ионную силу раствора не учитывать). Определите равновесные концентрации всех серосодержащих форм частиц в растворе.
Решение:
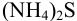 — сильный электролит, нацело диссоциирует, поэтому общая концентрация форм, содержащих серу, равна исходной концентрации соединения, т. е. по условию материального баланса:
— сильный электролит, нацело диссоциирует, поэтому общая концентрация форм, содержащих серу, равна исходной концентрации соединения, т. е. по условию материального баланса:
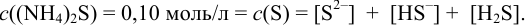
Главная реакция: 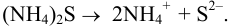 .
.
Побочные реакции: 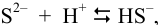
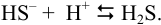
По формуле (2.4) или формулам (2.5-2.7) для вычисления молярных долей всех форм двухосновной кислоты вычисляют а и равновесные концентрации форм серы с учетом констант кислотности 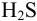 и pH раствора (главная и побочные реакции протекают при
и pH раствора (главная и побочные реакции протекают при 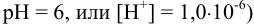 :
:
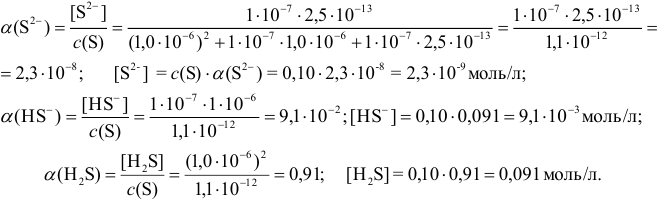
Проведенные вычисления показывают, что при таких условиях в растворе преобладает молекулярная форма, т. е. 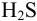 .
.
Пример 2.5.
Для начала осаждения 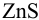 из
из 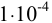 М раствора
М раствора 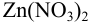 в растворе необходимо создать
в растворе необходимо создать 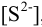 , равную
, равную 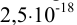 моль/л. Будет ли выпадать осадок
моль/л. Будет ли выпадать осадок 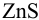 из такого раствора соли цинка, если насытить раствор сероводородом при
из такого раствора соли цинка, если насытить раствор сероводородом при 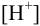 = 0,2 моль/л
= 0,2 моль/л 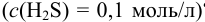 ? Если нет, то какую концентрацию ионов водорода следует создать в растворе для достижения достаточной концентрации
? Если нет, то какую концентрацию ионов водорода следует создать в растворе для достижения достаточной концентрации 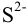 ?
?
Решение:
Осадок 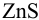 выпадет, если в указанных условиях
выпадет, если в указанных условиях 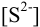 будет больше, чем
будет больше, чем 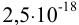 моль/л. Вычисляем
моль/л. Вычисляем 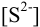 при
при 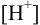 = 0,2 моль/л по формуле (2.4) или (2.5):
= 0,2 моль/л по формуле (2.4) или (2.5):
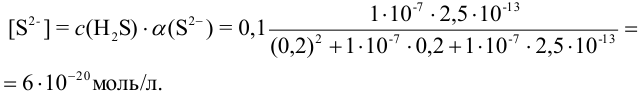
Вычисленная с учетом условий задачи 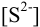 меньше необходимой для выпадения осадка
меньше необходимой для выпадения осадка 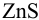 , следовательно, осадок не выпадет. Тогда необходимо решить уравнение (2.4) или (2.5) относительно
, следовательно, осадок не выпадет. Тогда необходимо решить уравнение (2.4) или (2.5) относительно 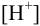 , достаточной для
, достаточной для 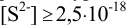 моль/л.
моль/л.
Пример 2.6.
Рассчитайте молярную долю и равновесную концентрацию ионов серебра в 0,010 М растворе 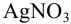 в присутствии 2,0 М
в присутствии 2,0 М  .
.
Решение:
Главная реакция: 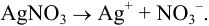
Побочные реакции: 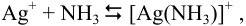
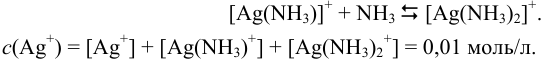
(условие материального баланса)
Молярную долю, 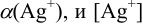 можно вычислить по формуле (2.8) с учетом табличных значений констант устойчивости комплексных ионов. Равновесную концентрацию лиганда —
можно вычислить по формуле (2.8) с учетом табличных значений констант устойчивости комплексных ионов. Равновесную концентрацию лиганда — 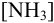 при этом можно принять равной исходной, поскольку побочные реакции протекают при большом избытке аммиака.
при этом можно принять равной исходной, поскольку побочные реакции протекают при большом избытке аммиака.
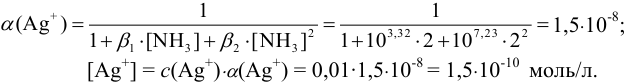
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

