Оглавление:
Гальванические элементы коррозия металлов
Задача 54.
а) Алюминиевый электрод погружен в 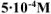 раствор сульфата алюминия. Вычислить значение потенциала алюминиевого электрода.
раствор сульфата алюминия. Вычислить значение потенциала алюминиевого электрода.

Решение:
Электродный потенциал алюминия рассчитываем по уравнению Нериста:
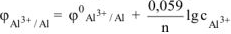
По таблице 11.1 определяем стандартный электродный потенциал алюминия
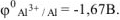
Записываем уравнение электродного процесса, протекающего на поверхности алюминиевого электрода в растворе соли:
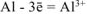
n — число электронов, участвующих в электродном процессе. Для данной реакции n равно заряду иона алюминия 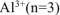 . Рассчитываем концентрацию ионов алюминия в растворе
. Рассчитываем концентрацию ионов алюминия в растворе 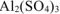 :
:
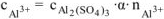
Разбавленный раствор 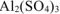 — сильный электролит.
— сильный электролит.
Следовательно, а = 1. По уравнению диссоциации 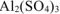 :
:
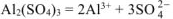
число ионов 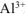 , образующихся при диссоциации одной молекулы
, образующихся при диссоциации одной молекулы 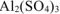 равно 2.
равно 2.
Следовательно, 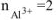
Тогда 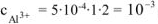 моль/л.
моль/л.
Рассчитываем электродный потенциал алюминиевого электрода:
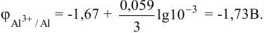
Ответ: 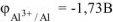
б) Потенциал цинкового электрода, погруженного в раствор своей соли, равен (-0,75В). Вычислить концентрацию ионов цинка в растворе.

Решение:
Электродный потенциал цинка определяется по уравнению Нернста:
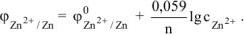
Откуда: 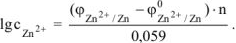
По таблице 11.1 определяем стандартный электродный потенциал цинка
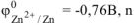 — равно заряду иона цинка
— равно заряду иона цинка 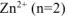 .
.
Тогда: 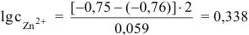
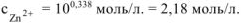
Ответ: 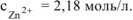 .
.
Задача 55.
Составить две схемы гальванических элементов (ГЭ), в одной из которых олово служило бы анодом, в другой — катодом. Для одной из них написать уравнения электродных процессов и суммарной токообразующей реакции. Вычислить значение стандартного напряжения ГЭ.
Решение:
В гальваническом элементе анодом является более активный металл с меньшим алгебраическим значением электродного потенциала, катодом — менее активный металл с большим алгебраическим значением электродного потенциала.
По таблице 11.1 находим 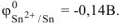 .
.
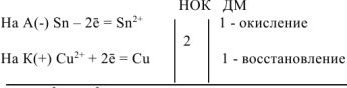
а) Олово является анодом ГЭ.
В качестве катода можно выбрать любой металл с
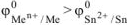
Выбираем, например, медь 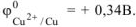 . В паре
. В паре 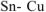 — олово будет являться анодом ГЭ, медь — катодом. Составляем схему ГЭ:
— олово будет являться анодом ГЭ, медь — катодом. Составляем схему ГЭ:
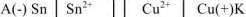
или

Уравнения электродных процессов:
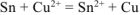 — суммарное ионно-моленкулярное уравнение токообразующей реакции
— суммарное ионно-моленкулярное уравнение токообразующей реакции
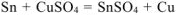 — суммарное молекулярное уравнение токообразующей реакции;
— суммарное молекулярное уравнение токообразующей реакции;
Рассчитываем стандартное напряжение ГЭ:
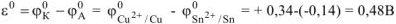
б) Олово является катодом ГЭ.
В качестве анода ГЭ можно выбрать любой металл с
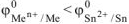 — кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
— кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
Выбираем, например, магний 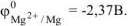
В паре 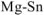 — магний является анодом, олово — катодом. Составляем схему ГЭ:
— магний является анодом, олово — катодом. Составляем схему ГЭ:
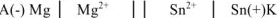
или

Задача 56.
Составить схему коррозионного гальванического элемента, возникающего при контакте железа с цинком в:
а) атмосферных условиях 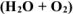 ;
;
б) кислой среде  ;
;
в) кислой среде в присутствии кислорода 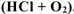 .
.
Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
Решение:
По таблице 11.1 находим значение стандартных электродных потенциалов железа и цинка:
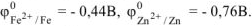
Так как 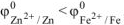 то анодом коррозионного гальванического элемента будет являться цинк, катодом — железо.
то анодом коррозионного гальванического элемента будет являться цинк, катодом — железо.
а) Коррозия в атмосферных условиях 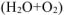 .
.
Составляем схему коррозионного ГЭ:
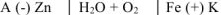
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:

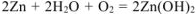 — суммарное молекулярное уравнение процесса коррозии.
— суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде 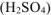
Составляем схему коррозионного ГЭ:
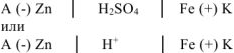
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:

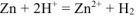 — суммарное ионно-молекулярное уравнение процесса коррозии;
— суммарное ионно-молекулярное уравнение процесса коррозии;
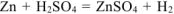 — суммарное молекулярное уравнение процесса коррозии.
— суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода 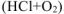 .
.
Составляем схему коррозионного ГЭ:
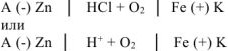
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
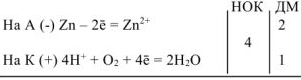
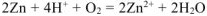 — суммарное ионно-молекулярное уравнение процесса коррозии
— суммарное ионно-молекулярное уравнение процесса коррозии
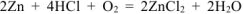 — суммарное молекулярное уравнение процесса коррозии.
— суммарное молекулярное уравнение процесса коррозии.
Во всех случаях коррозионному разрушению будет подвергаться более активный металл — цинк.
Задача 57.
Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 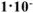
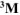 раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.
раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.

Решение:
Для составления схемы ГЭ необходимо знать величины электродных потенциалов металлов — цинка и хрома.
По таблице 11.1 определяем стандартные электродные потенциалы металлов:
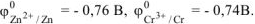
Хлорид цинка диссоциирует по уравнению:
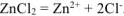
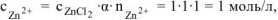
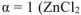 — сильный электролит),
— сильный электролит), 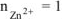 , поскольку условия стандартные
, поскольку условия стандартные 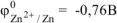 .
.
Хлорид хрома (III) диссоциирует по уравнению:

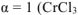 — сильный электролит),
— сильный электролит), 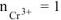 , поскольку условия отличны от стандартных, рассчитываем электродный потенциал хрома:
, поскольку условия отличны от стандартных, рассчитываем электродный потенциал хрома:
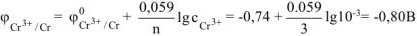
Так как 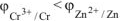 , то в ГЭ анодом будет являться хром, катодом — цинк.
, то в ГЭ анодом будет являться хром, катодом — цинк.
Составляем схему ГЭ:
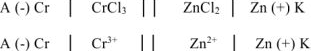
Составляем уравнения электродных процессов и суммарной токообразующей реакции:
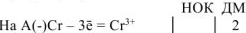
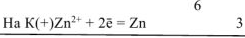
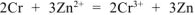 — суммарное ионно-молекулярное уравнение токообразующей реакции
— суммарное ионно-молекулярное уравнение токообразующей реакции
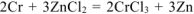 — суммарное молекулярное уравнение токообразующей реакции.
— суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
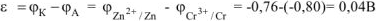
Ответ: 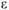 = 0,04В.
= 0,04В.
Задача 58.
Составить схему ГЭ, в котором протекает химическая реакция  . Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов
. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов 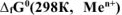 , рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
, рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
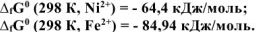

Решение:
На основании реакции, приведенной в условии задачи, составляем уравнения электродных процессов:

Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом — электрод, иа котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом — никель.
Составляем схему ГЭ:
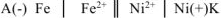
Рассчитываем стандартное напряжение ГЭ:

Рассчитываем константу равновесия токообразующей реакции (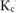 ).
).
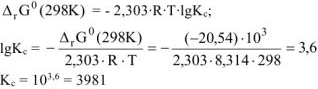
Ответ: 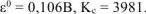 .
.
Задача 59.
Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 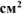 с никелевой в растворе соляной кислоты НС1. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
с никелевой в растворе соляной кислоты НС1. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 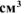 газа (н.у.).
газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 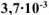 г. Плотность железа равна 7,9 г/
г. Плотность железа равна 7,9 г/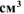 .
.
Решение:
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:

Так как 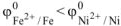 то анодом коррозионного ГЭ будет являться железо, катодом — никель.
то анодом коррозионного ГЭ будет являться железо, катодом — никель.
Составим схему коррозионного ГЭ:
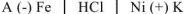
или
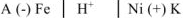
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
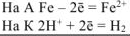
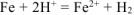 — суммарное ионно-молекуляриое уравнение процесса коррозии.
— суммарное ионно-молекуляриое уравнение процесса коррозии.
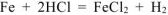 — суммарное молекулярное уравнение процесса коррозии.
— суммарное молекулярное уравнение процесса коррозии.
а)

Рассчитываем объемный показатель коррозии 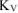 по формуле:
по формуле:
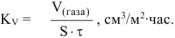
При расчете 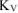 принимаем:
принимаем: 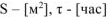 ,
, 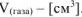 .
.
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, 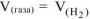 —
—
Тогда, 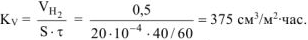 .
.
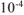 — коэффициент пересчета,
— коэффициент пересчета,  .
.
Рассчитываем весовой показатель коррозии 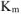 по формуле:
по формуле:
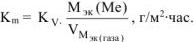
В процессе коррозии разрушению подвергается железо и выделяется водород.
Следовательно:
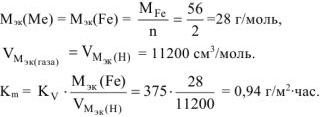
Ответ: 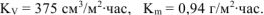
б)

Рассчитываем весовой показатель коррозии 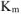 по формуле:
по формуле:
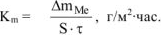
Коррозии подвергается железо. Тогда потеря массы металла
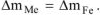
При расчете 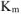 принимаем:
принимаем: 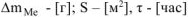 .
.
Тогда: 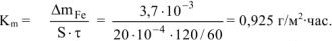
Рассчитываем глубинный показатель коррозии по формуле:
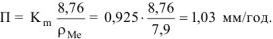
Ответ: 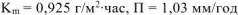 .
.
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:
| Гидролиз солей задачи с решением |
| Окислительно — восстановительные реакции (овр) задачи с решением |
| Электролиз растворов задачи с решением |
| Получение и химические свойства металлов задачи с решением |

