Оглавление:






Галоидные соединения
- Соединения галогенов. При взаимодействии с галогенами подавляющее большинство элементов выступают в роли металлов, поэтому теоретически возможные максимальные значения N в Формуле Эл, как правило, совпадают с числом соответствующих групп Е в периодической системе.
- Однако на практике это не всегда достигается. Если максимальная валентность этого элемента для различных галогенов неодинакова, то переход ряда F-C1-Bg-I всегда связан с его редукцией. Два В группе I〜IV периодической системы максимальная валентность элементов галогенного соединения, наблюдаемая на практике, в большинстве случаев совпадает с характеристикой. Исключения встречаются только в Cu, Ag и Au(и некоторых лантаноидах и Актинидах).напротив, в группе V-VIII теоретически возможная валентность, даже с фторидом, часто не достигается.
Термическая стабильность соединений галогенов серии F_Cl_Br_I постоянно снижается. Людмила Фирмаль
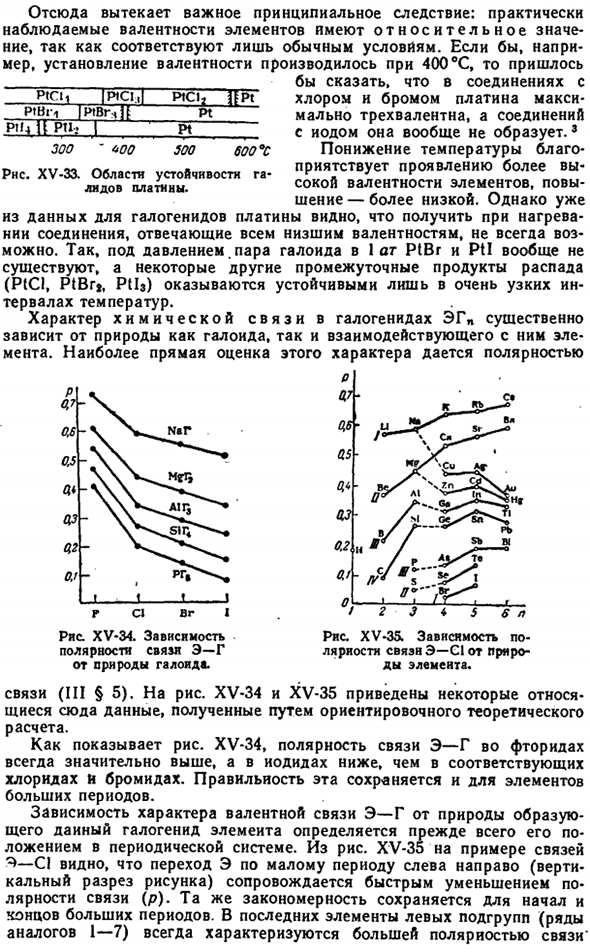
Разложение при нагревании сопровождается образованием соответствующих низших галогенидов. Каждый галогенид стабилен только в определенном температурном диапазоне (при определенном давлении пара).Например, для галлона платины (при давлении паров галогена 1 атм) область стабильности схематично показана на Рис.1. Совместим с XV-33 и следующими температурами(°C> s Валентность Пт. 。 。 4 3 2 1 O Хлорид…… < 370 370-435 435-581 581-583> 583 Бромид…… <335.335-405 405-410 — > 410 Я не собираюсь быть первым…… <263 263-272 272-355 — > 355 * О Х О Р ю.. Х * р д д.. Лиуа Р. химия металлоорганических соединений. С английского, Изд. И. Л. Кнуяница. М.. Издатель, 1963.360 секунд.
Носов п., Химик металлоорганических соединений.-Я не уверен, что делаю, — сказал он. ред. И. П. Берецкая. М. Мир. 1970.238 секунд Зеленый М. металлическое соединение переходного элемента. С английского, Изд. С п. Это хорошая вещь. М.. «Мир», 1972. 456 Е. А. Н. Несмеянов. Н.. Перевалов ® Е. Г.. Успехи химии, 196N, N 1, 3. Фредия П. Х.. Кабачник М. И.. От V до V rm a успехи в химии. 19″, М. Ю.1134. А. Н. Несмеянов. Н. успехи химии, 1959, Л«Ю, 1163. Суворов А. Л. Спасский С. С. успехи химии.
1959 год.«Я, 1267.» Wilkinson, J. K, F. Ton. Успехи химии, 1962, гл.7, 838. Разуваев, Г. А.. Латева, В. Н. успехи в химии. 1965, м » 4, 585. Р и С К и я И. и успехи химии, 1966, м. 3. 393.、 Дод ль Р.. Достижения в области химии. 1966.Л » 12, 2243. Фредерик П. Х. Кабачик М. И. Коршаку В. В. дает советы по химии. 1969, и 9, 1539、От этого вы получите важный и главный результат. Фактические наблюдаемые валентности элементов относительно значительны, так как они соответствуют только нормальным условиям.
Например, если валентность установлена на 400 ° 、 То есть в соединениях, содержащих хлор и бром, платина имеет до 3-валентность и вообще не образует соединений с йодом. Однако уже из данных по Галогенидной платине ясно, что не всегда удается получить соединения, соответствующие всем низким валентностям вследствие heating. So, под давлением. Оказывается, что 1-атомные галогениды PtBr и PtI вообще не существуют, а некоторые другие промежуточные продукты разложения (PtCl, PtBr*, Pt1h) стабильны только в очень узком диапазоне температур.
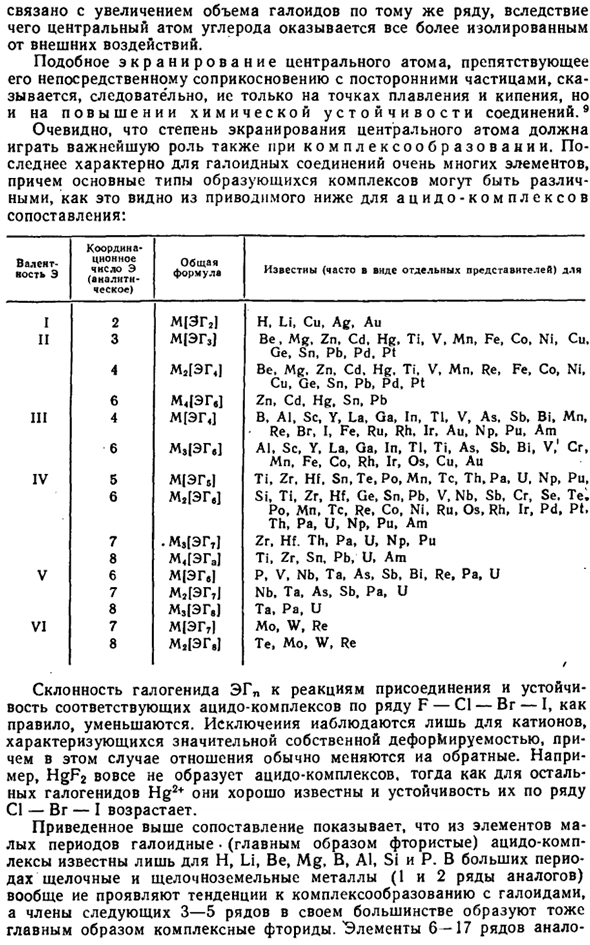
Природа химической связи ГАЛОГЕНИДА EHP в значительной степени зависит от природы галогена и элемента, взаимодействующего с галогеном. Наиболее непосредственную оценку этой характеристики дает полярность. 6р Марка, iPtci. я ptcij ifpt Пт НП / IVGhN пт Pll4 у птл, я пт 300. 500. 600°с Туалет РНС. ХV-33.Стабильная область галогенида платины. Рисунок Xv-34. Зависимость полярности электронной связи от природы галогена. Рисунок Xv-35.
Зависимость полярности связи е-С1 от природы элементов. Сообщение (III§ 5).Рисунки XV-34 и XV-35 являются частью приведенных здесь данных и получены путем приближенных теоретических расчетов. Как на фото. XV-34, полярность связи E-G фторида всегда заметно выше, а в йодиде она ниже, чем в соответствующем хлориде или бромиде.
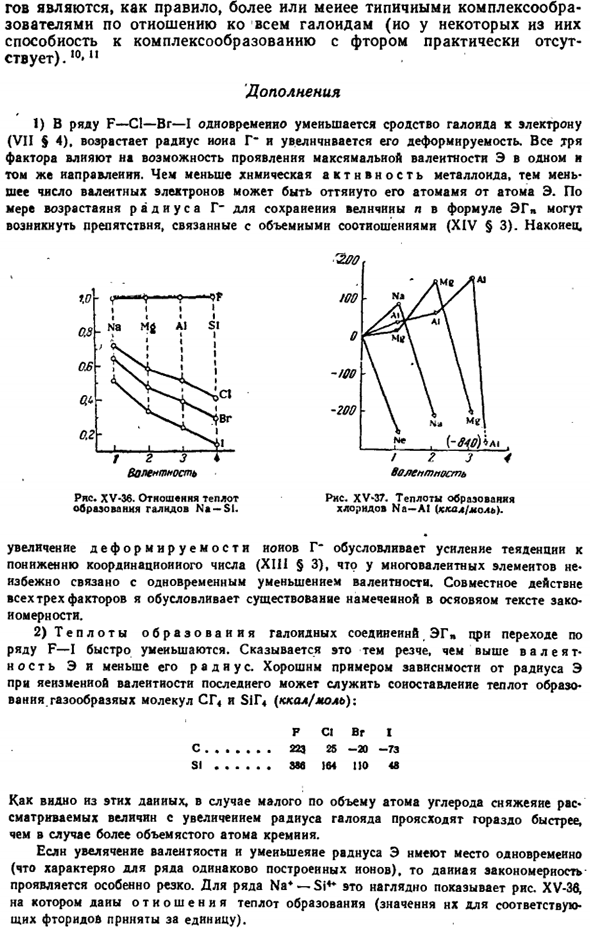
Эта правильность сохраняется для элементов большого периода. Зависимость природы Э-валентной связи —от природы элементов, образующих Галогенированное олово Эремита-во многом зависит от его расположения в периодической системе. Рисунок из примера соединения как XV-35 С1 показывает, что переход е (вертикальный разрез рисунка) за короткий промежуток времени слева направо сопровождается резким снижением полярности связей (Р).
Такая же картина применяется в начале и конце большого pattern. In последние, элементы левой подгруппы (аналоги от 1 до 7 рядов)всегда характеризуются большой полярностью связи. E-G, чем больше соответствующий элемент правой подгруппы (строки 11-17), и чем ниже валентность E, тем заметнее difference. As основное квантовое число (l) увеличивается, то есть при перемещении подгруппы сверху вниз, в рядах 1-7 полярность связи E-G периодически возрастает, но в рядах 11-17 ее максимум обычно наблюдается в элементах 5-го порядка period.
In в целом можно сказать, что галогениды с наибольшей полярностью связей соответствуют элементам левой и нижней частей, а минимальная полярность соответствует элементам правой и верхней частей расширенной формы периодической системы(стр. 4).4,5 Вышесказанное относится к отдельным молекулам, которые обычно соответствуют агрегатному состоянию газа. При переходе в жидкое, а затем в твердое состояние неорганические соединения могут образовывать 2 основных типа структур: молекулы и ions.
In в первом случае структура молекулы практически не нарушается, а вышеуказанные законы полярности связей остаются valid. In во 2-м случае, наоборот, индивидуальность каждой отдельной молекулы полностью утрачивается, и вещество приобретает свойства конкретного ионного агрегата(характерное многогранное воздействие на каждый ион всех его ближайших соседей).Очевидно, что понятие Союза полярности в рассмотренном выше смысле в данном случае неприменимо. Выбор того или иного типа агрегатной структуры (молекулы или иона) при переходе вещества из газообразного в жидкое и твердое состояние, по-видимому, зависит от многих факторов.
И так далее. Условий такого выбора быть не может generalized. By четко указывая, сколько именно составляет каждый тип структуры, он указывает на физические свойства рассматриваемого вещества, в частности его плавкость и летучесть: ионная структура характеризуется высокими температурами плавления и кипения, а молекулярная структура-низкой (III§ 8).
С этим галогеном поведение вариаций плавкости и волатильности производной в общих чертах для периодической системы согласуется с поведением, описанным выше для полярности связи. Огнестойкие и огнеопасные галогениды относятся в основном к нижнему левому элементу системы, плавкие и летучие элементы-к правому и верхнему. Однако часто наблюдаются плавкие и летучие всплески, которые не вызваны различиями в полярности связей.
Это следует, например, из следующего сравнения температур плавления и кипения периодических 3-элементных фторидных соединений: NeP M * P, AlPj SIP4 PPs SPel Температура Плавления, * C 995 1263 1040 −90 —94-61 (Да » Л. (Да другие) Температура кипения, ° С. 。 1785 2260 1257-95-85-64 Хотя полярность связей изменяется незначительно от A1F $до SiF (рисунок XV-34), первые соединения образуют ионные структуры, а вторые соединения образуют молекулярные структуры. Различное поведение обоих веществ в основном связано с неравным экранированием (затенением) центрального атома из-за окружающей среды. halides.
In каждая конкретная молекула алюминия не полностью экранирована 3″уникальными»фторами, поэтому она может легко взаимодействовать с»чужеродными».Напротив, малый кремний 4 ″ необходим «Фтора» достаточно для предотвращения подобных взаимодействий между одними и теми же «молекулами»SiF, в результате чего создаются необходимые условия для образования структуры ионного типа первым соединением и молекулярного типа вторым соединением. Зависимость плавкости и летучести галогенидов от свойств галогенов проявляется по-разному.
Если ионная структура существует, то температуры плавления и кипения серии F — CI — Br — I обычно уменьшаются с присутствием молекулярной структуры. Типичным примером является температура плавления и кипения (°C) галогенидов натрия и кремния. P CI Br 995 800 750 −90 −68 +5 (КР.) I F CI Br I 662 1785 1465 1392 1304 122 −95 +57 153 290 YAG Sif4 Первый закон основан на увеличении ионного радиуса ряда F-C1—Br-I (XIII§ 3). 2-я основная причина-это увеличение деформируемости одного и того же ряда галогенов, и это приводит к увеличению напряжения между отдельными молекулами за счет дисперсионного взаимодействия (III§ 7) 7 ″ 8
Характер изменения периодического цветового фенотипа галогенового соединения рассматривался ранее(XIII§ 3). по отношению к воде все растворимые галогениды грубо разделены на 4 группы, но они не четко отделены друг от друга. К первым элементам относятся производные элементов 1, 2 (кроме Be) и некоторые 3 аналога (La и его ближайшие соседи), Ag +и T1*.Все они подвергаются воздействию растворов электролитической диссоциации, которая практически не включает гидролиз. 2-я группа охватывает практически все остальные элементы и характеризуется наличием более или менее значительного гидролиза галогенидов ЭГП. E. чем выше валентность, тем меньше радиус.
- Если эти условия равны, то в правой колонке аналога (13-17) гидролиз более выражен, чем в левой (3-7). 3-я группа содержит очень мало индивидуальных галогенидов (HgCl2, Cdl2, PtCl4, AuCl и др.) и почти не гидролизуется из-за относительно слабой диссоциации. Однако в некоторых из них (PtCU, AuCl3 и др.), например, согласно схеме характерно добавление молекул воды с образованием сложных гидрокислот (XII§ 2) 2H20 + PtCl4 = H2 [(HO)2PtCl4] Наконец, 4-я группа включает несколько галогенидов (CCU, NCI3,SFe, OF2 и др.) большинства полуметаллических элементов. Все они слабо растворяются в воде и практически не подвергаются электролитической диссоциации.
По этой причине в нормальных условиях гидролиз протекает несколько медленно, но на практике его также можно считать полностью недоступным. Однако, в конце концов, он обычно работает отлично. . So например, гидролиз CC14 протекает медленнее, чем гидролиз COC12, но в обоих случаях полярность связи C — C1 должна быть примерно одинаковой. Аналогичным образом, значительное замедление гидролиза ряда COF2-СОС12-СОВГ2 несомненно、
Медленность химического взаимодействия с водой таких соединений, как CC14, 8F6, обусловлена не низкой полярностью связей, а тем, что их центральные атомы почти полностью закрыты halogen Людмила Фирмаль
Из-за увеличения количества галогенов в том же ряду, в результате, Центральный атом углерода все больше изолировался от внешних воздействий. Таким образом, такое экранирование центрального атома, которое предотвращает прямой контакт с посторонними веществами, влияет не только на температуру плавления и кипения, но и на повышенную химическую стабильность соединения. Очевидно, что степень экранирования центрального атома также должна играть важную роль в комплексообразовании. Последние являются свойствами галогенных соединений очень многих элементов, и основные типы образующихся комплексов могут быть различными. Это видно из сравнения следующих кислотных комплексов:
Тенденция реакции присоединения галогенидов EH и стабильность соответствующих ацидоидных комплексов серии F-C1-Bg-I, как правило, снижаются. Исключения наблюдаются только для положительных ионов, которые характеризуются ярко выраженной присущей им деформируемостью, и в этом случае соотношение обычно меняется, и наоборот. Например, HgF2 не образует никаких кислотных комплексов вообще. С другой стороны, хорошо известно об остальных галогенидах Hg2 +и улучшена стабильность в серии C1-Br-I. Приведенное выше сравнение показывает, что из минорных периодических элементов галоген•(главным образом фторид) кислотный комплекс известен только для H, Li, Be, Mg. Б, А., С., и П.
В крупных периодов, щелочных и щелочноземельных металлов(I и 2 ряда аналогов), как правило, показывают тенденцию к комплексообразования с галогенами, и в ближайшие 3-5 ряда членов в большинстве случаев также являются преимущественно комплексный фторид. Элемент 6-17 ряд аналоговый Как правило, они являются более или менее типичными комплексообразователями по отношению ко всем галогенам (у некоторых из них способность образовывать комплексы с фтором практически отсутствует).
Добавь 1) в ряду F_CI_Br_I одновременно уменьшается сродство галогена к электрону (VII $ 4), увеличивается радиус Иона T и увеличивается его деформируемость. Все 3 фактора Е в 1 н в одном направлении. Максимальная валентность выражения потенциала влияет. Чем ниже химическая активность металлоида, тем меньше число валентных электронов, которые могут быть выведены из его атома E. Если радиус Γ увеличивается для поддержания значения l в Формуле EG, то может возникнуть нарушение, связанное с объемным соотношением (XIV§ 3).
Рисунок XV-Sv. Диаграмма тепловых отношений XV-37.Температура образования Образование Al-id в Na-SI. Хлорид На-А! (Хикару / мол). Увеличение деформируемости Γ-Иона вызывает усиление тенденции к уменьшению числа координаций (XIII§ 3).Это обязательно связано с одновременным уменьшением валентности в случае многовалентного элемента. Совокупное воздействие всех 3-х факторов определяет наличие узора, очерченного в тексте оси. 2)теплоты образования Галоидных соединений, например, при прохождении через ф-я серия быстро уменьшается. Это означает, что чем выше е затухает, тем меньше радиус, тем больше эффект.
Хорошим примером зависимости последнего от неизменного валентного радиуса Е является сравнение Терро-тов образования молекул газа SG и Sir4(ккал / моль: Р! ВГ Я С……. 223 25-20-73 СИ…… 38v 164 программное обеспечение 48 Как видно из этих данных, Если атом углерода мал, то удаление количества, учитываемого при увеличении радиуса галояда, будет намного быстрее в случае большего атома кремния. Если увеличение валентности и уменьшение радиуса мест ® происходят одновременно(это характерно для большого числа равномерно составленных ионов), то эта закономерность особенно выражена.
Для серии Na * — Si4* это четко показано на рисунке. Указывают поправку на теплоту образования XV-Sv (величина соответствующего фторида берется за единицу). Теплота образования 18 электронов и галогенных соединений катионов с омической или незаконченной внешней оболочкой всегда значительно ниже, чем у катионов типа инертного газа с таким же зарядом и близким радиусом, и если переключить ряд F-I, то разница между 2 становится более заметной. Вышеуказанная закономерность отражена данными сводной таблицы (ккал / г-ЭКБ). 30 используя закон Гесса, можно приблизительно рассчитать теплоту образования большого количества галогенных соединений, соответствующих аномальной валентности элемента.
На рисунке сравниваются приближенные значения производимой теплоты различных хлоридов Na-A1, найденных аналогичным образом. XV-37 с известным значением NaCl. MgCl *и A1SC (верхний).На рисунке показано образование избыточного валентного соединения, такого как NaClj.1. один из электронов в неоновой оболочке десорбируется, например MgCli, происходит только тогда, когда поглощается очень большое количество циркия. Напротив, образование соединения, соответствующего неполой валентности, происходит с выделением энергии (рис. XV-37).Но для большинства малоценных элементов их гораздо меньше, чем тех, которые соответствуют обычному валентному выражению.
Поэтому обычно нет необходимости встречаться с такими соединениями, как MgCl, AlCl, но некоторые из них доступны при особых условиях(XI§ 2 add.88 и XII§ 1 добавить. См. 73).Для многовалентного элемента положение часто меняется на противоположное, и наиболее устойчивой производной является не максимальная, а та, которая соответствует более низкой валентности. 4) полярность связи обычно связана со значением ядерного расстояния соответствующей молекулы.
Таким образом, фторидное производное элемента элемент во 2-м периоде характеризуется следующими сутками. 3Ф Гэ + п Ух… Результаты расчета графически отображаются на диаграмме. Xv-38.As вы можете видеть, что для рассматриваемого соединения зависимость обычно обусловлена характером гладкой кривой, а для очень разных полярностей связи она может быть представлена приблизительно прямой линией (см. Рисунок X-64£). 5) ниже приведен пример формального эффекта, вычисленного с помощью некоторого простого числителя и значения электрического спектра Центрального атомного заряда Иона.
BFj BC1z BBg, Bis CF при изменении структуры OA p может произойти аналогичный скачок. Например, YC1 $1.06 A (8 электронов) расплавится при 700,T1Cb E-F A — ’ 8 электронов) расплавится при 155 ° C. Это хорошая идея. 7) например * молекулы одного и того же type. In центр Один атом полностью экранирован, и они могут взаимодействовать только с окружающими атомами галогена. При увеличении поляризации последнего центральным атомом поляризуемость атома галогена уменьшается. Энергия дисперсионного взаимодействия пропорциональна произведению поляризации ядра, поэтому Центральный атом слабее с эффектом поляризации.
Это связано с некоторыми закономерностями, характерными для периодической системы elements. So в этот же период железы (8 электронных е) элементов левой подгруппы имеют более высокую температуру кипения, чем железы (18 электронных е) правой подгруппы того же типа. Например, TiCU кипит при pr 136, в то время как GeCU кипит при 86 ° C(несмотря на высокую молекулярную массу 2-го соединения).
При усилении поляризационного эффекта E в результате сжатия лантаноидов температура кипения галогенидов Hf, Ta и W ниже, чем у аналогичных галоидных Zr, Nb и Mo. Молекулярный вес удивительно низок. Например. MoFj (Af-210) * ipit на 35, и на WFe (Л1-298) −17°С. Похожий случай (III§ 7 постскриптум 9), представляющий собой явное исключение из общепринятой схемы. На самом деле у нее есть общие причины. 8) интересный пример смешанной зависимости температуры плавления от свойств галогенов дают тяжелые лантаноиды: переход от фторида к хлориду сопровождается резким падением этих температур и дальнейшим переходом к бромидам и Йоду, они постепенно увеличиваются(добавление XI 6).Аналогичная ситуация в отношении температуры кипения, ч? Особенности G3(XII§ 4, дополнение.61). г
9) эффекты экранирования четко проявляются, особенно в случае простых обменных реакций между соединениями, которые распадаются на ions. As показано * Г * н от Л-М. П. Туманов Ю. Н.. Достижения в области химии. 1971, м. 2.276. Эксперимент, хлорид, бромид, йодид P. As, Sb (тип EG$) и Ti. При смешивании Ge, Sn (типа EG) они обмениваются друг с другом в любом сочетании. Между галогенами и исходными веществами, полными метаболитами, различными смешанными галогенидами устанавливается определенное равновесие.
Напротив, подобный галогенированный углерод не участвует в таких обменных реакциях. Это связано с тем, что галогенид c совместного предприятия полностью экранирован. Это делает невозможным обмен временного притяжения на 2-1 центральный атом Галогенида реагента. Кремний занимает среднее положение. Очевидно, что только Сиф заменит его другими гардумами. 10) Как упоминалось ранее (XIII§ 3 add.19), так же, как и галогенид-Ион, обнаруживается в первую очередь CN-Ионом. Сравнение характерных типов кислотных комплексов приведено в таблице.
Для сложных анионов[3 (CN) e] 5′ получается следующая последовательность относительной стабильности: мы готовы ответить на ваши вопросы по упаковке, логистике, сертификации или любым другим аспектам о фрезерном станке с ЧПУ, фрезерном станке с ЧПУ Machine.
In в элементах триады стабильность однотипного цианидного комплекса повышается сверху вниз. II) расчет распределения суммарного отрицательного заряда свободных ионов (: C «N:] -, основанный на электрических концентрациях атомов l£c-1.25 и Сг* 1.90) приводит к значениям с и-0—0.38. В случае, 62, то есть N, то есть большая часть заряда сосредоточена в атоме азота.
Для отдельных ионов приближенные расчеты с использованием обратного распределения поля[Fe (CN) e] * — (Ep «0.46) и (Fe (CN) el5» где = 0, 53) A = = / $(для насыщенных углеводородов) Ee = 1.68 приводят к следующему уравнению: +0.50 −0.11–0.64 +1.14 —0.07—0.62 Это домашняя страница Tomcat по умолчанию.- Очевидно, что указанное распределение заряда достаточно близко к фактическому распределению заряда. Молекулярно-орбитальный метод (XIV§ 3 add. It можно отметить, что аналогичный результат был получен при расчете lNi (CNb] 3-ионов по 106): −0,43 (свободные ионы CN) или −0,14 (комплексы) C для атомов и+0,46 для атомов N1.
Смотрите также:
| Элементы в химии | Окислы и их гидранты |
| Водородные соединения | Соли кислородных кислот |

