Оглавление:




Физико-химический анализ
- Физико-химический анализ. Обычные методы химического анализа позволяют определить состав наиболее сложных соединений, но в некоторых случаях этого недостаточно. Это связано с тем, что для установления состава путем химического анализа, прежде всего, необходимо выделить исследуемое вещество в его индивидуальном состоянии. Если такое разделение по каким-то причинам невозможно, то метод химического анализа также будет неприменим.
- В таких случаях метод физического исследования может быть очень полезен. Это отметил и М. В. Ломоносов.«Сочетание физической и химической истины облегчает распознавание скрытой природы тела», — писал он в своей книге. 1749.In условия часто удается не только обнаружить наличие в нем химических превращений, но и проследить ход последних и получить определенные инструкции по свойствам и составу образующегося продукта.
Обнаружение и изучение химических изменений, происходящих в системе, подлежит физико-химическому анализу. Людмила Фирмаль
Обобщенная интерпретация как самостоятельное научное направление базируется на Н. С. Курнаков (1913) дано 1 Например, подумайте о том, какую информацию вы получите, когда изучите скорость охлаждения. Для всего определения предварительно нагретое вещество охлаждают через равные промежутки времени, обращая внимание на его температуру. Результат наносится на график с временем, нанесенным на ось абсцисс, и температурой материала, нанесенного на вертикальную ось.
Кривая охлаждения, полученная этим методом, станет основой для дальнейших выводов. Если при охлаждении системы не происходит внутренних изменений с выделением тепла, то ее температура будет непрерывно падать (на схеме на рисунке XI-22 она соответствует линии а).Наоборот, когда происходят такие изменения, возникает временная задержка в охлаждении системы.
Например, сначала охлаждают водяной пар, нагретый до 150°С под атмосферным давлением (рис. XI-22, б). сначала его охлаждение протекает непрерывно, но при 100°С пар начинает конденсироваться с жидкой водой, что сопровождается выделением тепла-на кривой охлаждения появляется остановка, температура некоторое время не меняется(пока продолжается образование воды), т. е. кривая проходит параллельно горизонтальной плоскости. axis.
In кроме того, от 100°С до нуля происходит постепенное охлаждение жидкой воды, и кривая снова непрерывно уменьшается. Но при 0°С вода начинает замерзать, что опять же сопровождается heat. In кривая охлаждения, время, необходимое для замораживания всей доступной воды, помечается новой остановкой, то есть участком, параллельным горизонтальной оси. Охлаждение льда снова продолжается.
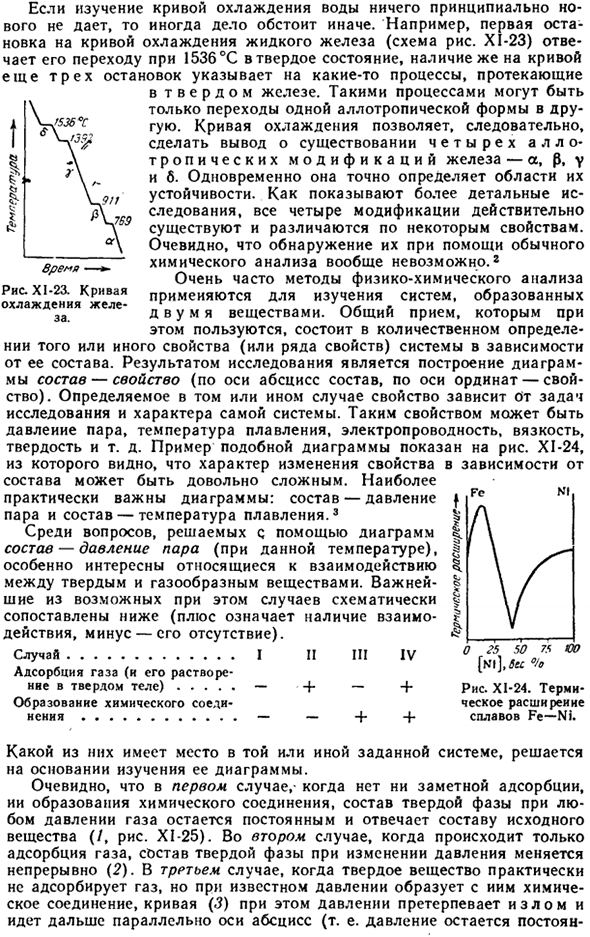
Если исследование кривой водяного охлаждения не дает принципиально нового результата, то ситуация может быть иной. Например, первая остановка кривой охлаждения жидкого железа (рис. Х1-23) соответствует переходу в твердое состояние при 1536 ° С, но наличие еще 3 остановок в Кривой указывает на некоторые процессы, происходящие с твердым железом.
Такой процесс является лишь переходом от одного аллотропа к другому allotrope. So, из кривой охлаждения можно сделать вывод, что железо имеет 4 аллотропных варианта (os, 0, y, b).в то же время оно точно определяет площадь stability. As более детальное исследование показывает, что все 4 модификации на самом деле присутствуют и отличаются некоторыми характеристиками. Очевидно, что их вообще невозможно обнаружить с помощью обычного химического анализа.
Чаще всего метод физико-химического анализа используется для изучения систем, которые образуются из 2-х веществ. Общий метод, используемый в этом случае, заключается в количественном определении конкретных свойств (или количества свойств) системы в зависимости от ее конфигурации. Результатом исследования является построение композиции. Диаграмма свойств (конфигурация вдоль горизонтальной оси и свойства вдоль вертикальной оси).
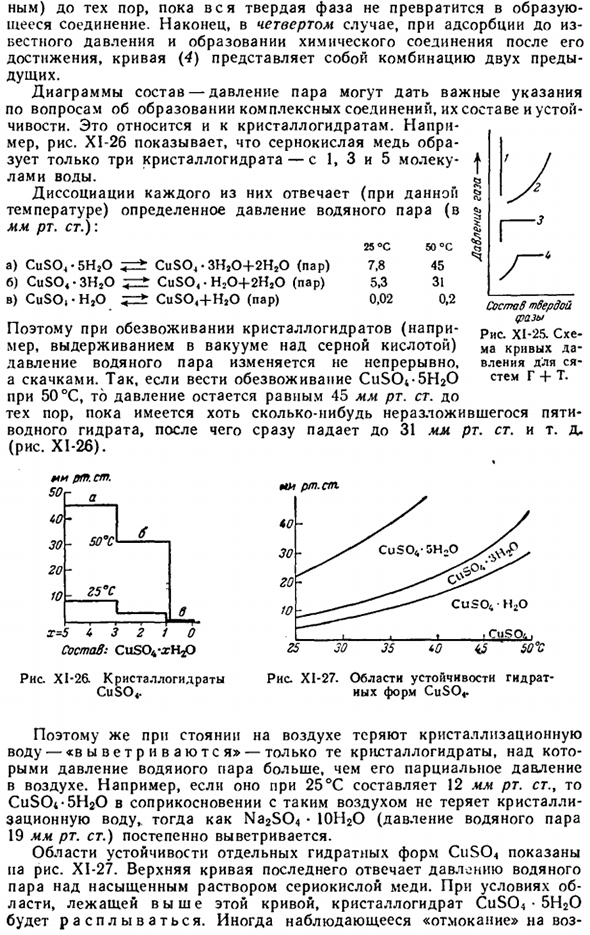
Характеристики, которые определяются в конкретном случае, зависят от цели исследования и характера самой системы. Такими свойствами могут быть: давление пара, температура плавления, проводимость, вязкость, твердость, etc. An пример такой фигуры показан на рисунке 2. В XI-24 мы видим, что характер изменения свойств в соответствии с составом очень сложен. Наиболее практически важным показателем является состав-давление пара и состав-температура плавления 3.
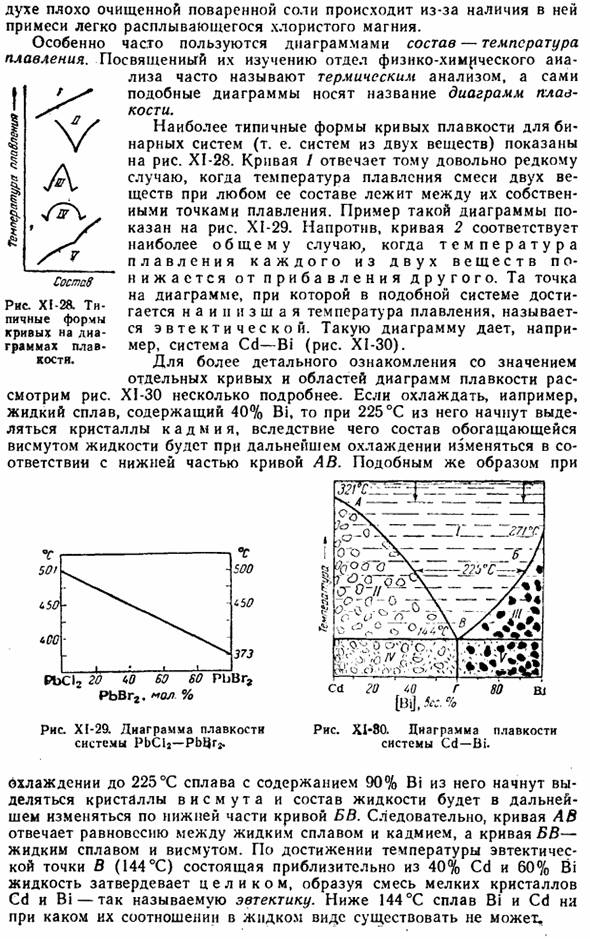
Среди задач, решаемых с помощью диаграмм состав-давление пара (при заданной температуре), особый интерес представляют задачи, связанные с взаимодействием твердых и газообразных веществ. Схематично сравните наиболее важные случаи, рассмотренные в данном случае (плюс означает наличие взаимодействия, минус-отсутствие). Случай…………. Я ВТОРОЙ III IV Адсорбция газов (и растворение в твердых телах)….. Образование соединений То, что делается в той или иной системе, определяется на основе рассмотрения рисунка.
По-видимому, в первом случае, когда нет выраженной адсорбции или образования соединения, состав твердой фазы при любом давлении газа остается постоянным и соответствует составу исходного материала ( / , фиг. XI-25). Во 2-м случае, когда происходит только адсорбция газа, состав твердой фазы непрерывно изменяется с изменением давления(2).
В 3-м случае, если твердое вещество фактически не адсорбирует газ, а образует с ним соединение при определенном давлении, кривая (3) ломается при этом давлении и становится еще более параллельной абсциссе (то есть давление остается постоянным).) J536cc Время есть Диаграмма XI-23.Кривая охлаждения утюга. 25 50 [K|], Bsc° / о Диаграмма XI-24.
Тепловое расширение сплава Fe-Ni. — + — + — + — + n) вся твердая фаза получается, чтобы стать соединением. Наконец, в 4-м случае, когда адсорбируется до известного давления, и после его достижения образуется соединение, кривая (4) становится комбинацией предыдущих 2 кривых. Диаграммы состав-давление паров могут служить важным руководством по формированию, составу и стабильности комплексных соединений.
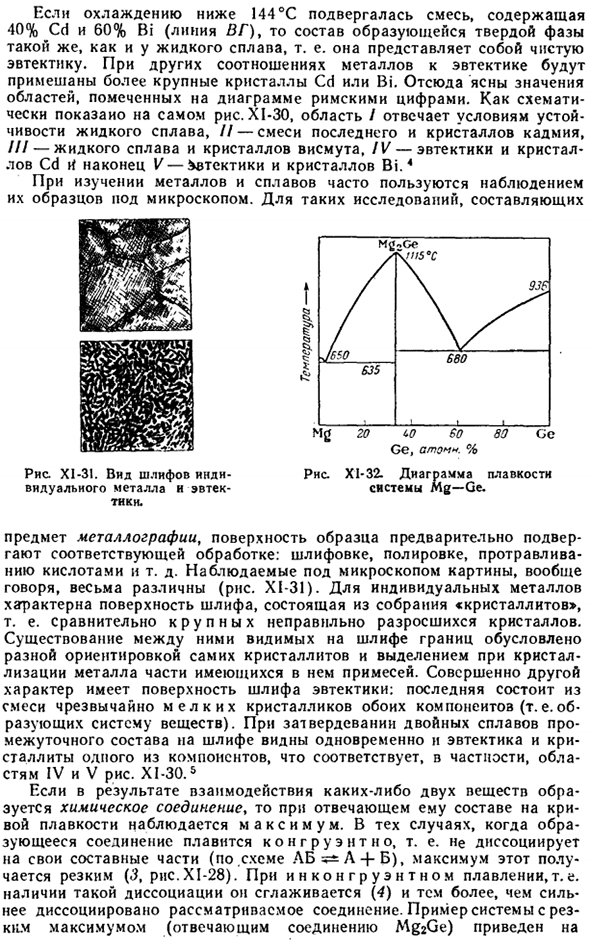
Это также относится и к кристаллическим гидратам. Например, на рисунке XI-26 показано, что сульфат меди образует только 1, 3 и 5 молекул воды в 3 кристаллогидратах. Диссоциация каждого из них соответствует определенному давлению(мм рт. ст.) водяного пара (при определенной температуре). 25°C 50°C а) CuS 0 Диаграмма XI-26. Гидрат журнала Так, при стоянии в воздухе кристаллическая вода теряется — «ветер поднимается, он исчезает» — только кристаллические гидраты, давление водяного пара которых выше парциального давления в воздухе.
Например, при 25°C и 12 мм Hg. As как правило, CuS0t-5H20 при контакте с таким воздухом не теряет кристаллической воды, но Na2S04•UN20 (давление водяного пара 19 мм рт. ст.) постепенно разрушается. Стабильные области отдельных гидратированных форм CuSO показаны на рисунке. XI-27.Кривая над последней соответствует давлению водяного пара на насыщенный раствор сульфата меди. При условии области выше этой кривой кристаллический гидрат CuS04•5H20 размыт.
Иногда наблюдается «погружение» Дух недостаточно очищенной поваренной соли обусловлен наличием примесей, которые легко распространяются на хлорид магния. Особенно хорошо используется состав диаграммы-температура плавления. Отдел физико-химического анализа, посвященный их изучению, часто называют термическим анализом, и я думаю, что сама такая фигура называется плавающей фигурой. ’^^Кость.
Наиболее типичная форма кривой плавкости бинарной системы (то есть системы из 2 веществ) показана на рисунке. XI-28.Кривая/соответствует достаточно редкому случаю, когда температура плавления смеси из 2 веществ произвольного состава находится между точками плавления каждого из них. them. An пример такой схемы показан на рисунке. XI-29.
Напротив, кривая 2 соответствует наиболее распространенному случаю, когда температура плавления каждого из 2 веществ уменьшается с добавлением других веществ. Точка диаграммы, где в такой системе получается самая низкая температура плавления, называется эвтектикой. Такие диаграммы предоставляются, например, системой Cd-Bi (рис. XI-30). Рассмотрим рисунок для получения дополнительной информации о значениях отдельных кривых и площади диаграммы плавления.
XI-30-это немного больше деталей. Например, при охлаждении жидкого сплава, содержащего 40% Bi, кристаллы кадмия начинают осаждаться при 225°C, и в результате состав богатой висмутом жидкости изменяется по мере дальнейшего охлаждения в соответствии с нижней частью кривой A. B. Рисунок Х1-29.Рисунок XI-80 из легкоплавких материалов. Плавкая фигура Система PbClj-PbCrz. Система CD-Би.
Когда сплав с 90% содержанием Bi охлаждается до 225°C, кристаллы висмута начинают осаждаться, и состав жидкости изменяется вдоль нижней части кривой BV. Таким образом, кривая AB соответствует равновесию между жидким сплавом и кадмием, а кривая BV соответствует жидкому сплаву и висмуту. При достижении температуры эвтектической точки в (144°с) жидкость, состоящая примерно из 40% Cd и 60% Bi, полностью затвердевает, образуя мелкокристаллическую смесь Cd и Bi-так называемую эвтектику. Ниже 144 ° С сплавы Bi и Cd не могут существовать в жидких соотношениях.
Состав Рис. Х!-2 и Т-образные кривые. Если смесь, содержащую 40% Cd и 60% Bi (линия VG), охлаждают до температуры менее 144°С, то состав образующейся твердой фазы такой же, как и у жидкого сплава. То есть чистая эвтектика. Для других металлов соотношения более крупные кристаллы Cd или Bi смешиваются с эвтектикой. Отсюда значения областей, отмеченных римскими цифрами на рисунке, будут равны clear.
As схематично показано на рисунке. XI-30, область / соответствует стабильным условиям жидкого сплава, / / / — смеси кристаллов кадмия с последним, / / / — жидкого сплава и Кристалла висмута, IV-эвтектики и Кристалла CD rf, и, наконец, V-эвтектики и Bi.4 кристалла При изучении металлов и сплавов часто используют наблюдение образцов под микроскопом. Для таких исследований Рисунок Х1-31.Вид тонкого сечения отдельных металлов и эвтектики. Гэ / точка. % Рисунок XI-32.
- Схема плавления системы Mg-Ge. Поверхность образца, являющегося объектом металлографии, предварительно обрабатывается соответствующей обработкой (шлифовка, полировка, травление кислотой и др.).Фотографии, которые наблюдаются под микроскопом, как правило, очень разные(рис. XI-31).Отдельные металлы характеризуются тонкой поверхностью поперечного сечения, состоящей из агрегатов микрокристаллов, то есть относительно крупных и неравномерно выращенных кристаллов.
Наличие видимых границ между ними в тонких сечениях обусловлено различной ориентацией самого кристаллита и выделением некоторых примесей, присутствующих в металле при кристаллизации. Последний состоит из очень маленькой кристаллической смеси обоих компонентов (то есть образует систему веществ).
Поверхность эвтектического разреза обладает совершенно иными свойствами. Людмила Фирмаль
При упрочнении бинарных сплавов промежуточного состава одновременно видны эвтектика и микрокристалл компонентов 1, особенно в тонких сечениях, соответствующих участкам IV и V на Рис.4. Си-30.5 Если соединение образуется в результате взаимодействия каких — либо 2 веществ, то в соответствующем его составе максимальное значение наблюдается на кривой плавления.
Если полученное соединение совпадает и плавится, то есть не диссоциирует на составные части (по схеме AB ^ A + B), то этот максимум заостряется («3, Рисунок XI-28»).Если нет плавления, то есть такой диссоциации, то она сглаживается(4), то чем больше, тем интенсивнее диссоциация рассматриваемого соединения. Примеры систем с резкими максимальными значениями (соответствующими соединениям Mg2Ge)、 Рисунок XI-32.
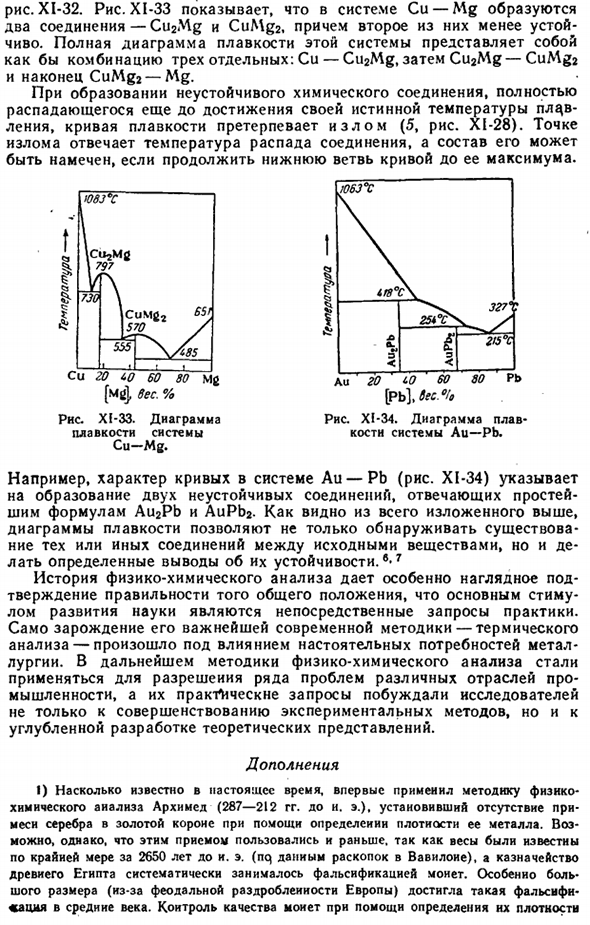
На рисунке XI-33 показано, что в системе Cu-Mg образуются 2 соединения (Cu2Mg и CuMg2).Полная схема плавления этой системы представляет собой комбинацию из 3 отдельных: Cu-Cu2Mg, затем Cu2Mg-CuMg2 и, наконец, CuMg2-Mg. Когда образуется нестабильное соединение, которое полностью разлагается до достижения истинной температуры плавления, на кривой плавления возникает излом (5, Рис. XI-28).
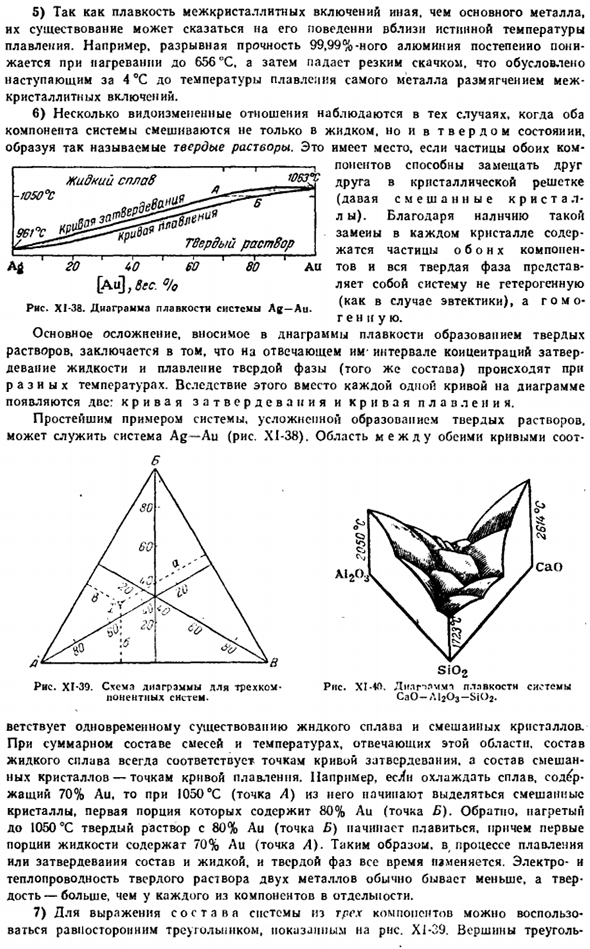
Точка останова соответствует температуре разложения соединения, и если продолжить нижнюю ветвь Кривой до ее максимума, то можно дать обзор ее состава. / 063°с 1G8°C \ 327″: х / л. а. Н я — » −215°С Е <3 Au 20 LO 60 80 Pb [Pb до 6ec° Диаграмма XI-34. Схема плавления системы Au-Pb. Например, характер кривой системы Au-Pb (рисунок XI-34) показывает образование 2 нестабильных соединений, соответствующих простейшим формулам Au2Pb и Aupp2.
As как видно из вышеизложенного, плавильный чертеж позволяет не только обнаружить наличие определенных соединений между исходными материалами, но и сделать определенные выводы об их стабильности. Семь История физико-химического анализа дает особенно четкое подтверждение правильности общего положения о том, что непосредственным стимулом развития науки является прямая просьба практики.
Появление термического анализа, его важнейшей современной методологии, произошло под влиянием насущных потребностей metallurgy. In в дальнейшем методы физико-химического анализа стали использоваться для решения многих задач в различных отраслях промышленности, а их практические потребности позволили исследователю не только усовершенствовать экспериментальные методы, но и основательно разработать теоретические концепции.
Добавь I) насколько теперь известно, он впервые применил метод физико-химического анализа к Архимеду (287-212 гг. до н. э.).Однако этот метод, возможно, использовался и раньше, поскольку масштаб был известен по меньшей мере 2650 лет назад. э. (Раскопки в Вавилоне), сокровищница Древнего Египта систематически занималась подделкой монет.
Особенно большой*(из-за феодальной раздробленности Европы) достиг такой фальсификации в середине века. Контроль качества монет путем определения плотности Диаграмма XI-33. Схема плавления системы Cu-Mg. Она подробно изложена в книге»весы мудрости»(1121) арабского ученого аль・Кази. О правильности его методики свидетельствует тот факт, что приведенное им значение плотности металла практически ничем не отличается от современного.
2) переход вещества от одной модификации к другой (от ромбической серы к моноклинной, от кристаллогидратов к безводным солям и т.) обычно сопровождается заметным изменением объема системы. Вы можете использовать его для определения температуры (точки преобразования), при которой происходит такой переход. Основанный на изучении изменения объема системы при нагреве (или охлаждении), метод физико-химического анализа не называется детандером.
Общие характеристики кривой расширения показаны на рисунке. X1-35: первоначально нагрев системы сопровождается лишь постепенным изменением объема, но в момент трансформации объем изменяется несколько резко. Температура, соответствующая кручению кривой, является точкой трансформации испытуемого материала, ниже которой одна форма стабильна, а другая форма стабильна. Для измерения детандера можно использовать пикнометр с длинной капиллярной трубкой, возле которой закреплена шкала (рис. Х1-36).
Бутылка удельного веса почти полностью заполнена тестируемым веществом и наполнена какой-то жидкостью, которая с ним не взаимодействует. Затем сосуд нагревают (или охлаждают) очень медленно, и через короткие промежутки времени положение мениска жидкости в капилляре помечают галочкой. 1 23 * 56789 Время 100%интернет CucmaS В0% 6 Диаграмма XI-37. diegrmmm ^схема построения плавкости за счет кривой охлаждения. 3) Состав для представления состава на рисунке-характеристики бинарной системы обычно используют по 1 атому (молекулярному) проценту массы или вещества.
Первый метод более удобен с практической точки зрения, но второй метод по своей сути точен, поскольку позволяет четко видеть химическое соотношение рассматриваемой системы. 4) на практике кривая плавления обычно создается на основе кривой охлаждения. После создания и плавления смеси веществ а и в в определенном составе (например, от 1 до 9 проходов, рисунок Х1-37), вы получите кривую охлаждения, соответствующую этим mixtures.
It это температура плавления чистого компонента и затвердевания и отклонения эвтектики, которые остаются в последнем. Это происходит, когда тепло кристаллизации выделяется из охлаждающего расплава определенных компонентов. Совсем как охлаждение сплавов (металлов, солей и др.), явление происходит во время замораживания растворов. Компонентами в данном случае являются растворенные вещества и растворители. Температура- Диаграмма XI-35.Отображает кривую расширения.
5) плавкость зернограничных включений отличается от плавкости основного металла, поэтому их присутствие может влиять на их поведение вблизи истинной температуры плавления. Например, прочность на растяжение 99,99% алюминия уменьшается постепенно при нагревании до 656°С, а затем резко. Это связано с размягчением межзеренных включений, которое происходит при температуре 4°с относительно температуры плавления самого металла.
6) если оба компонента системы смешиваются не только в жидком, но и в твердом состоянии, образуя так называемый твердый раствор, то наблюдается несколько измененных соотношений. Это верно, если частицы обоих компонентов могут быть заменены друг на друга в кристаллической решетке (для получения смешанного Кристалла).При наличии такого замещения каждый кристалл содержит частицы обоих компонентов, и вся твердая фаза представляет собой однородную систему, а не неоднородную систему (как в случае эвтектики).
Диаграмма плавкости твердого тела Основная проблема, поставленная решением, заключается в том, что затвердевание жидкости при различных температурах и плавление Солидуса (одного и того же состава) происходят в соответствующей концентрации range. As в результате вместо каждой кривой на диаграмме показаны 2 кривые коагуляции и плавления. Простейшим примером системы, осложненной образованием твердого раствора, является система Ag-Au (рис. XI-38).
Площадь между обеими кривыми равна、 Шесть Диаграмма XI-39. 3 Схема компонентной системы. Жидкого сплава и смешанных кристаллов присутствуют одновременно. На общий состав и температуру смеси, соответствующей этой сфере, состав жидкого сплава всегда соответствует точке кривой коагуляции, а также состав смешанных кристаллов соответствует точке кривой плавления. Например, если вы охлаждаете сплав, содержащий 70% Au, то при 1050°C (точка а) начинают осаждаться смешанные кристаллы, первая часть которых содержит 80% Au (точка 5).%Au (точка B) начинает плавиться, и первая часть жидкости содержит 70% Au (точка A), поэтому состав как жидкой фазы, так и твердой фазы постоянно меняется в процессе плавления или затвердевания.
Электрическая и теплопроводность твердого раствора из 2-х металлов обычно низкая, а твердость-у каждого компонента происходит индивидуально. 7) для представления состава системы из 3-х компонентов можно использовать равносторонний треугольник, который обозначен в RNS. Х1-39.Пики труэгола- Любовь О. Рисунок X1-38.
Схема плавления Ag-системы УО 60 [Ас];вес. % A12C>、 Солнце. Si02 Диаграмма XI-40.Фигура?) Плавкость системы Ca0-L1203-b / 02. Инка представлена чистыми веществами А, В и С. Каждая высота берется за 100, а ее доля представляет собой процент этого компонента в системе. Сумма длин всех трех перпендикуляров, упавших в сторону от любой точки внутри равностороннего треугольника, равна его высоте (то есть 100), поэтому каждая точка фигуры соответствует определенной конфигурации, соответствующей длине этих перпендикуляров.
Например, точка x имеет 50% L, 30% B и 20% C. 3. значение изучаемых свойств компонентной системы может быть нанесено перпендикулярно плоскости композиционной диаграммы (в любом масштабе).Результатом является конфигурация и свойства различных диаграмм в пространстве. XI-40 в качестве примера показывает аналогичный пространственный план действительно важной системы CaO-L12O3-SiOj. Для его построения экспериментально было определено около 7000 точек.
Смотрите также:
| Бор | Подгруппа галлия |
| Алюминий | Подгруппа скандия |

