Оглавление:










Элементы в химии
- Элементы. одним из важнейших практических свойств элементных элементов является их распространенность. Ниже приводится сравнение атомных процентных значений наиболее распространенных элементов земной коры. 1.52.32 2. Ч £ 16.95 3. $ 1 16.67 4. АИ 5.53 5. На 1.95 6. Фе 1.50 7. Ка-1.48 в 1L2 1.39 9. К 1.08 10. Л 0.22 11. С 0.14 12. Р 0,04 13. Мп 0.03 14. Н 0.03 15. С-0.03
- Как показывают данные, из общего числа компонентов земной коры (3 оболочки, все 1 —воздух, вода и верхняя часть твердого тела) 99,4% атомов занимают только 15 элементов, а все остальное содержание составляет только 0.6%.It интересно отметить, что наиболее распространенные элементы имеют относительно небольшой положительный ядерный заряд.
Большинство элементов в нормальных условиях характеризуются наличием одного вещества, но многие из них характеризуются наличием аллотропов (II§ 4). Людмила Фирмаль
Последнее, в общем плане, можно отнести как к разнице в кристаллической структуре (например, графит и алмаз), так и к разнице в атомарности молекул(например, кислород и озон).в обоих случаях соответствующие простые вещества имеют несколько различное строение. properties. In в следующей презентации учитываются наиболее распространенные форм-факторы. В нормальном состоянии газами являются только H, N, O, F, C1 и инертные газы-элементы, находящиеся на верхней и правой сторонах периодической системы. Нормальное состояние жидкости Vg и Hg.
Из-за легко происходящего переохлаждения, Cs(mp.- F28°C) и Ga (+30°С) часто хранятся в жидком состоянии. Остальные элементы являются твердыми в нормальных условиях.8 и 19 В свободном состоянии подавляющее большинство элементов имеют вид металла с оттенками от серебристо-белого до темно-серого, и это относится не только к типичным металлам, но и ко многим полуметаллам, C(графит), Si, As, Se, Te. Только некоторые элементы имеют различные оттенки, сохраняя при этом общий металлический вид. Таким образом, КР-красный, Аи-желтый, Би рыжеватый цвет, ПБ голубоватый цвет, и я temiobiolet.
Из элементов, не имеющих металлического вида, S-желтый, F-очень бледный зеленовато-желтый, CI-желто-зеленый, а Br-красновато-коричневый. Бесцветными являются H, N, O и инертные газы, а в твердых элементах только фосфор (белый) и углерод (алмаз).как видно из приведенного выше списка, все элементы 4-7 периода, за исключением брома и инертных газов, характеризуются появлением металлов. У меня нет Элли.
КС сосредоточен в верхней правой части расширенной формы периодической системы (стр. 4). Физические свойства, такие как температура плавления, плотность и твердость, зависят от типа кристаллической решетки и, строго говоря, могут быть сопоставлены только в одном случае с элементами, подлежащими compared. In в общем, все эти свойства демонстрируют более или менее выраженную циклическую зависимость ядра от положительного заряда. з® — * 5 По общим химическим свойствам большинство элементов являются металлами. Все они находятся в левом нижнем углу системы, и мы можем предположить, что Be, Al, Ge, Sb и Po представляют границу.
Верхняя правая часть системы заполнена полуметаллическими элементами, B, Si, As и Te являются репрезентативными элементами системы. boundaries. So, приблизительную границу между металлом и металлоидами можно провести по линии, проходящей между 2 заданными рядами элементов. При движении слева направо или снизу вверх в течение короткого промежутка времени (за исключением первого случая) наблюдается явное ослабление металла или усиление полуметаллических свойств элемента. observed. In в крупномасштабных ситуациях ситуация усложняется, с рядом аналогов 1-3 (с. а переход снизу вверх обычно приводит не к ослаблению, а к усилению металлических свойств элементов.
Если сравнивать ряды, входящие в одну и ту же группу (1 и 11, 2 и 12 и т.) друг с другом, то элементы левого ряда всегда имеют более определенное металлическое свойство, чем правый. Водород выделяется среди своих анубг, и его полуметаллические свойства(из-за малого заряда ядра) менее выражены, чем у iodine. So в общем случае наиболее активным металлом является элемент в левом нижнем углу (Fr, Cs, Ra), а наиболее активным металлоидом-элемент в правом верхнем углу периодической системы (F, O, C1).
Как правило, взаимодействие между элементами протекает так же активно, как и химические свойства сильно отличаются друг от друга other. So например, теплота образования соединений между членами одного и того же периода обычно настолько велика, что они отделяются друг от друга other. As пример такой закономерности, теплоты образования определенных соединений между элементами периода 3 и периода 2 показан ниже. Поскольку формулы этих соединений различны, их данные нельзя сравнивать напрямую, их необходимо заранее привести к сопоставимому виду. По этой причине теплота образования молекулы грамма делится на количество валентных связей, присутствующих в соединении, так что получается значение, присвоенное 1 граммовому эквиваленту (теплота образования «на связь»).
Последние уже можно сравнивать между собой. Вы можете увидеть ход расчета из данных в таблице ниже. N’ACI MeCl2 AICls sicu PCI5 I 1 LIjO B » 0 BJOJ CO * NJOJ Теплота образования молекул, ккал. 。 98154167170104143144305305 94 10 Количество валентных связей 1 2 3 4 5 2 2 6 4 10 Образование теплоты связи, ккал….. 98 77 56 43 21 1 | 72 72 51 24 1 В целом валентность химического элемента зависит от природы взаимодействующих атомов (и внешних условий), но во многих элементах она остается практически неизменной constant. In другие (например, Mn, Ru), напротив, выражением своего очень большого разнообразия являются observed.
In аналогичные элементы с различной валентностью максимум обычно наблюдается в соединениях кислорода или фтора, а минимум-в соединениях с нейтральными молекулами (такими как Со) и комплексным цианидом. Из элементов малого периода (1-3) переменная валентность характерна только для N, P, S и C1.It значительно чаще встречается среди членов большого периода (4-7), и в начале этих периодов тенденция к образованию низковалентных соединений при переходе колонны (4-10) возрастает вверх, ослабевая на ее краях(аналоговые линии 13-16).
Переход от нейтральных атомов к ионам сопровождается изменением всех основных поляризационных свойств элемента (заряда, радиуса, типа внешней электронной оболочки).Совокупность перечисленных в общих чертах признаков определяет х и М свойства ионов. Элементные соединения известны только E2 -, E», e2 \ E3*, E4+, то есть от отрицательных двойных зарядов до положительных 4 зарядов. Более высокая валентность е соответствует образованию одного из полярных соединений (например, NH3).
Составные ионы (такие как CrOj). Величина заряда химических свойств очень велика, особенно при его изменении, меняются и другие основные свойства элемента (раднус, структура внешней электронной оболочки). при тех же скоростях часто наблюдается большое сходство между членами различных групп циклической системы. Например, 6-валентный Уран по химическим свойствам очень похож на 6-валентный
Уран(имеются существенные различия в свойствах простых веществ).С другой стороны, существенно отличающиеся свойства обычно являются свойствами одного и того же элемента с различными валентными состояниями. Например, MN в 2 валентность больше похож на Fe по 7 валентных чем на 2 млн. Как и увеличение заряда, последовательное уменьшение радиуса влияет на поляризационные свойства ионов. Таким образом, 1 из этих факторов более или менее компенсируется другими факторами. Такая компенсация также учитывает сходство свойств ионов. Эти характеристики находятся наискось друг от друга и часто наблюдаются в периодической системе.
Например, газ +(0,62 а) во многом аналогичен Sn * +(0,74 а), а Ca * +(1,06 а) аналогичен La»* -. (1.22 а) Очень резкое влияние на свойства ионов оказывает изменение структуры внешнего электронного поля. shell. In в частности, аналогичные изменения происходят при переходе от элементов (Cu-Br) 4 — го ряда 11-го к соответствующим элементам (Na-Cl) 3-го ряда аналога. Согласно предыдущему (XIII§ 3), ионы с внешней оболочкой из 18 электронов характеризуются гораздо большим поляризационным действием и присущей им деформируемостью, чем ионы из 8 электронов.
Благодаря этому, несмотря на свою характерную валентность, элементы соответствующей подгруппы 4-го периода передают множество характеристик резко соответствующим элементам 3-го периода, но часто следуют за ними, и наиболее близкие аналоги (в случае Li) особенно легко получить. Трансформируемый Ион E семейства меди рясы, согласно многим характеристикам, поступает по меньшей мере в 2 цикла. Аналогично, ионы 18 электронов (5) периодически»тянутся вверх».очень важно рассмотреть эту ситуацию, чтобы понять закономерности, которые происходят в циклической системе.
Характеризующиеся различными структурами внешней электронной оболочки, 1 или другое сходство свойств между ионами сильно зависит от природы 3-го Иона, который взаимодействует с каждым данным. Например, при сравнении 8-электронного Na (0,98 а), Rb +(1,49 а) и Sr2 (1,27 а) с 18-м (18〜F2)〜электронным Ag (1,13 а), T1 *(1,49 а) и Pb * +(1,32 а) оба легко деформируются и похожи друг на друга в плане труднодеформируемых анионов (F〜, N07, s -, Br), но могут легко трансформироваться в C1 ( — , как и для I -, S2 -), тем больше деформируемость чем больше анион, тем более выражен difference.
It следует всегда учитывать при сравнении элементов разных подгрупп одной и той же группы периодических систем. Подобные изменения в природе химических связей следует часто наблюдать, если сравнивать соединения других рядов элементов в периодической системе, так как полярность связей уменьшается с увеличением поляризации взаимодействия между ионами. Очевидно, что степень этого изменения зависит от поляризационных свойств как катионов, так и анионов.
Простейшая зависимость анионов от их свойств состоит в том, что чем больше их деформируемость, тем более благоприятны условия, при которых будут появляться менее полярные связи. Со стороны катионов ситуация сложнее, здесь необходимо различать труднодеформируемые ионы типа инертного газа и гораздо более легко деформируемые ионы с внешней оболочкой из 18 электронов (и неполной).Уменьшите радиус.
Во-вторых, эта тенденция, как правило, гораздо больше, а зависимость от заряда и радиуса (как правило, одинаковая) гораздо слабее. Таким образом, ожидается, что область присутствия соединения, построенного по типу относительно низкополярного соединения катионов с 18-электронными (и незаконченными) внешними оболочками, будет значительно шире. Добавь 1) радиус на экваторе сферы 6378 км или радиус на полюсах 6357 км, общая площадь ее поверхности составляет 5.10-10 км9, а объем — от 1.08 до 10 ′ * км? Масса Земли составляет 5,98-10,7 г, а общее число атомов, образующих ее, составляет порядка 10 секунд.
2) изучение состава нижней части атмосферы, которая непосредственно связана с твердой корой в атмосфере, не является особо проблематичным, так как содержание отдельных элементов в атмосфере Земли в целом приблизительно равно same. It также относительно легко оценить количество отдельных элементов, содержащихся в водной массе на поверхности Земли (гидросфере). В случае твердой коры (литосферы) такая оценка очень сложна из-за чрезвычайного разнообразия и неравномерного распределения rocks.
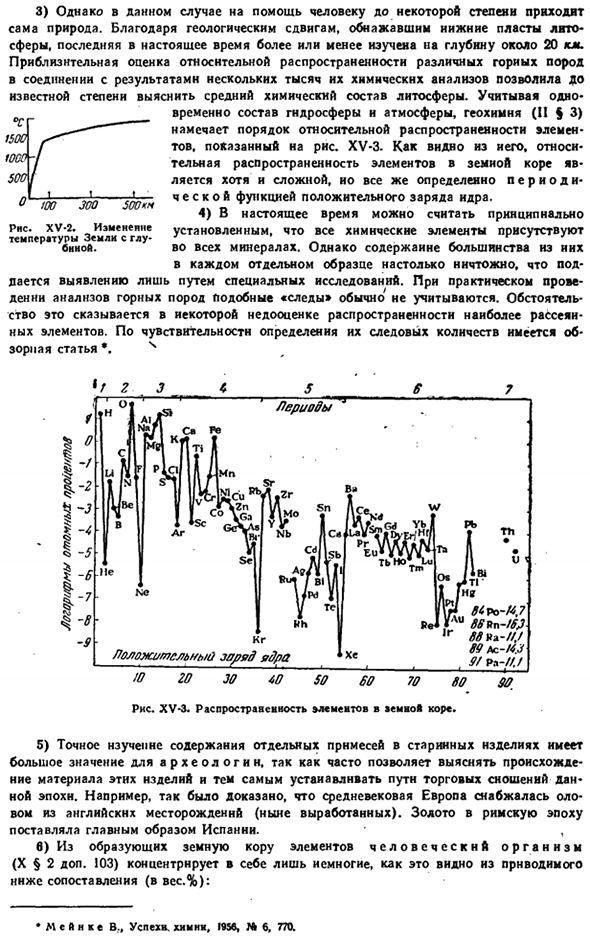
An важным фактором является трудность проникновения непосредственно через твердую кору из-за общего теплового режима: в самом верхнем слое, где каждые 100 м имеются впадины, температура повышается в среднем на 3 градуса, изменение считается обозначенным на рисунке Xv-2. 3) но в этом случае сама природа в какой-то мере поможет людям. Из-за геологических изменений, которые обнажили нижние слои Кремневой сферы, последняя в настоящее время более или менее изучена на глубину около 20 km.
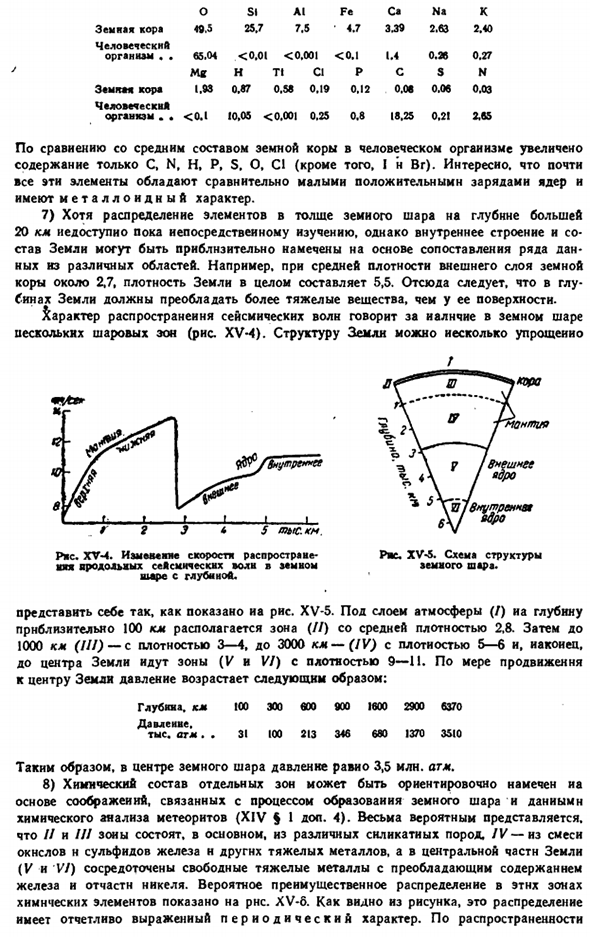
In в сочетании с результатами тысяч химических анализов грубая оценка относительного обилия различных пород позволила в некоторой степени определить усредненный химический состав литосферы. Учитывая состав гидросферы и атмосферы, геохимия (II§ 3) показывает порядок относительного обилия элементов, показанных на рисунке. Xv-3.As из нее видно, что относительное обилие элементов в земной коре является периодической функцией положительного заряда Гидры, хотя и сложной. 4) в настоящее время можно считать, что фундаментально установлено, что все химические элементы существуют во всех минералах.
Однако обнаружить их можно только специальными исследованиями, так как содержание большинства из них в отдельных образцах не очень important. In реальный анализ породы, такой «след» обычно не рассматривается. Эта ситуация находит свое отражение в конкретной недооценке распространенности наиболее разрозненных элементов. Существует обзорная статья 4 о чувствительности измерения следовых количеств.
Мне будет 40, мне будет 70. Рисунок Xv-3.Элементы в земной коре. 5)для археологии очень важно точно изучить содержание отдельных примесей в древних изделиях. Потому что во многих случаях можно выяснить происхождение материала этих изделий и тем самым установить методы торговых отношений этой эпохи. Например, в Средневековой Европе было доказано, что олово поставлялось с Британских месторождений (сейчас оно истощено).
Римское золото поставлялось в основном в Испанию. 、 в) среди элементов, образующих земную кору, человеческое тело (x§ 2 ВН.103) очень слабо концентрируется (%по массе), как видно из следующего сравнения. 500. * » Рисунок Xv-2.Температура Земли имеевна с глубиной. Действительно ода «Дж» Положительный заряд ядра♦Xegj ры -//./ * М Е М М Е В. успех, химик, 1956, м 6, 770. Подробнее о SI Al Fe C » Na K Корочка 49.5 25.7 7.5 4.7 3.39 2.63 Органическое вещество в организме человека. 。 65.04 <0.01 <0.001 <0.1 1.4 0.36 0.27 Мг N ТТ ки П Ц С Н Зайнен кора 1.93 0.67 0.58 0.19 0.12 0.06 0.06 0.03 Органическое вещество в организме человека. 。 <0.1 10.05 <0.001 0.25 0.8 18.25 0.2! 2.65
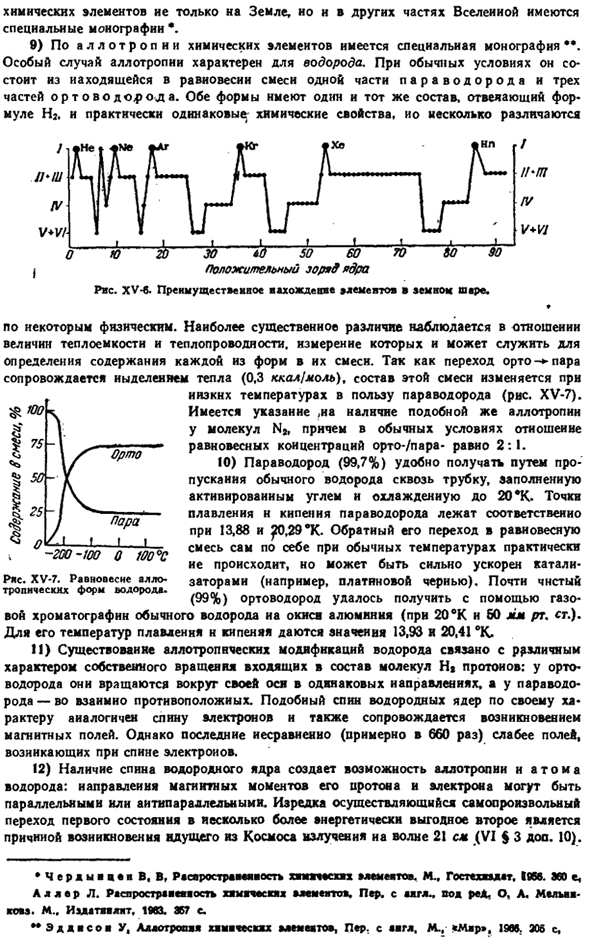
При сравнении со средним составом земной коры в организме человека повышается содержание C, N, H, P, S, O, только C1 (кроме того, 1 n Bg). интересно, что почти все эти элементы имеют относительно небольшой положительный ядерный заряд и по существу являются полуметаллическими. 7) распределение элементов в толще земли на глубине 20 км и более пока недоступно для непосредственного изучения, но внутреннее строение и состав Земли можно примерно очертить, сопоставив множество данных из разных регионов.
Например, если средняя плотность внешнего слоя земной коры составляет около 2,7, то плотность всей Земли равна 5.5.As в результате более тяжелые вещества должны распространяться глубже в землю, чем поверхность Земли. Характер распространения сейсмических волн указывает на наличие в земле нескольких сферических зон (рис. XV-4).Структуру земли можно немного упростить / Правая сторона. ХV-4.Из-за ограничения скорости Rwe распространилась. ХV-5.Структурная схема Вертикальное землетрясение волки com Подробно.
Представьте себе, как показано на рисунке. ХV-5.Ниже атмосферного слоя ( / ) и глубиной около 100 км находится зона ( / / ) со средней плотностью 2,8.Затем до 1000 км (II/) — плотность 3-4, до 3000 км-плотность 5-6 Н (IV), наконец, зоны плотности 9-11 (V и VI) перемещаются к центру Земли. Двигаясь к центру Земли, давление увеличивается следующим образом: Глубина, км 100300600900 1600 2900 6370 клен. Тыс. атмосферного давления. 31100213346680 1370 3510 Итак, в центре Земли давление составляет 350 миллионов атмосфер.
8) химический состав отдельных зон может быть предварительно очерчен на основе данных химического анализа камней, с учетом соображений, связанных с процессами формирования Земли (XIV§ 1, доп. 4). /Представляется вероятным, что зоны /и///состоят в основном из различных силикатных пород. IV-смесь оксидов и сульфидов железа и других тяжелых металлов, а также свободные тяжелые металлы, в основном состоящие из железа и частично никеля, сосредоточены в центре Земли (V и VI).Возможность основного распределения химических элементов в этих зонах показана в РНС. Xv-6.
As как видно из рисунка, это распределение имеет четкие периодические features. By Распространенность Существуют специальные монографии химических элементов не только на Земле, но и в других частях Вселенной.* 9) существует специальная монография по аллотропии химических элементов, и особый случай аллотропии характерен для водорода. В нормальных условиях он состоит из равновесной смеси 1 части пара-водорода и 3 частей ОРТ-овода. Обе формы имеют 1 идентичный состав, соответствующий формуле Н3.
И почти одинаковые химические свойства, слегка отличающиеся Рисунок XV-е. * основное положение элементов автомобиля в шаре; * Некоторые физические. Наибольшая разница наблюдается в терминах теплоемкости и теплопроводности, а ее измерение помогает определить содержание каждой формы в смеси. Орто — * — переход пара сопровождается распределением тепла (0,3 ккал / моль), поэтому состав этой смеси является Низкая температура в пользу пара-водорода(рисунок XV-7).
Существует аналогичный аллотроп в молекуле N *, кроме того, в нормальных условиях имеются признаки того, что соотношение равновесной концентрации Орто/пара равно 2: 1. 10) пара-водород (99,7%) был удобно получен путем пропускания обычного водорода через трубку, заполненную активированным углем и охлажденную до 20 * K. точки плавления и кипения пара-водорода составляют 13,88 и 0,29 * K соответственно. Сама инверсия к равновесной смеси при комнатной температуре фактически происходит, но значительно ускоряется катализатором (таким как Платиновая сажа).
Газовая хроматография нормального водорода (20 ° К и 60 мм рт. ст.) на оксиде алюминия позволила получить практически чистый (99%) Орто водород. Для его температуры плавления заданы значения 13,93 и 20,41°К. 11) наличие аллотропных модификаций водорода связано с различной природой присущего вращения протонов, составляющих НТ molecule. In Орто-водородные, они вращаются в одном направлении вокруг оси, а в пара-водородные-в противоположном направлении.
Подобные спины ядер водорода сходны по своей природе со спином электронов, что также сопровождается появлением магнитного поля. Однако последнее слабее (примерно в 660 раз), чем электрическое поле, создаваемое спином электрона. 12) наличие спина в ядре водорода создает аллотропный и водородный потенциал атома. Направление магнитного момента его протонов и электронов является параллельным или непараллельным.
Иногда спонтанный переход из первого состояния во второе, слегка энергетически благоприятное, является причиной излучения из космоса с длиной волны 21 см (VI $ 3 доп.10). Çeldineh Б, Б, » Тесье lemeti Preu. М., Гостехнадат. 1866 год. 360 Ф. Адлер л. Распространенность химических удвоение. Пер на английском языке.. ред. О. А. Мельников. М.. Iadatvnlyat, 1963.967 С. «Edasoa Вт, химическое анаболические личность, транс. Стойкость, М..«Мир», 1966,306 С. § § 75 И%Т. Т Орто 5-25 Я О, да. Пара J-1-1_L — зоопарк-слишком т°с Ряса. ХV-7.Аллотропное равновесие водорода.
Основываясь на таких переходах, атомные часы были построены гораздо точнее, чем те, что на часах(XIII§ 1, 4).Возможная ошибка оценивается в 100 миллионов лет до 1 секунды. • 13) Еще одним частным случаем аллотропии является характеристика гелия (см. II§ 2 additional II).Когда он охлаждается до 37,17 К под давлением насыщенного пара (im Hg), он переходит во 2-й фазовый переход(XIV§ I дополнительный 58) и обычную форму жидкого гелия(так называемый гель)I) другой модификации(то есть гелия II). как вы можете видеть из rns. В XV-8, когда давление увеличивается, точка перехода (так называемая точка X) смещается в сторону немного более прохладной температуры.
14) Если свойства гелия I сходны с другими сжиженными газами, то свойства гелия II в чем-то совершенно аномальны. Например, существует сверхтекучесть. То есть практически полностью без вязкости, а теплопроводность значительно выше, чем у silver. In теоретическая интерпретация аномальной природы гелия II, концепция фононов (XIII§ 3 add.28), и в определенной степени использовать величину возбуждения коротких волн, сходную с таковой. 15) 2 электрона атома гелия, спин становится параллельным (ортогелий) или антипараллельным(парагелий).
Обе формы сосуществуют в обычном геллне, и переход между ними классифицируется как «запрещенный» (VI§ 3 add.10). 16) полимеризация характерна для многих химических элементов и многих производных. Имеется обзорная статья*о высокомолекулярных неорганических соединениях, образующихся при его использовании. 17) как правило, изменение идентичности, общее для всех неметаллических веществ, представляет собой переход от прямого, очень высокого давления к металлическому состоянию.
Например, в случае с водородом это давление оценивается в 200 миллионов атмосфер (так что в Юпитере может быть металлический водород).Образование металлического водорода из атома оценивается в 10 ккал / г атомов, в то время как длина нормальной молекулы соответствует 52 ккал / г атомов. Поэтому последнее является энергетически более выгодной формой. Однако существует предположение, что после декомпрессии металлический водород может поддерживаться в стабильном состоянии и в нормальных условиях.
Есть обзорная статья о * * высоком давлении (включая переходы в металлическое состояние). 18) газообразные элементы в нормальных условиях (за исключением инертных газов) состоят из двухатомных молекул. Примерно то же самое относится и ко многим другим элементам, которые являются paired.
As вы можете видеть, rns. XV-9, энергия диссоциации основной двухатомной молекулы, представляет собой четко выраженную периодическую функцию положительного заряда ядра (2-й минимум, 5-й максимум). 19) Если вы сравните следующие параметры, то получите интересные результаты. Рисунок Xv-8.Диаграмма состояния гелия. Ядерная дистанция. А. 。 1.12 Энергия диссоциации. Рейдга.•••••••••* 154 Один 1.21 Я 1.28 119. ’Акдри Ю1 К. A. In Химия, If68, Nb 11. 1257, Коршк В. В.» Я не смогу этого сделать», — сказал он., Успехи в химии, имфл. М 7, 783.Г. Ж.
Эмери успех Hamia, 1961, м 3, 410. Айдрнавоа К. А. Х а ФТ Д У и И. Хайанашвили Л. М.. Достижения химии, 1965, м. 1.27、 * * X и m и S. D. успехи в химии, 1963.М9, 1674. Как язык отображается в RNS. Орбитальная схема XV-2p разделенных электронов атома кислорода и молекулы O *находится на уровне релаксации. Поэтому естественно, что при удалении 1 из этих электронов (O,—► Oj) связь фиксируется, а избыток (O,—► O») добавляется к ее ослаблению.
Наоборот, с молекулами азота, уровень и таким образом переход N, — ► Nj сопровождается увеличением расстояния (с 1,095 до 1,116 А) и ослаблением связей(с 226 до 202 ккал / моль). Молекула фтора ведет себя как кислород(рис. VI-7) и 9 ’Ф9 Х Рисунок Xv-10.Схема 5р-орвгг » о * количество кислорода в молекуле Другие галогены, в которых разделение электронов сопровождается резким увеличением энергии диссоциации(ккал / моль): Положительный заряд яда^ а РНС. В XV-9.Второй атомной молярной г л(ккал! Mol) энергия диссоциации. Тсс. gr Ихэ.
Девяносто три Ки ВГ ВГ Движение кислорода é2 — ► ^ ^требует 2×1 x внешнего слоя, в то время как в галлоне только 4×1 x, относительное усиление связи во 2-м случае больше important. At в то же время удаление электронов со связывающих орбит молекулы щелочного металла r <GC сопровождается увеличением энергии диссоциации: Li, (26)—► Li J (36) и Na, (17)—► NaJ (24).Причины обоих неясны. Несмотря на эти неясности, возможность предсказания характера изменения энергии, возникающего в результате непризнания молекул, является одним из больших преимуществ теоретических молекулярных механизмов (VI§ 1).14).
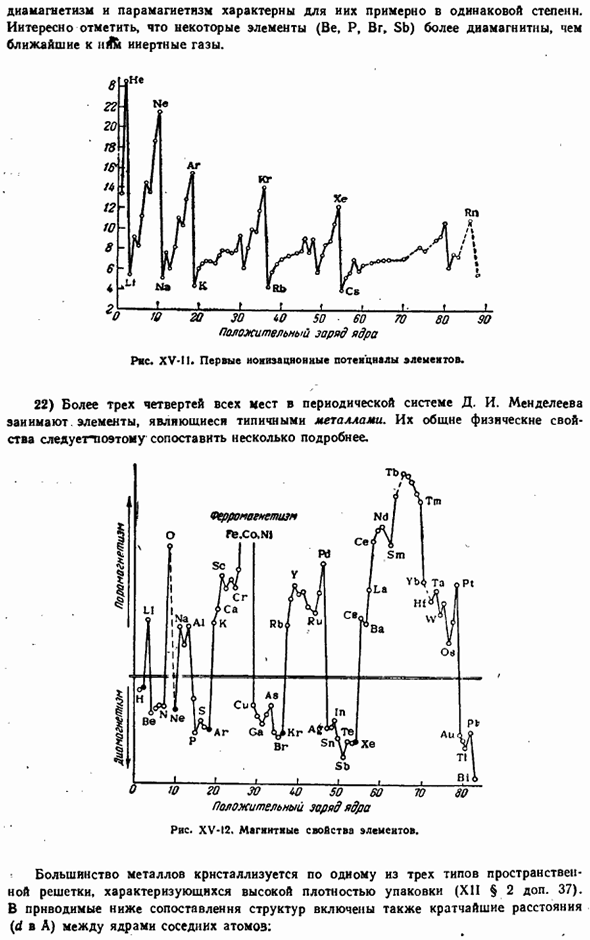
- Однако его следует переоценить. — Как и квантовая теория атомов, теория МО представляет собой простую модель. Очень полезно, но все же это всего лишь модель, а не»сущность» в себе » (Райд). 20) 1) одной из важных числовых характеристик атома является величина его неклеевого потенциала. Значение этн, которое связано с отделением первого электрона от нейтрального атома, сравнивается для многих элементов на РНС. ХV-11. как вдно НЗ рнсунка.
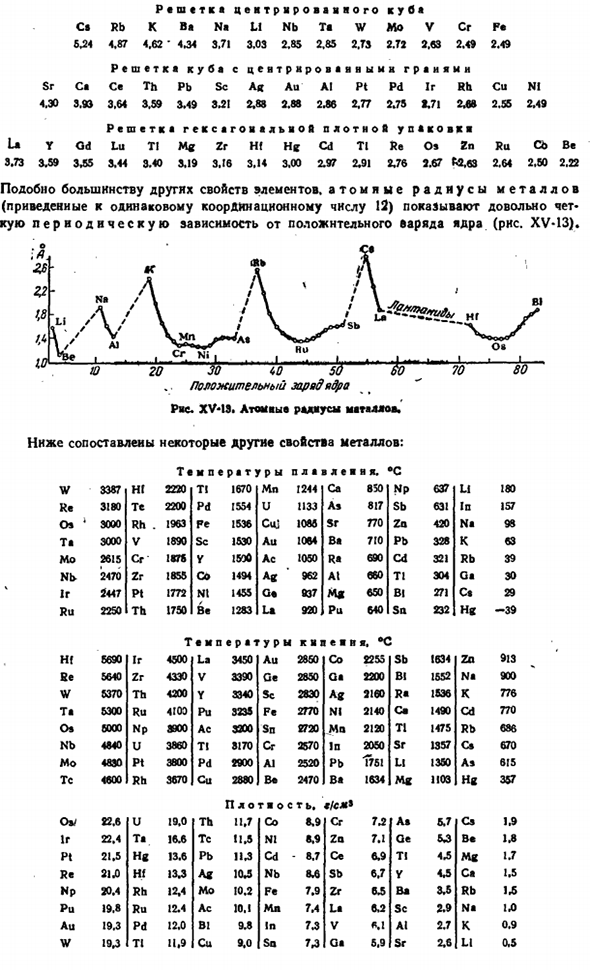
Первый ионизационный потенциал элемента-это четко выраженная периодическая функция положительного заряда ядра. 21) магнитные свойства элементов (точнее, простых веществ) не столь выражены, но периодичны в nature. Заметим, что некоторые элементы (Be, P, Br, Sb) являются более диамагнитными, чем инертный газ, ближайший к A. 20 30 iO 50 60 70 80 Ряса. XV-M. первый потенциал ионизации элемента. 22). I. Более 4 минут 3 из всех мест в системе Менделеевского цикла занимают элементы, являющиеся типичными металлами.
As это видно из рисунка XV-I2 Диамагнетизм и парамагнетизм-это почти одно и то же. Людмила Фирмаль
Поэтому необходимо более подробно сравнить их общие физические характеристики. Яд положительного заряда / в Рисунок XV-I2.Магнитные свойства элемента. Большинство металлов кристаллизуются в любом из 3 типов пространственных решеток и характеризуются высокой плотностью упаковки(XII§ 2 add.37).
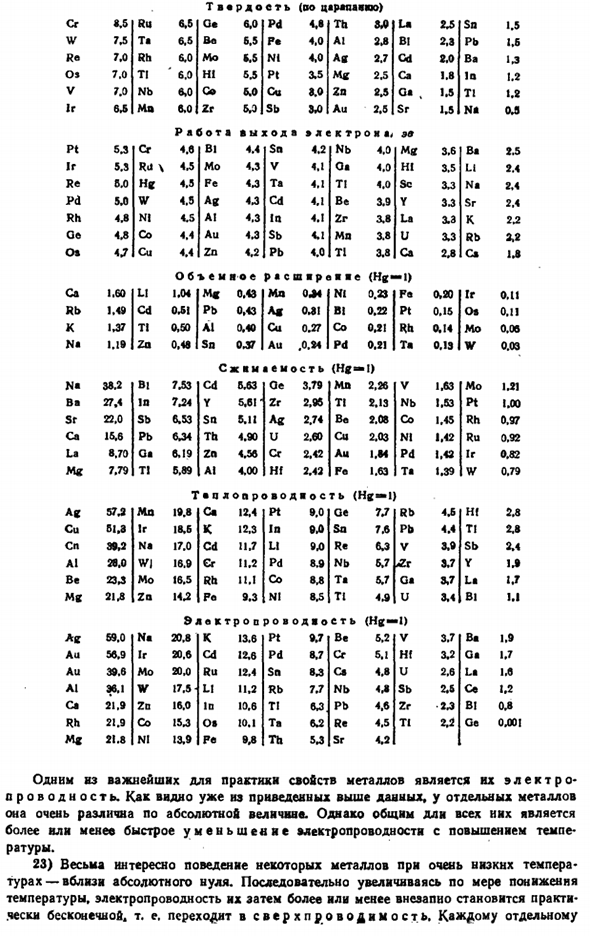
Кратчайшее расстояние между ядрами соседних атомов(4 из а) также включается в сравнение следующих структур: Решетки Се РБ К В » Н. Л.! Nb Ta W Mo V Cg Re 5.24 4.87 4.62•434 3.71 3.03 2.85 2.85 2.73 2.72 2.63 2.49 2.49 Центральная кубическая решетка Sr Sa Ce Th Pb Sc Ag Au Al Pt Pd Ir Rh Cu N! 4.30 3.93 3.64 3.59 3.49 3.21 2.88 2.88 246 2.77 2.75 т. 71 2.66 2.55 2.49 Шестиугольная решетка У г ГД Лу Тл мг ЗР НТ ч ^ кд Тл Ре ОС 2Н ру сидел бы 3.73 3.59 3.55 3.44 3.40 3.16 3.19 3.3.00 у 2.97 2.91 2.76 2.67 fс2.Е3 2.64 2.80 2.22 Как и большинство других свойств элемента, атомный радиус металла (сведенный к тому же координационному числу
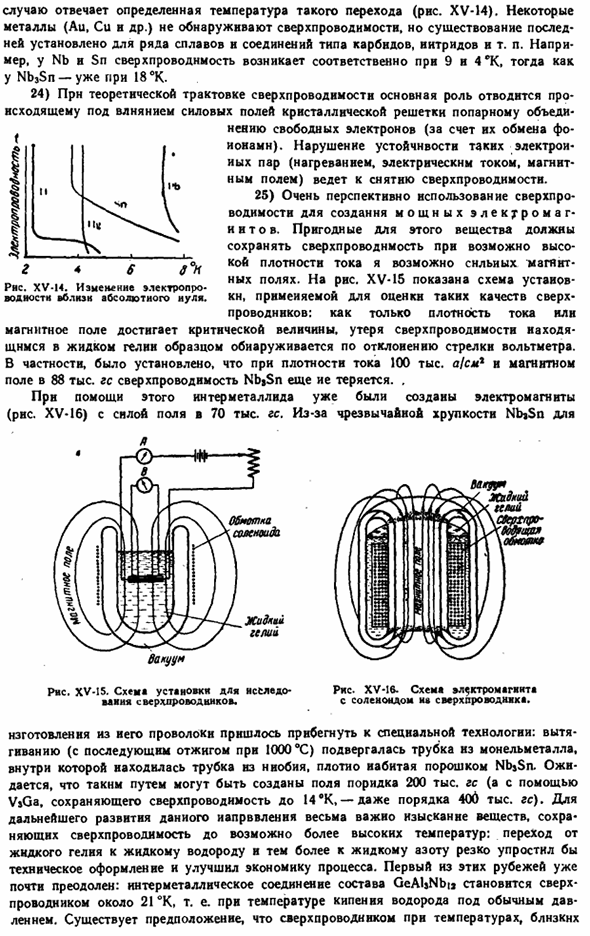
12) показывает достаточно четкую циклическую зависимость ядра от положительного варианта (рис. XV-13). Рисунок Xv-13.Атомный радиус металла. Некоторые из других свойств металла сравниваются со следующими: Температура плавления. одним из важнейших свойств настоящего металла является его conductivity. As как видно из приведенных выше данных, абсолютное значение очень сильно отличается для отдельных металлов. Однако суммарная длина всех их представляет собой более или менее быстрое уменьшение электропроводности с повышением температуры.
23) поведение некоторых металлов при очень низких температурах-близких к абсолютному нулю-очень интересно. При непрерывном увеличении с понижением температуры их электропроводность впоследствии становится почти бесконечно бесконечной. То есть, он становится superconducting. To каждый индивидуум Случай соответствует удельной температуре такого перехода(rns. XV-14).Некоторые металлы(au, CU и др.) не проявляют сверхпроводимости, но наличие последней установлено для многих сплавов и соединений, таких как карбиды, нитриды и др. Например, в Nb и Sn, 9-4% — уже при 18°к 24) в теоретической интерпретации сверхпроводимости основную роль играет попарное интегрирование свободных электронов под действием силового поля кристаллической решетки(для их обмена).) joiamn).
Такое нарушение стабильности электронных пар (при нагреве, электрическом токе, магнитном поле) приводит к снятию сверхпроводимости. 25) использование сверхпроводимости для создания мощного электрохромата и тому подобного весьма перспективно. Материал подходящий для этого сохранит сверхпроводимость при максимально возможной плотности тока и возможно сильный _«»Поле. на РНС. XV-15 показана схема устава Риас. ХV-14. электрогидравлические изменения Влага близка к абсолютной Лилии. КН использовался для оценки качества таких сверхпроводников.
Когда плотность тока или магнитное поле достигают критического значения, потеря сверхпроводимости образца в жидком гелии обнаруживается отклонением стрелки в направлении voltmeter. In в частности, мы обнаружили, что при плотности тока 10 миллионов а / с *и магнитном поле 88 миллионов ГС сверхпроводимость nbtsn все еще отсутствует. 。 На этой интерметаллического соединения, электромагнит (РНС. XV-16) уже создан. Из-за крайней уязвимости NbjSn Рисунок Xv-15. * Схема установки XV-lft для исследований. Схема вл ^ ктромагиита Вии сверхпроводник.
Соленоиды и «сверхпроводники». Приходилось полагаться на особую технологию изготовления проволоки: растяжка (с последующим отжигом при 1000°с) представляла собой трубку из металла Монеля, трубку из ниобия, плотно упакованную порошком NbjSn inside. It ожидается, что этот способ позволит создать подерку поля 20 млн Г (даже с помощью Вжга поддерживается сверхпроводимость до 14 ВК, около 40 млн г). для дальнейшего развития данного подхода очень важно найти вещество, сохраняющее свою сверхпроводимость до максимально возможной температуры: переход от жидкого гелия к жидкому водороду, а также жидкому азоту, значительно упрощает технологическое проектирование и повышает экономичность процесса.
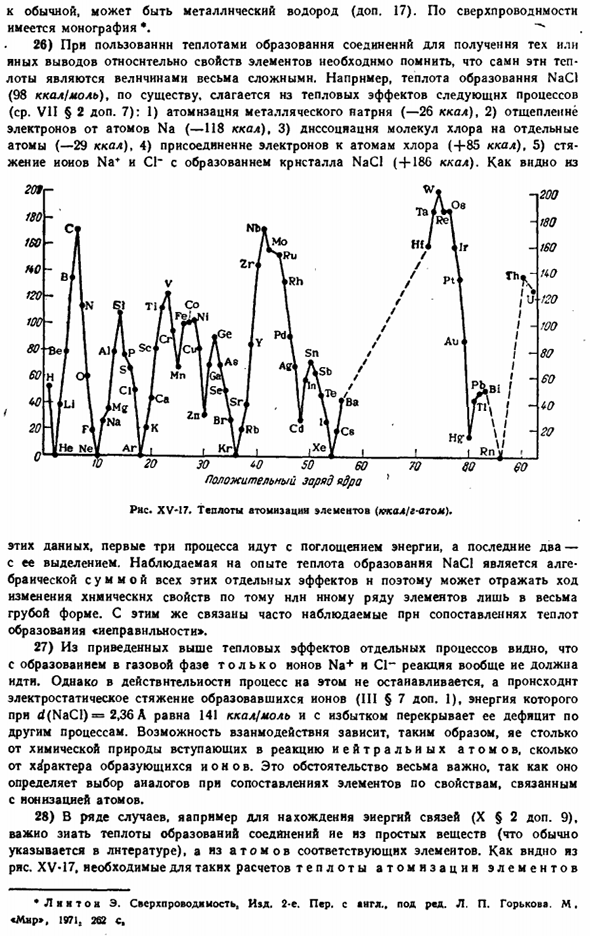
Первая часть этих границ почти преодолена: интерметаллическое соединение с составом GeAljNbn становится сверхпроводником примерно при 21°К, то есть при температуре кипения водорода в атмосфере pressure. At температура, близкая к Обычно может присутствовать металлический водород (дополнительно 17).Имеется монография по сверхпроводимости. 26) при использовании теплоты образования соединения для получения конкретных выводов о свойствах элемента необходимо помнить, что сама эта теплота является очень сложной величиной.
Например, тепло, выделяемое NaCl(98 ккал! Мол) в основном состоит из тепловых эффектов следующих процессов (см. VII§ 2 additional 7): 1) атомная конверсия металлического картриджа(-26 ккал), 2) Удаление электронов из атома Na (-118 ккал), 3) диссоциация молекулы хлора на отдельные атомы (- 29 ккал), 4) адгезия электронов к атому хлора (+85 ккал), 5) образование кристаллов Na и+186 ККЛ путем коалесценции молекул хлора. ions. As вы можете видеть из Положительный заряд Оус Правая сторона. XV-17
Элементарная жара распыливания (Yakal / Goss). Из этих данных первые 3 процесса сопровождают поглощение энергии, последние 2 процесса сопровождают ее высвобождение. Экспериментально наблюдаемая теплота образования NaCl является алгебраической суммой всех этих индивидуальных эффектов, и поэтому только в очень грубой форме может отражать ход изменения химических свойств ее ряда на другие elements. In эта связь часто наблюдается при сравнении теплоты образования «неровностей». 27) из приведенных выше тепловых эффектов отдельных процессов видно, что если в газовой фазе образуются только Na +и C1〜ионы, то реакция должна протекать в целом.
Но на самом деле процесс на этом не останавливается, а происходит электростатическое сжатие образующихся ионов (III§ 7 additional 1), энергия которых равна 2,36 ккал / моль при<*(NaCl)= 141 а, покрывающее избыток других частей process. So, возможность взаимодействия во многом зависит от химических свойств нейтральных атомов, входящих в реакцию, а также от природы образующихся ионов. Это обстоятельство очень важно, поскольку определяет выбор аналогов при сравнении элементов по свойствам, связанным с ионизацией атома.
28) часто добавляют§ 2 (например, чтобы найти энергию связи.9). важно знать теплоту образования соединений из атомов простых веществ(обычно указывается в литературе) и соответствующую elements. As как видно из рисунка XV-17, распыление элементов необходимо для таких расчетов теплоты * Lmmton E. сверхпроводимость и д. 2.-Я не уверен, что делаю, — сказал он. под п»Д. Л. П. Горького» М. «Мир», 1971, 262 С. По мере увеличения атомного номера он периодически изменяется с естественным минимумом инертных газов. 29) конкретными случаями описанных в тексте закономерностей являются сходства между Be1 *(0.34 A)^и AI3 * (0.57 A), а также B **(0.20 A) и Si4 * (0.39 A).Однако здесь играет роль не только радиус, но и различие в структуре внешней электронной оболочки.
Последнее можно видеть из того факта, что Li *(0.78 A) в некоторых отношениях аналогичен MgJ *(0.78 A), хотя эффективные радиусы обоих ионов одинаковы. Это сходство, по-видимому, связано с усилением поляризационного действия при переходе от 8 электронов к гелиевой внешней оболочке, в результате чего Li *«догоняет» Mgl *до некоторой extent. In в этой связи, возможно, при переходе от 3-го элемента к соответствующему элементу 2-го периода наблюдается резкий скачок характеристик. 30) влияние структуры внешней 2-й электронной оболочки более выражено на свойства элемента, в результате чего меньше внешних electrons.
It является очень сильным из-за наличия только 1 электрона (атома Cu и его аналогов) во внешней оболочке, он явно влияет на 2 существа и быстро уменьшается с увеличением числа. С другой стороны, вышеизложенное касается сравнения свойств атомов или ионов по заданным достоверным данным. Сам этнический радиус зависит не только от внешнего, но и от структуры N всех внутренних электронных оболочек. Действительно, в некоторых структурах 8-«-18 32 любой переход из них должен сопровождаться непрерывным увеличением действия положительного поля внешнего или не внешнего ядра атома, что неизбежно приведет к уменьшению его радиуса(общее число электронных слоев постоянно).
Например, в результате заполнения внутреннего слоя лантаноидных элементов 18-32 электронами радиус Иона E3 * уменьшается до La5(2、8、18、18、8)от 1.22 A до Lus( 2、8、18、32、8)。 Уменьшение радиуса («сжатие лантаноида»), которое происходит при переходе семейства лантаноидов, распространяется не только на неатомы, но и на нейтральные атомы (атомы, внешняя оболочка которых находится уже за пределами 3-го).оно также оказывает очень сильное влияние на элементы (Hf, Ta и др.) периода b, следующего за лантаном, уменьшая радиусы атомов nx и ions. An важным следствием этого является то, что характеристики элементов 4-10 линий в периоде резко приближаются к аналогам 5-го period. So, Hf по всем своим химическим свойствам очень похож на Zr. Это также объясняет большое сходство между Nb и Ta, Mo и W, Tc и Re и платиновым металлом 5. 31) результаты исследования обусловлены, в частности, воздействием купающихся организмов. Вторичная периодичность.
Суть ее заключается в»зигзагообразном» изменении некоторых свойств однотипных соединений при переходе элементов из верхней части группы в нижнюю периодической системы. «Вторичная периодичность» наблюдается относительно редко и наиболее отчетливо проявляется при добавлении к членам малого периода характерных валентностей сравниваемых элементов и элементов подгрупп, подходящих для совместного рассмотрения. Хорошим примером четкого выражения этого являются данные на рисунке. XI 1 * 74.
Наличие первого излома в ходе рассматриваемых характеристик-от Mg до Zn-указывает на то, что структура внешней оболочки изменялась от 8 до 18 электронов, то есть, по сути, характерные значения элементов 3-го и 4-го периодов правой подгруппы (VI§ 4). 2-й перегиб от Cd к Hg обусловлен увеличением силового поля ядра, характерного для элемента в конце 6-го периодического глаза, за счет его Лайтандового сжатия. Из вышесказанного видно, что»квадратичная периодичность», наблюдаемая при определенных сравнительных условиях, не является закономерностью с независимым физическим смыслом.
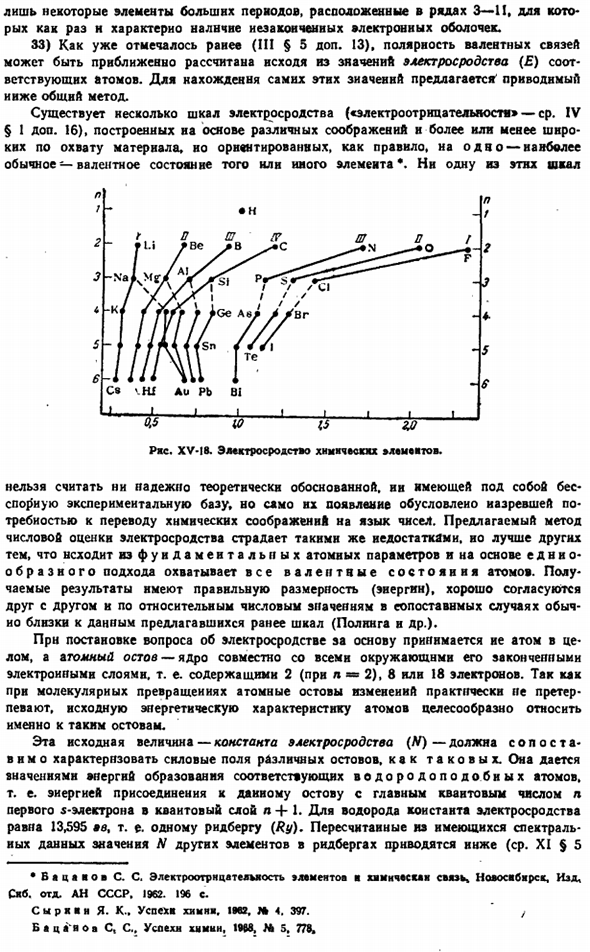
32) очевидно, что наличие незаконченной электронной оболочки особенно важно для некоторых свойств ионов (например, цвета), независимо от того, является ли она внешней или internal. In в частности, окрашенные ионы являются Только некоторые элементы большого периода в строках 3-11.Наличие незаконченной электронной оболочки как раз характерно. 33) Как уже упоминалось (см. III§ 5, 13), полярность валентной связи может быть вычислена приблизительно на основе значения электрической степени ( £ ) соответствующей atom.
To чтобы найти эти значения самостоятельно, были предложены следующие популярные методы: Существует несколько шкал электрического сродства, более или менее находящихся в диапазоне материала, построенных по различным соображениям и направленных, как правило, на валентное состояние Ома (наиболее распространенное).Или другие предметы*. нет этнической шкалы Нельзя считать, что существует теоретически достоверно обоснованная и бесспорная экспериментальная база, но само появление обусловлено острой необходимостью перевода химических соображений на язык чисел.
Методы, предложенные для численной оценки электрического сродства, имеют те же недостатки и превосходят другие в том, что они охватывают все валентные состояния атомов на основе единого подхода, не выходя за рамки основных атомных параметров. Полученные результаты имеют правильные размеры (энергию) и хорошо согласуются друг с другом, а в относительных числах, когда они сопоставимы, обычно будут близки к данным ранее предложенной шкалы (Pauling et al. it это не так.
При постановке вопроса о производстве электроэнергии за основу берется весь атом, а ртутное ядро-это ядро со всеми готовыми электронными слоями, окружающими его. Поскольку атомное ядро претерпевает изменения в молекулярных превращениях, рекомендуется приписывать такому ядру начальные энергетические свойства атома. Это начальное значение (константа электрического сродства (N)) эквивалентно характеристике силовых полей различных cores.
It задается Энергия образования соответствующих водородоподобных атомов, то есть величина энергии связи с конкретным ядром с основным квантовым числом l первых z-электронов в квантовом слое n 4-1.Для водорода электрическая постоянная составляет 13,595 Св, то есть 1 Ридберг. Вот значения N других элементов readbergs, пересчитанные из доступных спектральных данных(см. XI $ 5) * Вшнов С. С. ■ химические связи, Новосибирск, издательство, Сяб. Отъезд Академии Наук СССР. 1962.196 секунд Сирия, Ю. К.. Успехи в химии. 1962.4. 397.、 О Бацая а с, С. успехи химии, 1968, М5, 778、
Добавьте его в список. 4 и рис. X111-78). I, Fe и Xe diagrams. It получается путем экстраполяции, заключенной в скобки. Константа электрода является основным атомным параметром. Электростатическая постоянная (Ry /моль) Ли Бэб С Н О П 0.40 144 2.79 4.74 7.20 10.16 13.62 Na Mg Al Si P S a 048 1.11 2.09 342(4.78 6.47 8.41 К Сертификации СК Тл В ХТ Млн Фе 0.32 0.87 1.58 2.45 3.45 4.38 5.86(7.28) КР ЗН ОК Оэ как SE Бр 0.57 1.32 2.26 346440 6.01 7.58 РБ-Старший. 041 0.81 1.44 2.13 2.96 3.91 Ag Cd In Sn Sb Te I Xe 046144 2.06 3.00 4.12 540(644)<8.12) CS в Лос-Анджелесе 049 0.74 149 Au Hg Tl Pb Bl 0.68 1.38 2.19 3.11 4.12
Величина электрического сродства 1 или другого атома X (£x) зависит только от Wx. Но также и к природе среды его скелета в рассматриваемой молекуле. o, i и e, соответственно, указывают количество скелетов npiT, доступных для o-соединения. — Связывание и свободные электроны, то находятсяx, определяются уравнением электрического affinity. It может быть выражена в простейшей форме: П-(н + е + 2V7T£Х, О + я + а-2-й при вычислении e каждый свободный электрон или Р-электрон в валентном слое считается е-единицей, d-электрон считается равным 2, Sn» и т. д.).
Необходимость в 2-кратном (в первом приближении) увеличении, по-видимому, обусловлена повышенным экранирующим эффектом таких электронов. Следует отметить рациональную форму уравнения электрического сродства и отсутствие в нем эмпирического коэффициента. «Для простоты я думаю, что это изящество математической схемы, предложенной природой, и очень убедительный аргумент, чтобы доказать ее справедливость» (Гейзенберг).
Рисунок XV-I8 показывает на графике прогрессию изменений электрического сродства периодической системы к наиболее распространенным валентным состояниям соответствующих элементов. Сравните некоторые числа x, представляющие первые 4 группы ниже. — Л1-Н-К-РБ-ПК-КР-АГ-Ас 0.40 048 042 041 0.29 047 0.58 048 -Быть — Мг- — Ка — Ср — Ва- -ЗН- -Компакт — — — НД- 0.67 0.66 0.44 0.41 047 0.66 0.62 6.69 1-б-я-АС-1-Ск-1-г-Ла-1-Ме-1-ти- 0.93 0.70 0.53 0.48 0.43 0.75 0.69 0.73 Я 1-СИ-1 1-Тл-1 1-ЗР-1-Цзи—Ге-л-ПУ 1 1.19 043 041 0.55(0.5)0.84 0.75 0 * 78 Из представления о том, как тип среды скелета влияет на значения электрического сродства, мы получаем следующее приближенное сравнение значений
E1: 1-часовой — Бе-Б Е = — Б-Бо-СН-СН-СН-СН — » > СН = 0.67 0.82 0.93 1.14 0.80 0.G2 — ПР-и-мн — — МН-МН » — Фе— Фе- 0.54 0.61 1.08 ^ 0.57 о » о’0.60 0.65 — Ы-Ы — Ы — — Ы — ^ Х-Ф 1.30 1.33 Ii36 1.42 1 0е я> 53,, 7и 2.32 — С- \ Се «- с- » Кр-ки — ки- — — ХЛ ^ — с?| = ««1.68 1.68 1.43 * 1.48 | Д 1.19 л, в> 1.90 -Н — н — н-н- -н — — н ^ — н = — Бр-я 1.71 1.81 1.90 » 1 2 (M 2.28 1.28 1.13 -Понятия не имею. Восемьдесят — о-о-о-о — «= о » — р — ^ п- / \ / ^ 2.04 2.09 2.42 2.23 1.14 Значение степени электричества, рассчитанное по приведенной выше формуле, также может быть использовано в качестве абсолютного значения (Ry / mol).N как родственник (£н■= 1).
Если все атомы, связанные с определенным скелетом, идентичны, они могут быть применены непосредственно. При более строгом подходе необходимо учитывать свойства таких атомов. Однако исправления, введенные этим, вероятно, невелики. Другая ситуация несравнимо значима. Если окружающие атомы не одинаковы, то электричество в ядре перераспределяется между ними (физически это можно интерпретировать как очень небольшое смещение ядра в ту или иную сторону).
Если конкретный атом X настроен другими атомами ( / ), то переход от статического электричества (£x) к его динамическому значению (£x<, т. е.£xm,£xx и т. д.) происходит в соответствии с одним из типов распределения.: Положительные и отрицательные ^ ’УБ + ТВ * тольк…)’. На самом деле, они оба представляют одно и то же. То есть положительно заряженное ядро X стремится захватить максимально возможную долю внутримолекулярных электронных облаков. Если слабый сосед может достичь этого, распределение будет противоположным. При сильном распределении(но с высокой электронной плотностью) распределение становится прямым.
Наиболее обоснованно такой расчет перераспределения производился в отношении насыщенных углеводородов, что является наиболее простым случаем. Мы обнаружили, что длина этого атома углерода характеризуется обратным распределением индекса подвижности»2/3″ (см. Приложение 2). 34) уравнение полярности (III§ 5 add.13) будет введен в действие.
Если EA и£in-значения электричества атомов, образующих связь A-B, а o — число вовлеченных электронов 16 Б. Б, Некрасов Я 0.75 0.92 0.96 1.17 1.35 При образовании этой связи отношение полного валентного электронного облака каждого рассматриваемого атома определяется соотношением. век£в. При строгой геголярной связи A-B каждый атом становится половиной общего электронного облака. Отклонение от этого значения (o / 2) определяет полярность соединения.
Направление, в котором смещается электронное облако (с первого на 2-е), показано индексом Р、 в ВЭА в ВЭБ £а +в U * БА — £ 5—£на +£д После большого поворота、 _y(е-ЕА)^(ЕА-Св) 2 (£ь +£А) ППР™2(£а+£)») Однако v / 2 — это только порядок (p) конкретного соединения. Поэтому, в конце концов. 」 РАВ-П£на +£А » ва-Р тг + е BTSA A ^ B Если допускается предварительный перенос 1 электрона от донора (D) К акцептору (A), то предварительно акцепторная связь восстанавливается до обычной валентности bond.
In в соответствии с этим полярные уравнения для донорно-акцепторной связи принимают вид: £а +£г + £ 1 и£Г + £ С −1 Исходя из полярности связей, можно рассчитать официальный эффективный заряд атомов в молекуле (III§ 6, дополнение.4).Если мы рассмотрим далее материалы этого раздела, то это используется частично. Конечно, полученные таким образом величины нельзя считать спорными, но они используются в полутеоретических квантово-химических расчетах (XIII§ 3 add.3) менее достоверны, чем аналогичные результаты, и, несомненно, гораздо ближе к истине, чем значение, заданное состоянием окисления соответствующего атома.
Смотрите также:
| Комплексные соединения | Водородные соединения |
| Периодический закон как основа химической систематики | Галоидные соединения |

