Электрический ток в электролитах
Электролитами, или проводниками второго рода, называются вещества, в которых прохождение электрического тока сопровождается электролизом.
Электролиз — это выделение на электродах составных частей растворённых веществ или продуктов вторичной реакции.
В электролитах, являющихся водными растворами (или расплавами) кислот, щелочей, солей, перенос заряда осуществляется ионами. Такая проводимость называется ионной.
Закон электролиза установлен опытным путём М. Фарадеем.
Масса вещества, выделившегося на электроде за время 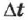 при прохождении электрического тока, пропорциональна силе тока и времени:
при прохождении электрического тока, пропорциональна силе тока и времени:
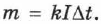
Величину 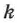 называют электрохимическим эквивалентом данного вещества и выражают в кг/Кл. Электрохимический эквивалент численно равен массе вещества, выделившегося на электродах при переносе ионами заряда
называют электрохимическим эквивалентом данного вещества и выражают в кг/Кл. Электрохимический эквивалент численно равен массе вещества, выделившегося на электродах при переносе ионами заряда 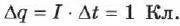
Можно показать, что
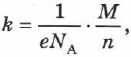
где 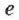 — заряд электрона,
— заряд электрона, 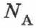 — число Авогадро,
— число Авогадро, 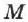 — молярная (или атомная) масса вещества,
— молярная (или атомная) масса вещества, 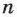 — валентность иона, т. е.
— валентность иона, т. е. 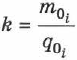 — электрохимический эквивалент равен отношению массы иона к его заряду.
— электрохимический эквивалент равен отношению массы иона к его заряду.
Таким образом, измеряя величины 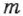 и
и 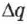 , можно определить электрохимические эквиваленты различных веществ.
, можно определить электрохимические эквиваленты различных веществ.
Формулы могут быть использованы для определения заряда электрона:
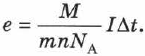
Все входящие в эту формулу величины либо известны 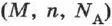 , либо измеряются
, либо измеряются 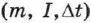 . Именно таким образом в 1874 г. было определено значение
. Именно таким образом в 1874 г. было определено значение 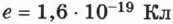 .
.
Эта лекция взята со страницы лекций по всем темам предмета физика:
Возможно эти страницы вам будут полезны:
| Свободные носители электрического заряда в металлах, жидкостях и газах в физике |
| Электрический ток в газах в физике |
| Полупроводники в физике |
| Взаимодействие магнитов в физике |

