Оглавление:
Эквивалент. Закон эквивалентов
Задача 5.
Трехвалентный элемент образует оксид, содержащий 68,90% масс, кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.

Решение:
По закону эквивалентов:
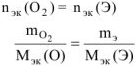
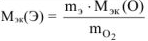 , где
, где 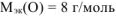
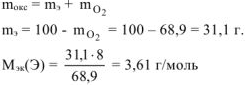
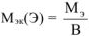 , где В — валентность элемента.
, где В — валентность элемента.
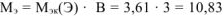 г/моль, что соответствует молекулярной массе атома бора.
г/моль, что соответствует молекулярной массе атома бора.
Ответ: 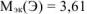 г/моль; элемент — В.
г/моль; элемент — В.
Задача 6.
На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.у. Рассчитать молярные массы эквивалентов оксида и металла. Назвать этот металл.

Решение:
По закону эквивалентов
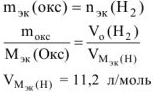
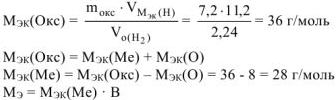
Если 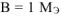 = 28 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если
= 28 г/моль. Такого металла в таблице Д.И. Менделеева нет. Если 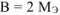 = 56 г/моль. Следовательно,
= 56 г/моль. Следовательно, 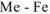
Ответ: 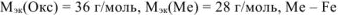
Задача 7.
Хлорид некоторого металла массой 0,493 г обработали избытком раствора 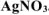 . При этом образовалось 0,86 г
. При этом образовалось 0,86 г 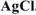 Вычислить молярную массу эквивалента металла и назвать этот металл.
Вычислить молярную массу эквивалента металла и назвать этот металл.
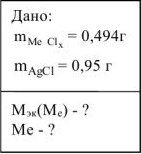
Решение:
По закону эквивалентов:
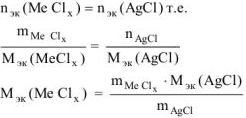
где х — валентность Me, т.к. заряд хлорид иона равен — 1.
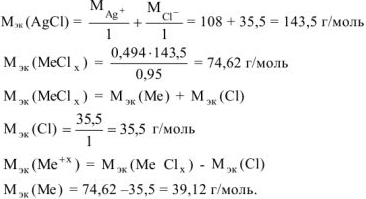
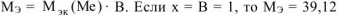 г/моль, что соответствует молярной массе атома калия.
г/моль, что соответствует молярной массе атома калия.
Ответ: 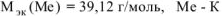
Задача 8.
При растворении 16,25 г двухвалентного металла в кислоте выделилось 6,52 л водорода, собранного над водой и измеренного при температуре 298К и давлении 730 мм рт. ст. Определить молярную массу эквивалента металла и назвать металл. Давление паров воды при температуре 298К равно 23,76 мм рт. ст.

Решение:
По закону эквивалентов
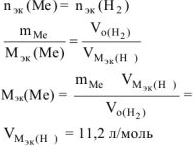
По объединенному уравнению газового состояния
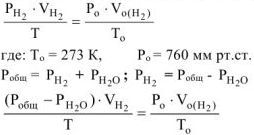
определяем 
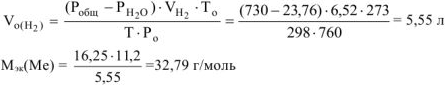
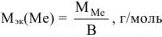 , где В — валентность металла
, где В — валентность металла
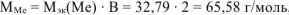 , что соответствует молекулярной массе атома цинка.
, что соответствует молекулярной массе атома цинка.
Ответ: 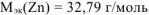 , металл — Zn
, металл — Zn
Задача 9.
При окислении металла израсходовано 3,79 л кислорода, измеренного при 293 К и давлении 740 мм рт.ст. Образовалось 39,43 г оксида. Определить молярные массы эквивалентов металла и оксида. Назвать металл.

Решение:
По закону эквивалентов
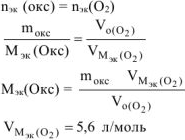
По объединенному уравнению газового состояния
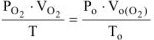
где: 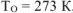 ,
, 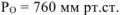
определяем 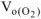
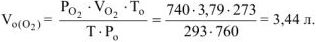
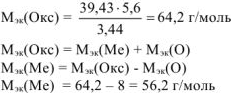
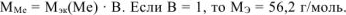 . Такого металла в таблице Д.И. Менделеева нет. Если В = 2, то
. Такого металла в таблице Д.И. Менделеева нет. Если В = 2, то 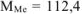 г/моль. Следовательно, металл — кадмий
г/моль. Следовательно, металл — кадмий
Ответ:
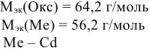
Задача 10.
Написать уравнения реакций взаимодействия гидроксида железа (III) с хлороводородной кислотой с образованием:
а) хлорида дигидроксожелеза (III);
б) хлорида гидроксожелеза (III);
в) хлорида железа (III).
В каждой реакции вычислить молярную массу эквивалента гидроксида железа (III). В одной из реакций определить массу гидроксида железа (III), необходимую для взаимодействия с 3,65 г хлороводородной кислоты.
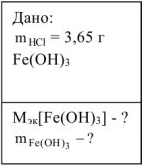
Решение:
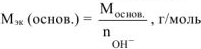
 — число гидроксогрупп, замещенных в данной реакции на кислотный остаток.
— число гидроксогрупп, замещенных в данной реакции на кислотный остаток.
По реакциям а), б) и в):
Определяем 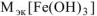
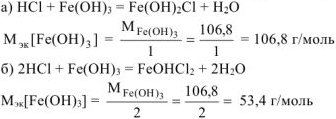
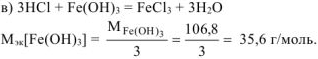
По закону эквивалентов:
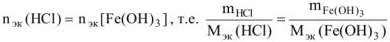
Откуда по реакции (в)
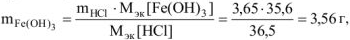
где 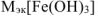 = 35,6 г,моль
= 35,6 г,моль
Ответ:
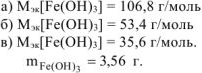
Эти задачи взяты со страницы готовых задач по предмету химия:
Возможно эти страницы вам будут полезны:
| Способы выражения состава раствора задачи с решением |
| Энергетика химических реакций задачи с решением |
| Металлы VIII группы задачи с решением |
| Основные классы неорганических соединений задачи с решением |

