Оглавление:
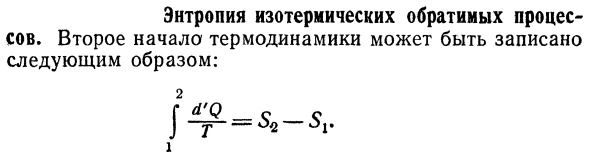



Энтропия изотермических обратимых процессов.
- Изотермический обратимый процесс энтропия Процесс. Можно написать второй закон термодинамики. Следующим образом: Два Я » Р — = = К)%〜» ~~ «* ^ 1# Дж * Один 119.
Преобразование единицы массы жидкости в пар* Потребляется определенное количество тепла Скрытая теплота испарения, то есть Q = A. В этом случае форма Формулы Е, 14) имеет вид: 1 _ ы г-В2-Р> {、 Где S2-энтропия состояния пара, а S {- энтропия состояния пара* Жидкое состояние ПИИ.
В изотермическом процессе Г= const、 Или Норм = С2-Зх. Е, 14) Рассмотрим конкретный пример. Жидкое равновесие* Кости, содержащие насыщенный пар при постоянной температуре* Тула Т. Людмила Фирмаль
Та же формула равна случаю* Жидкая фаза твердая, но только здесь к-скрытая теплота скрытая теплота: Где S2-энтропия жидкой фазы, а Si-энтропия твердого тела* Тело дого.
- Таким образом, энтропия может быть выражена как: Удельные физические величины. Скрытая теплота, пар* Как скрытая теплота плавления, так и температура.
Однако, эти физические Можно только рассчитать количества и Дельта-операции* Пи, но не в абсолютном смысле. Часто используемый Первый и второй принципы термодинамики, вы можете Государственная функция (в частности, entro Энтропии) до константы, то есть до расчета Только различия в значениях этих функций в 2-х состояниях Условия.
Как вы можете видеть, энтропия не измеряется, а вычисляется из Сила других физических величин, которые легко определить Поделитесь опытом. Людмила Фирмаль
Вычисление абсолютного значения функции Государство возможно только с помощью третьего принципа Термодинамика.
Смотрите также:
Решение задач по термодинамике
| Энтропия.Второе начало термодинамики для случая большого числа нагревателей и холодильников. | Энтропия идеального газа. |
| Энтропия. | Энтропия и закон соответственных состояний. |

