Оглавление:




Дросселирование ван-дер-ваальсова газа. Кривая инверсии
- Выжмите газ ван дер Ваальса. Кривая инверсии * Из уравнения ван-дер-Ваальса (p + a / v2) (v-b)= найти частичное RT (ДВ / ДТ),= * п п-в / Т)2-2ab Ф / в * Подставляя значение частного дифференциала в уравнение (14-4), после нескольких допущений получаем следующее приближенное выражение, справедливое для p 0 или v oa. ■ Среда
Или дифференциальный дроссельный эффект АИ = = dTldp ^ б! Ы [^±т(14.7) SR Где cp-удельная теплоемкость при постоянном давлении. A и B-постоянные уравнения Ван-дер-Ваальса. R * — \ = C по эффекту производной Джоуля-Томсона«、 2 А / РТ = б И инвертировать температуру ТМ = 2а / РБ. Экспресс загар при критической температуре, которую вы хотите
газовая постоянная. T-температура газа. Людмила Фирмаль
использовать. Формула(4-3)): Gk = 8a / 27Rb, или alb =(27 / S) RTHt И затем… Таа-(27/4) ГК-6,75 ГК. температура инверсии фактического газа в соответствии с уравнением Ван-дер-Ваальса при Р = 0 в 6,75 раза превышает критическую температуру. Процесс сдавливания тела всегда связан с потерей «доступного» work. In дело в том, что при сжатии газ не выполняет никакой полезной работы на внешних
объектах, а кинетическая энергия газа не изменяется. Таким образом, газ накачивается от давления pt до давления p2, а работа pLvt-p2v2>окружающей среды при продавливании газа через дроссель расходуется на преодоление силы трения, приводящей к фрикционному нагреву. 2 ПН <7mP = Дж ПДВ + Пи вл-П2 П2 = — J в ВДП. Я пирог. Работа трения преобразуется в тепло лотка
- и увеличивает энтропию газа. Полное изменение энтропии газа дросселем равно П. С2-Си = — §(в / Т) ДП. пт Более точное исследование процесса дроссельной заслонки газа ван-дер-Ваальса и экспериментальные данные с использованием фактического газа показывают, что фактический газ имеет бесконечное число точек инверсии, образующих так называемую кривую инверсии диаграммы
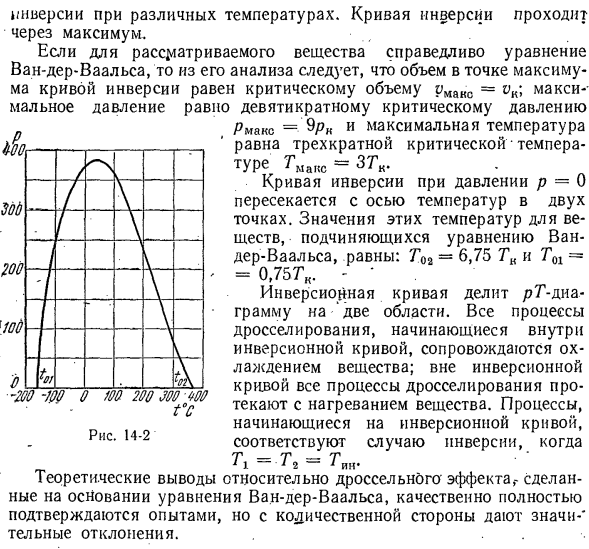
rG. Уравнения кривой инверсии могут быть получены в явном виде из приведенного соотношения, если известно уравнение состояния реального газа. Тав-в (ДГ вещество имеет 2 точки разворота.1 находится в жидкой области, а другой 1 — в области перегретого пара(газообразного). На рис. 14-2 показана кривая инверсии T n = /(p)% азота, построенная
Независимо от величины давления Людмила Фирмаль
по формуле T (dv / dT) p-v = 0.Из рисунка видно, что давление фактически соответствует 2 точкам инверсии при различных температурах. Кривая инверсии проходит через максимальное значение. • Если уравнение ван-дер-Ваальса справедливо для рассматриваемого вещества, то из его анализа следует, что объем в максимальной точке кривой инверсии будет равен критическому объему pmax =максимальное давление будет равно критическому
давлению N pmax = $ Pk и в 9 раз больше максимальной температуры * Температура gmax = zgk, что в 3 раза превышает критическую температуру. * Кривая инверсии при давлении p = 0 пересекает ось температуры в 2 точках. Значение этих температур вещества по формуле ван-дер-Ваальса составляет Г0а= 6,75 ГК и Т01 = 0,75 ГК. -’ Кривая инверсии делит диаграмму pT на 2 области. Все процессы дросселирования, которые начинаются на кривой инверсии,
сопровождаются охлаждением вещества. Вне кривой инверсии все регулировочные процессы происходят при нагревании вещества. Процесс, который начинается с кривой инверсии, соответствует случаю инверсии в случае 7 \ = 7 * 2 = Tin. Теоретические выводы о дроссельном эффекте, сделанные на основе уравнения ван-дер-Ваальса, качественно и полностью подтверждаются экспериментом, но имеются существенные отклонения от количественной стороны. 。 。 200. Сто / К / \ / \ В Семь \ \ )\ Вт Т \ — 200-РГ О М ДЖУ 200 ВТ ВС Рисунок 14-2 м
Смотрите также:
Решение задач по термодинамике
| Истечение идеального газа из комбинированного сопла Лаваля | Изменение энтропии идеальных газов при смешении |
| Дросселирование газа | Абсолютная влажность, влагосодержание и относительная влажность воздуха |

