Пример №1-7.
Для восстановления 23,2 г одного из оксидов железа до металла потребовалось 8,96 л водорода (н. у.). Какой именно оксид железа был взят дли восстановления?
Решение:
Реакция восстановления неизвестного оксида железа на основании закона эквивалентов может быть записана в следующем общем виде:
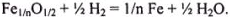
Из уравнения реакции видно, что для восстановления [3(Fe) + 8] г неизвестного оксида железа необходимо Э(Н) = 1,0 г. Из условия задачи следует, что 23,2 г оксида железа прореагировало с 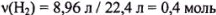 , т. е. с 0,8 г водорода.
, т. е. с 0,8 г водорода.
Решая пропорцию:
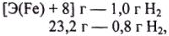
находим 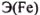 = 21,0 г.
= 21,0 г.
Проведя оценку молярной массы эквивалента железа для всех его известных оксидов, получаем: 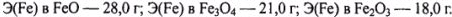
Отсюда следует, что оксидом, взятым для восстановления, является 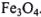 .
.
Этот пример взят со страницы решения задач по химии с примерами:
Возможно эти примеры вам будут полезны:

