Оглавление:
Буферные растворы
Важным случаем кислотно-основного равновесия является равновесие в растворах, содержащих кислотно-основные сопряженные пары и обладающих буферным действием (буферные растворы). Их готовят разными способами: растворяя в воде слабую кислоту и ее соль (буферный раствор кислотного типа); слабое основание и его соль (буферный раствор основного типа); две соли многоосновных кислот разной степени замещения (например 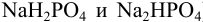 ); проводя реакцию частичной нейтрализации многоосновной кислоты сильным основанием.
); проводя реакцию частичной нейтрализации многоосновной кислоты сильным основанием.
Буферное действие подобных систем проявляется в способности поддерживать 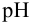 в растворе практически неизменным при внесении в него или образовании в нем некоторых количеств сильной кислоты или основания вследствие замены сильного протолита образующимся слабым.
в растворе практически неизменным при внесении в него или образовании в нем некоторых количеств сильной кислоты или основания вследствие замены сильного протолита образующимся слабым.
В растворе, содержащем сопряженную пару, например НА и 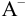 , устанавливаются равновесия:
, устанавливаются равновесия:
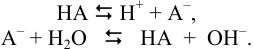
Концентрация ионов водорода в таком растворе (с учетом автопротолиза воды) выражается уравнением:
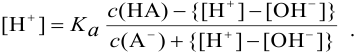
При достаточно высоких концентрациях 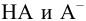 можно считать, что
можно считать, что 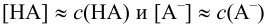 , поэтому, пренебрегая величиной
, поэтому, пренебрегая величиной 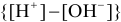 , получаем формулу для приближенной оценки
, получаем формулу для приближенной оценки 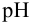 в буферных растворах:
в буферных растворах:
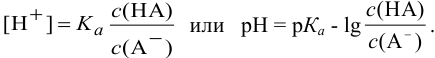
Каждый буферный раствор характеризуется сопротивляемостью к изменениям pH. Количественно ее выражают буферной емкостью 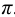 : Она определяется числом молей эквивалентов сильной кислоты или основания, которые нужно добавить, чтобы изменить
: Она определяется числом молей эквивалентов сильной кислоты или основания, которые нужно добавить, чтобы изменить 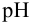 раствора на единицу:
раствора на единицу:
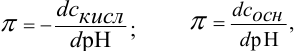
где 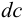 — прирост концентрации сильной кислоты или основания, вызвавший изменение показателя кислотности среды на
— прирост концентрации сильной кислоты или основания, вызвавший изменение показателя кислотности среды на 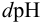 .
.
Буферная емкость связана с концентрацией компонентов буферной системы:
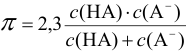
и с константой диссоциации кислоты 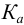 :
:
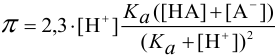
Зная буферную емкость, можно найти изменение 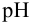 раствора при добавлении сильной кислоты или основания, определить состав буферной смеси и решать другие вопросы. См. также пример 3.16.
раствора при добавлении сильной кислоты или основания, определить состав буферной смеси и решать другие вопросы. См. также пример 3.16.
Пример 3.8.
К 12 мл 0,030 М раствора муравьиной кислоты прибавлено 15 мл 0,15 М раствора формиата калия. Вычислить pH полученной смеси.
Решение:
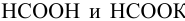 являются компонентами буферной смеси (кислотой и сопряженным основанием). Рассчитаем их концентрации после смешения
являются компонентами буферной смеси (кислотой и сопряженным основанием). Рассчитаем их концентрации после смешения 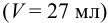 :
:
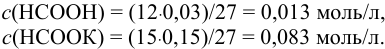
Рассчитаем  кислотного буфера:
кислотного буфера:
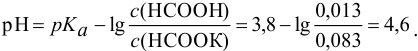
Пример 3.9.
К 20 мл 0,20 М раствора двухзамещенного фосфата калия прибавлено 10 мл 0,25 М раствора 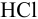 . Определить
. Определить 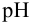 раствора.
раствора.
Решение:
При смешивании данных растворов происходит реакция:
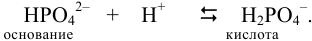
Количество добавленной сильной кислоты меньше, чем 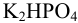 . Поэтому, наряду с образовавшейся в результате реакции солью
. Поэтому, наряду с образовавшейся в результате реакции солью 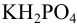 , в растворе будет оставаться
, в растворе будет оставаться 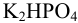 . Рассчитаем концентрации анионов (солей) в образовавшемся буферном растворе с учетом разбавления и взаимодействия:
. Рассчитаем концентрации анионов (солей) в образовавшемся буферном растворе с учетом разбавления и взаимодействия:
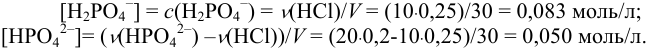
Находим 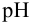 раствора:
раствора:
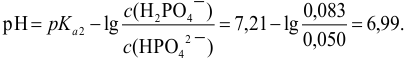
Пример 3.10.
Сравнить эффективность двух буферных растворов:
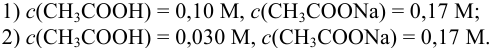
Решение:
Рассчитаем 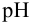 каждого буферного раствора:
каждого буферного раствора:
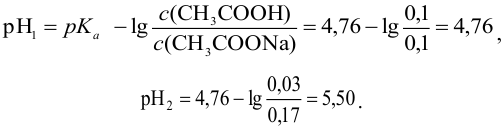
Эффективность буферного раствора будем оценивать по величине буферной емкости. Для этого к каждому буферному раствору “добавим” 0,01 моль 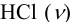 . При этом
. При этом 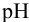 каждого раствора изменится вследствие протекания реакции:
каждого раствора изменится вследствие протекания реакции:
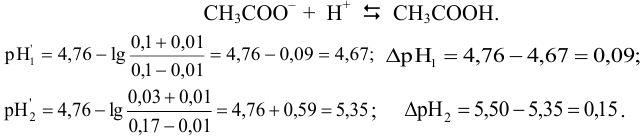
Рассчитаем буферную емкость с учетом формулы (3.12):
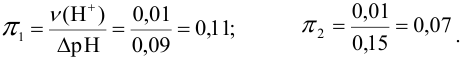
Первый буферный раствор обладает большей буферной емкостью, так как в этом растворе 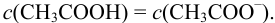
Пример 3.11.
Определить состав аммонийной буферной смеси с 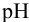 9,25, при добавлении к 0,50 л которой 25 ммоль
9,25, при добавлении к 0,50 л которой 25 ммоль 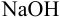 значение pH изменяется не более, чем на 0,050.
значение pH изменяется не более, чем на 0,050.
Решение:
Найдем 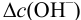 , соответствующее добавляемой в буферный раствор щелочи:
, соответствующее добавляемой в буферный раствор щелочи:
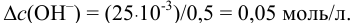
Найдем необходимую буферную емкость по формуле (3.12):
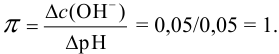
Рассчитаем константу кислотности 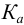 иона аммония:
иона аммония:
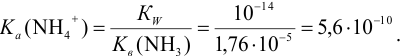
Зная 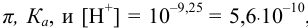 рассчитаем
рассчитаем 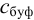 . по формуле (3.14):
. по формуле (3.14):
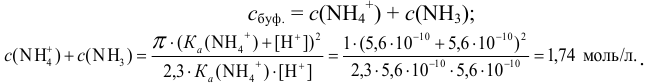
Из уравнения (3.11) находим отношение компонентов:
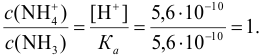
Следовательно, состав смеси: 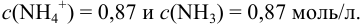
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

