Оглавление:






Азотная кислота
- Азотная кислота Повторить Главу 7. ■Молекулярная структура. Принцип ковалентной связи (I, с. 125), элемент и структурная формула азотной кислоты должны быть выражены следующим образом: .. \ 5:. н: а? НН-о ’ / о: о На таком изображении вместо стабильного 8-электронного слоя показан 10-электронный слой вокруг атома азота(5 электронов атома кислорода в точке, обозначенной 5-электроном азота, обозначенного звездочкой).
- Однако вокруг атомов 2-го периодического элемента, поскольку он не имеет d-орбитали, он может разместить только 8 электронов. Это несоответствие обусловлено донорно-акцепторным механизмом (п. 1) между атомом азота и атомом кислорода. Благодаря этому электронная и структурная формула азотной кислоты может быть представлена следующим образом: * о-о И: о? Н О-О-Н / о:
8) предположим, что существует связь, образованная растворением. Людмила Фирмаль
Однако экспериментально доказано, что в молекуле азотной кислоты между атомом азота и 2 атомами кислорода химическая связь точно такая же, то есть нет двойной связи и одной связи. Поэтому структура молекулы азотной кислоты должна быть выражена следующим образом: НВП ХХ R> 0 Пунктирная линия указывает, что двойная связь распределена между 2 атомами кислорода.
Степень окисления азота молекулами азотной кислоты равна+5, так как 5 электронов движутся от атома азота к атому кислорода. Валентность азота равна 4.Это связано с тем, что существует 4 общие пары электронов. Мы получили ваш feedback. In в лаборатории азотную кислоту получают, слегка нагревая ее до кристаллического нитрата натрия или калия с концентрированной серной кислотой. NaN03 + H2S04-l NaHS04 + HN03t
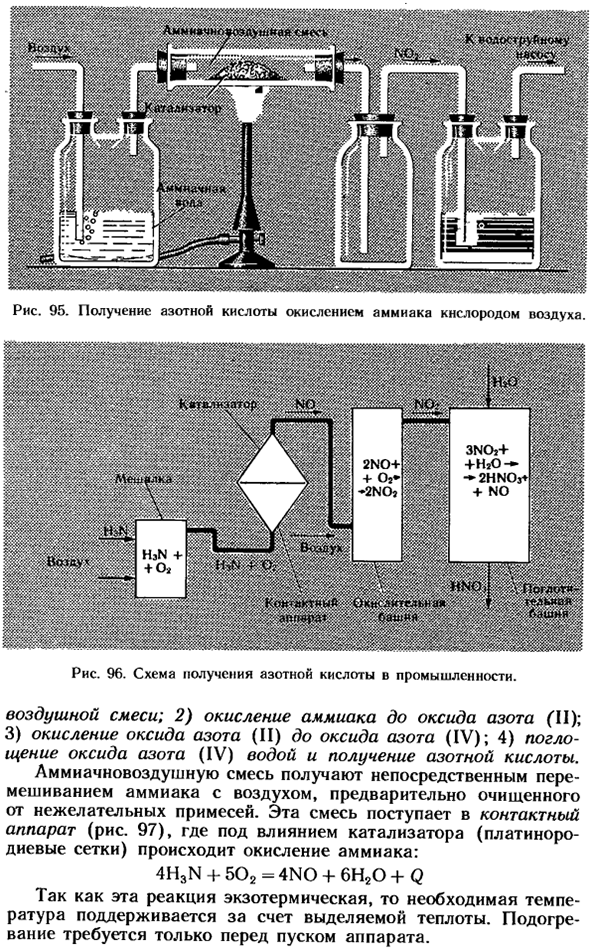
При более сильном нагревании образуется сульфат натрия, что нежелательно, так как в этих условиях азотная кислота разлагается. В промышленности азотную кислоту получают путем окисления аммиака кислородом воздуха в присутствии catalyst. To привыкнуть к этому способу можно с помощью устройства (рис. 95).Когда струя воздуха с добавленным кислородом всасывается, смесь аммиака и воздуха образуется 10-12-процентным раствором аммиака.
Под действием катализатора (порошка хрома (III) или оксида марганца (IV) и смеси асбеста) аммиак окисляется в пробирке, а образовавшийся оксид азота (IV) поглощается в колбу водой, в которую добавляется индикатор. Процесс получения азотной кислоты в промышленности протекает в несколько стадий(рис. 96): 1) Получение аммиака Рисунок 95.
Азотную кислоту получают путем окисления аммиака кислородом воздуха. 3ной + + H2O- — 2HNCV + НЕТ 2НО + + О» * * 2НО? * ■ 5-й»кДж Рисунок 96.Схемы производства азотной кислоты в промышленности. 2) окисление аммиака до оксида азота (II); 3) окисление от оксида азота (II) до оксида азота (IV); 4) поглощение оксида азота (IV) водой и образование азотной кислоты.
Воздушно-аммиачная смесь получается прямым смешением воздуха с аммиаком, который предварительно очищают от нежелательных примесей. Смесь поступает в контактное устройство (рис. 97), где аммиак окисляется под действием катализатора (платино-родиевая сеть). 4h3n + 502 = 4N0 + 6H20 + Q эта реакция экзотермична, поэтому необходимая температура поддерживается генерируемым теплом. Нагревать необходимо только перед запуском прибора.
Окисление от оксида азота (II) до оксида азота (IV) происходит при комнатной температуре. 2N0 + 02 — * 2N02 Поэтому смешанный газ, содержащий оксид азота (IV), выходящий из контактного устройства, охлаждают, пропуская его через паровой котел-утилизатор, где получают водяной пар.
Газовая смесь, содержащая оксид азота (IV), направляется в абсорбционную колонну, где она заполняется фарфоровым кольцом, которое увеличивает контактную поверхность между газом и водой. Вода поступает в башню сверху, а снизу в газовую смесь, содержащую оксид азота (IV) (принцип обратного потока).Возникает реакция: 3NOz +H202HN03-я-нет Из-за избытка кислорода весь оксид азота (II) окисляется до оксида азота (IV), который почти полностью превращается в азотную кислоту.
4N02 + 2H20 4HNp3 + Q Реакция оксида азота (IV) с водой является экзотермической и обратимой. Это связано с тем, что при нагревании азотная кислота разлагается(стр. 34). Так, в обычных установках можно получить раствор с массовой долей 0,50-0,60 или низкой концентрацией, содержащий только 50-60% азотной кислоты acid. To сдвиньте баланс вправо, поднимите pressure.
- In на некоторых заводах при давлении около 5 МПа получают концентрированный раствор, содержащий 0,98 массовой доли или 98% азотной кислоты. Физические характеристики. Чистая азотная кислота представляет собой бесцветную дымящуюся жидкость с раздражающим запахом. Концентрированная азотная кислота обычно окрашивается в желтый цвет.
Этот цвет дает оксид азота (СП). он образуется за счет частичного разложения азотной кислоты и ее растворения. Химические свойства азотной кислоты приведены в таблице 48. А рассмотрим конкретный пример взаимодействия азотной кислоты с металлами.
1.Взаимодействие азотной кислоты с инертными металлами (Pb, Cu, Hg, Ag)’: Людмила Фирмаль
1 в ходе этих реакций выделяется смесь оксидов с различной степенью окисления азота. Рисунок 97.Обратитесь к устройству. Таблица 48.Химические свойства азотной кислоты Снуп! Яблочная кислота Общие с другими кислотами (ПК’nsfnczoskne 1.Для почти полной диссоциации Мала — * ч + + НТС Азотная кислота (похожая на соляную кислоту и серную кислоту) является сильной кислотой 2.
Реагирует с основными оксидами: CuO +2HN03 Cu (N03) 2+Н20 CuO + 2II + + 2N0a—» — Cu2 + — f-2N03 + + H2O CuO-f2H * — * Cu2 + + IIoO I. При нагревании и воздействии света концентрированная азотная кислота разлагается. 411N03 ′ SF 21120 + 4N02t + 021. В результате азотная кислота является мощным окислителем. а) тлеющий Луч в нагретой концентрированной азотной кислоте воспламеняется (рис. 98). б) скипидарное масло в концентрированной азотной кислоте (рис. 99) и опилки Разработка плана» Рисунок 99.
Воспламенение скипидарного масла в концентрированной азотной кислоте. Рисунок 98.Воспламенение тлеющих частиц в концентрированной азотной кислоте нагревают. 3.Реагируя на разум: Фе(о) ч + 3ч бортовым номером 03 + ФК (нос) 3 + 3×20 Фе (он) 3 + 3Н + — Ф 3NOj ^ — ионов FE3 + | −3NOs + 3×20 ФК (Ой я) 3 + 3×3 * Гс3 * + 3×20 4.Реагирует с солями более слабых и летучих кислот(диапазон воздействия кислот, I, P. см. 79): Na2C03 + 21IN03 — » — 2NaN03 + + Н2О + СО2 2Na + + CC ^ «+ 2H + + — * 2Na♦ — f 2N03 » +1120 + C02t COs2 + 2H + — * H20 + C02t 2.
Благодаря взаимодействию концентрированной азотной кислоты и белка образуется ярко-желтое вещество. Поэтому желтые пятна появляются на коже из-за действия азотной кислоты 3.Азотная кислота по-разному реагирует на metals. In в этих реакциях выделяются различные оксиды азота, иногда азот и даже аммиак, в зависимости от концентрации кислоты и восстановительной способности металла.
Это связано с очень высокой окислительной способностью азота при степени окисления+ 5. Сорок пять Hg + 4HNO, — V Hg (NOs) 2 + 2N02t — | — 2H20 Конец 0 + 2 Hg-Hg 1 +5 +4 N + N 2 0 +5 +2 +2 3Hg-f 811 nos 3Hg (N03) 2 + 2NOt + 4H20 sc 0 +2 4-5 42 Н + 3Е — + Н 2.
Взаимодействие азотной кислоты с активными металлами (Ca, Mg, Zn) o +5 +2 «2 3мг + 3мг 8ч Ной (нос) 2-е 2NOt б 41l20 0 +2 мг-2ё — * — мг + 5 42 N + 3 * — N 0 +5 I 2 +1 4Mg + 10HNO3 4Mg (N03)2 + N2Ot + 5II20 Раз Около 4: 2 Мг-2е — + мг 45 4-1 2Н + 8э- * 2Н 4M°g + 1011 N&03 — * * 4Mg (N03) 2 + * NH4NOs + 3HrO Сильно П » 3б 4-2. Мг −3 Н < 2 Мг-2С +5 N + 8 *- Некоторые металлы (Fe, Cr, Ni) с умеренной активностью вообще не реагируют с концентрированной азотной кислотой и разбавляются так же, как и с активными металлами.
Металлы, содержащие золото, платину, осмий, иридий и другие азотные кислоты, не реагируют ни при каких условиях. При работе с концентрированной азотной кислотой требуется предельная осторожность! Избегайте контакта с кожей и одеждой! Применение азотной кислоты показано на рисунке 100. Ответьте на вопросы и выполните упражнения 16-23(стр. 49).Решите задачи 2 и 3(стр. 50).
Смотрите также:
| Аммиак | Соли азотной кислоты |
| Соли аммония | Круговорот азота в природе |

