Оглавление:






















Азот
- Общее содержание азота в азотной коре оценивается в 0,03^.Большая его часть (около 4•1015 г) сосредоточена в атмосфере, основную ее часть (75,6% по массе) составляет свободный азот (N2).Сложные органические производные азота входят в состав всего живого organisms. As в результате гибели этих организмов и распада их остатков образуются более простые азотистые соединения, которые могут накапливаться при благоприятных условиях(главным образом при отсутствии влаги).
- Это очевидное происхождение природных месторождений нанотехнологий в Чили, а также промышленных 1. значение как одного из источников получения связанного азота (то есть азота в виде соединения) 1-2 Поскольку свободный азот содержится в атмосфере, его производство сводится к отделению от кислорода и других компонентов воздуха. .
Технически это осуществляется путем постепенного испарения жидкого воздуха («фракционирования») в специальных installations Людмила Фирмаль
In в этом случае кислород и инертные газы образуются одновременно. В лабораторных условиях азот может быть получен реакцией NH4NT02 = 2H20 + N2-f 80 ккал Он легко прогрессирует при нагревании концентрированного раствора аммиачной селитры 3 В нормальных условиях азот является бесцветным, без запаха gas. It также бесцветен в жидком и твердом состоянии. Температура плавления азота −2°C. Температура кипения на −196 ° С. Растворимость в воде небольшая, около 2 емкости.% *
Молекулы азота-это диатомовые водоросли, которые не распадаются на атомы значительно даже при очень высоких температурах. Свободный азот химически очень инертен. В нормальных условиях он практически не вступает в реакцию с металлоидами или металлами (за исключением Li).Нагревание увеличивает химическую активность главным образом по отношению к металлам, некоторые из которых соединяются с образованием нитридов(таких как MgjNj).
Жидкий азот расходуется в основном для глубокого охлаждения, а газообразный азот расходуется как исходный продукт синтеза различных производных. Соединения азота очень важны для биологии и различных отраслей промышленности. Большая их часть расходуется в качестве минеральных удобрений, а также при изготовлении взрывчатых веществ. Превращение свободного азота воздуха в связанное состояние осуществляется в основном синтезом аммиака.
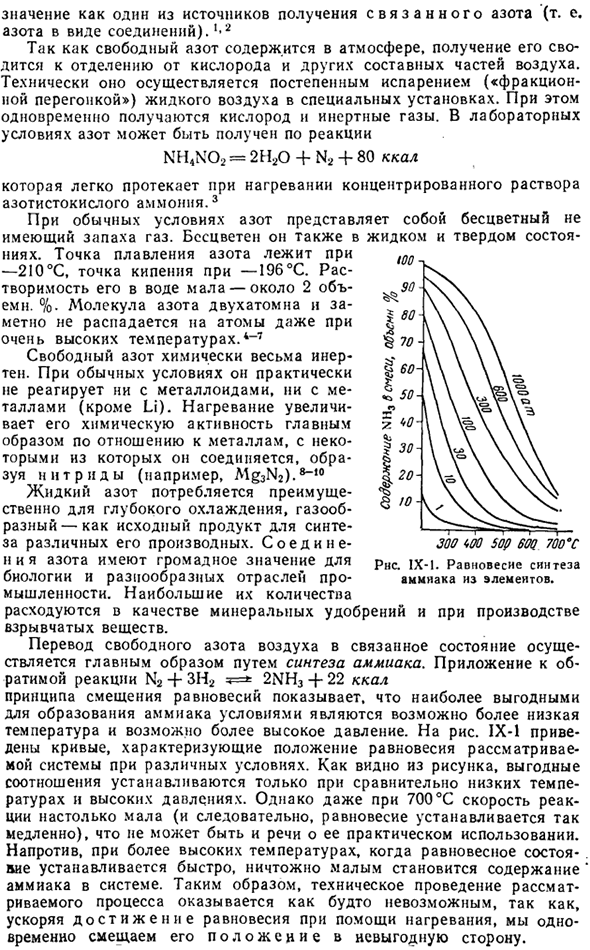
Обратимая реакция приложение N2 — + ■ ЗН22NH3 + 22 ккал Принцип сдвига равновесия показывает, что наиболее благоприятными условиями для образования аммиака являются минимально возможная температура и максимально возможное давление. На рис. IX-1 показана кривая, характеризующая положение равновесия рассматриваемой системы в различных условиях. conditions.
As как видно из рисунка, благоприятное соотношение устанавливается только при относительно низких температурах и высоком давлении. Однако о его практичности не может быть и речи, потому что даже при 700°С скорость реакции очень медленная (и поэтому равновесие устанавливается очень медленно).Наоборот, при более высокой температуре, когда она находится в равновесии.
Это устанавливается немедленно, и содержание аммиака в системе ничтожно мало. Поэтому представляется, что техническая реализация рассматриваемого процесса невозможна. Это неудивительно, ведь он ускоряет достижение равновесия за счет нагрева и одновременно смещает свое положение в неблагоприятную сторону. РНС. IX-1.Баланс синтеза аммиака из элементов. Однако существуют средства ускорения достижения состояния равновесия, без одновременного смещения состояния равновесия. Такая частая помощь является подходящей catalyst. In в этом случае было обнаружено, что металлическое железо хорошо действует(включая примеси A1203 и K2O).
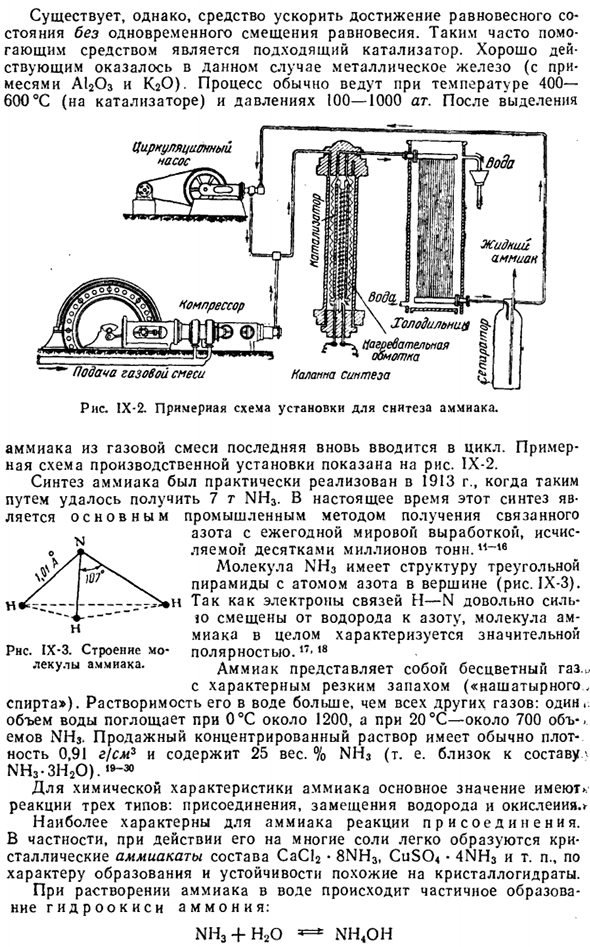
Этот процесс обычно проводят при температуре 400-600 ° С (выше катализатора) и давлении 100-1000 Ат. После отбора Циркуляционный насос Компрессор Холодильник Щ- °木§ § § § § § § § § Газоснабжение Рисунок 1X-2.An примерная установка синтеза аммиака. Аммиак из газовой смеси, последний снова вводится в цикл. Примерная схема производственной установки приведена на рисунке. IX-2. Синтез аммиака был фактически осуществлен через 7 лет, когда NH3 был получен таким способом в 1913 году.
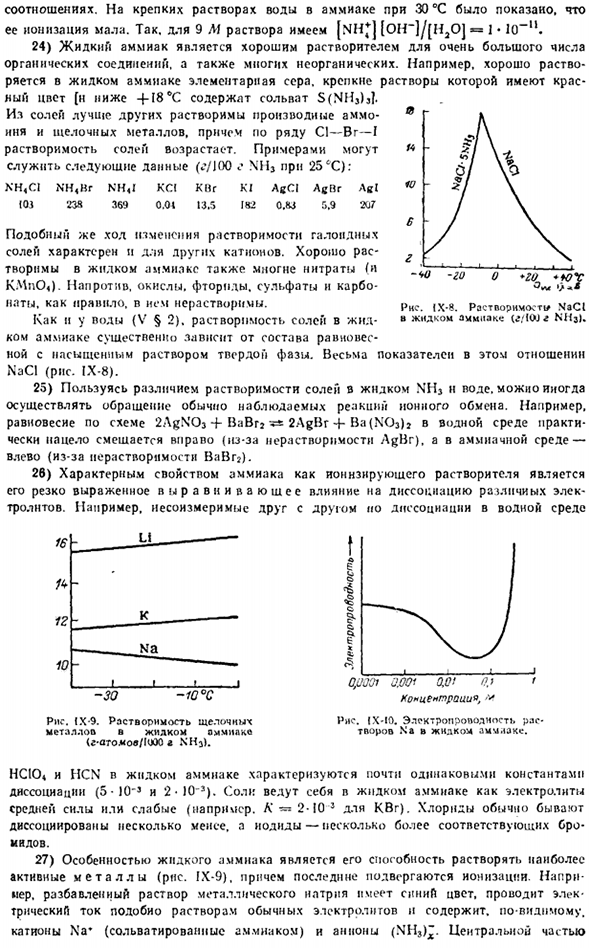
В настоящее время этот синтез является основным промышленным методом получения связанного Ежегодный мировой объем производства составляет десятки миллионов тонн азота. «- * ® В NHj молекула имеет структуру треугольной пирамиды с атомом азота в ее вершине(рис-3). поскольку электроны связи n — H-N достаточно сильно смещаются от водорода к азоту, молекула аммиака характеризуется довольно большим количеством РНС в целом. іх-3.Структура-это молярная концентрация. !7-18 Молекулы аммиака. Аммиак-бесцветный газ…
Сопровождается характерным резким запахом («аммиак, спирт»).Его растворимость в воде больше, чем у всех других газов.1, том воды поглотить около 0°К на около 1200, том на 20°К на около 700. ЭМ NH3.Коммерчески доступные концентрированные растворы обычно содержат плотность 0,91 г / см3, с массой 25 г.%NH3(то есть близок к составу NH3-3H20).19-30 Что касается химических свойств аммиака, то»наиболее важными являются 3 типа реакций: добавление, замещение водорода и окисление». Реакция сложения является наиболее характерной для ammonia.
In в частности, благодаря его действию на многие соли легко образуется кристаллический аммиак такого состава, как CaCl2•8NH3, CuS04•4NH3. При растворении аммиака в воде происходит частичное образование гидроксида аммония. NH3 + H20 NH » OH Жидкий аммиак Синтез галапумы В этом соединении радикал аммония (NH4) играет роль одновалентного металла. Таким образом, электролитическая диссоциация NH * OH продолжается, но становится основным типом. KH4OH ^ НХ * — Ф О ’
Объединение обоих уравнений дает общее представление о равновесии, которое имеет место в водном растворе аммиака. NH3-f-H20 NH4OH NH; — f OH ’ Из-за этих равновесий аммиачная вода(часто просто называемая «аммиаком») имеет резкий запах.
В связи с тем, что концентрация ионов OH в растворе низкая, NHOH считается слабым основанием.1. гидроксид аммония является одним из важнейших химических реагентов, и его разбавленный раствор («аммиак») также используется в медицине и в домашних условиях(для стирки одежды и удаления грязи).31 ″ 33
При добавлении кислоты вышеуказанное равновесие смещается вправо (поскольку ионы OH объединяются), например, аммониевая соль образуется по следующему уравнению: NH4OH + HCI = N, 0 + NH4C! Эти соли также образуются при непосредственном взаимодействии аммиака с кислотами, которое сопровождается выделением тепла. Например, для газообразных NH3 и HCl、 NH3 HCI = MH4C1 + 42 ккал Интересно, что при полном отсутствии воды такой реакции не происходит. Как не-аммония себя(Нжт).Большинство его солей бесцветны.
Большинство из них хорошо растворимы в воде (рис. 1Х-4) и сильно диссоциируют в растворе. Аммонийная Соль играет важную роль во многих производственных процессах и широко используется в лабораториях.34 ″ 41 При нагревании соль аммония очень легко разлагается. Характер разложения определяется свойствами кислот, образующих анионы. Если последний является окислителем, то аммиак окисляется (например, NH4NO2 =2Н2О-f-N2 в вышеуказанной реакции).Если кислота не является окислителем, то характер разложения определяется ее летучестью при температуре разложения.
Из солей нелетучих кислот (например, Н3РО4) выделяется только аммиак, но если кислота Летучая (например, нс1), то при охлаждении она снова охлаждается в NH3.Результат такой разборки и последующего обратного соединения сводится к тому, что рассматриваемая соль (NH4Cl и др.) возгоны. 42-45. Когда сильная щелочь действует на соль аммония, аммиак выделяется в результате реакции. NH4Cl + NaOH = NaC! + NH4OH = NaC! + NН3 + Н20 13 Б. В. Некрасов Диаграмма IX-4.
Растворимость соли аммония(моль / л! И20). Его можно использовать для лабораторного производства аммиака, а также для обнаружения ионов NH «в растворе. К последнему добавляют щелочь, после чего аммиак выделяется под действием запаха или мокрой лакмусовой бумажки. Реакция замещения водорода менее характерна для аммиака, чем реакция присоединения.
Однако при высоких температурах реакция, например, может заменить водород металлом 2A1 + 2NH3 = 2A1M + ZN> + 93 ккал Наиболее часто нитриды получают при раскалении металла в атмосфере аммиака. Последние являются твердыми, и по большей части они очень устойчивы к нагреву. Гидриды активного металла, например, согласно схеме, разлагаются более или менее легко с выделением аммиака Mg3N2-f 6H20 = ZMDON + 2NH3 В целом, нитриды инертных металлов очень устойчивы к воздействию воды.
При замещении только 2 атомов водорода молекулы аммиака получают имид, а при замещении только 1-Амид металла. Первый включает в себя двухвалентные радикалы= NH (они и o-группа), а второй-одновалентный радикал -?\ Н2 (и М и No-группы).Например, путем пропускания сухого NH3 в расплавленный металлический натрий по реакции 2Na + 2NH3 = 2NaNH2 + H2 + 35 ккал Образуется бесцветный кристаллический Амид натрия, который является типичной солью NH2 с anions. In вода, быстро растворяется в соответствии с формулой NaNH2 + H20 = NH3 + NaOH Амид натрия используется для органического синтеза 63-69 Помимо производных металлов, замещенными продуктами аммиачного боролола галогена являются known.
An примером может служить хлорированный азот (NC13), который образуется в виде желтых маслянистых капель при воздействии хлора на сильный раствор хлорида аммония. NH4CI +ЗС12 = 4НС1+ NCI3 При нагревании выше 90°C (или ударе) уже взорванный хлорид азота распадается на элементы. Продуктом, замещающим 1 аммиачный борролол гидроксильной группой, является гидроксиламин (NH2OH).в результате восстановления HX03 в схеме он образуется при электролизе азотной кислоты (с использованием ртутных или свинцовых катодов).
HNO3 + 6H-2H20 + NH2OH Гидроксиламин является бесцветным Crystal. It главным образом использован как сильный разбавитель(окисленный к N2 или N20).82-83 Как замещение водопода, реакция оксидации амиака относительно uncharacteristic. It не горит в воздухе, но воспламеняется в атмосфере кислорода, горя желтым пламенем с образованием азота и водяного пара. 4NH,+ 302 = 6H20 + 2.4,+ 303 ккал
Согласно схеме, хлор и бром энергично реагируют с аммиаком 2NH3-fЗГ2 = 6нг+ N2 Он также окисляет аммиак в solution. In отношение к большинств другим оксидантам, NH3 стабилизировано под нормальными условиями. Наиболее важным продуктом окисления аммиака является гидразин (X2H4), образующийся в результате реакции. 2NH3 + NaOCl = H20 + N2H4 + NaCl Как видно из Формулы, под действием окислителя каждая молекула аммиака в этом случае теряет 1 атом водорода, а оставшиеся радикалы\ H2 присоединяются к каждому other.
So, структурная формула гидразина будет H2N-NH2. Гидразин-это бесцветная жидкость, которая испаряется в воздухе и легко смешивается с водой. Используется в качестве сильного восстановителя (окисление до N2).84-92 Взаимодействие гидразина с азотистой кислотой в схеме N, H4 + HN02 = 2H> 0 + HN3 Азотная кислота (H- \ r = N) является formed.
It представляет собой бесцветную летучую жидкость с резким запахом. Прочность азотной кислоты близка к уксусной кислоте, а растворимость солей (азидов) аналогична соляной кислоте. Как и сам HN3, некоторые азиды сильно взрываются при нагревании или ударе. Это является основанием для использования азида свинца[Pb (\3) 2] в качестве детонатора, вещества, которое вызывает немедленное разложение других взрывчатых веществ в результате взрыва.
Добавь 1) Первые признаки Зота как особого вещества были получены в 1772 году. Природный азот состоит из смеси 2 изотопов-4N (99.G3%) и IJN(0,37%). 2) атом азота в основном состоянии является внешним электронным слоем 2s22 /?Он имеет 3 структуры и является 3-валентным. Ранее рассматривался вопрос о возбуждении других валентных состояний (VI§ 3 постскриптум 9).Непрерывная энергия ионизации азота имеет следующее значение (эВ):14.53; 29.59; 47.43; 77.45; 97.86。
Ионы N * находятся в атмосфере на расстоянии более 500 км(несколько). Сродство атома азота к 1 электрону оценивается в −500 ккал / г для 3+12 ккал / г атомов. 3) разложение NH NO NOj очень пирогенно, поэтому нагревание (до примерно 70°C) необходимо только для того, чтобы начать reaction. In в дальнейшем, наоборот, необходимо избегать быстрого прогрессирования процесса путем охлаждения реакционного сосуда.
Вместо аммиачной селитры можно использовать смесь NaNO2 и NH4Cl. NaNO * + NH4C1 * * при взаимодействии между ними с реакцией NaCl NH4NOj последующее разложение (переход в слабокислую среду желателен) всегда смещает равновесие вправо, так как NH4N02 частично formed. By последовательно проходя через насыщенный раствор (раствор NH4hSO», H2S04 и FeSO»с нагретым насыщенным раствором NaNOj), удобнее удалить небольшое количество NH3, NO и 02 из образующегося газа, затем медленно капать на Белый Жар меди, а затем высушить азот (см. IV§ 1 дополнительно 5).
Азота может быть получена также при нагревании смеси молотых KjCr2Or (2 части по весу) и (NН4) 2S04 (у меня мас).Эта смесь разлагается, как и дихромат аммония (VIII§ 5 Дон.55).Но реакция происходит только при нагревании. Чистейший азот получают пиролизом при 300°с тщательно высушенного азида натрия(по схеме 2NaN3 = 2Na-f-3N2).Контейнер с азотом должен быть черным, с желтой надписью»азот», подчеркнутой коричневой полосой. А3 * 4) в молекулах N2 тройные связи возникают между атомами азота.
Ядерное расстояние< / (N) характеризуется −1.0×5 A. волновое число> = 2331 см1, постоянная силы k = 22.4, энергия диссоциации 226 ККА. Энергия разрыва первой связи из 3 НБ \связей оценивается в 130 ккал! Моль. Потенциал ионизации молекулы N’j очень высок и составляет 15,0 Э. для энергии диссоциации молекулярного Иона N^ вычислено 202 ккал моль.
5) была ли экспериментально установлена замечательная термическая диссоциация N? Атомы до 11a, 3000°C не произойдут. По-видимому, при нормальном давлении степень диссоциации не превышает даже нескольких процентов при 5000°С, фотохимическая диссоциация молекул\ 2 происходит только на атмосферной высотке.
Искусственное получение атомарного азота может быть достигнуто пропусканием газа N (сильно разгерметизированного йода) через поле высокочастотного разряда. Поскольку энергия активации реакций с участием свободных атомов обычно очень мала (часто от 0 /особенно, было показано, что заполнение автомобильными шинами (вместо воздуха) значительно продлевает срок службы.
9) растворимость азота в воде при нормальном давлении очень мала (рисунок V-2), но с ее увеличением значительно возрастает, достигая примерно 7 О6в ом на объем воды, достигая 1000. 10) наиболее характерным валентным состоянием азота является зячнос-3. 0. +3 и+5.Схема окислительно-восстановительного потенциала ©, соответствующая переходу между ними, показана ниже. Значение…… −3 0 +3 +5 Кислая среда…. Дж + 0.-7; +1.45 j + 0.94 j щелочной… j −0.74 | +0.41 j + U. UI { 11) в ходе поиска катализаторов синтеза аммиака было опробовано около 20 000 различных веществ.
Широко используемый железный катализатор обычно находится в атмосфере состава НН2+, \ i2 Geo и GE * 04 (малая примесь Fe. It готовят путем нагревания близкой смеси (в том числе А1203 и Кон). H2S и позже. И. СО2, водяной пар и кислород быстро «отравляют» катализатор, и подаваемая к нему смесь азота и водорода должна быть полностью освобождена от них.
Примерные выходы аммиака (500 куб. см и 300 Ат) показаны на рисунке в зависимости от времени контакта реакционной смеси и катализатора. IX-5.При правильных технологических условиях катализатор будет работать бесперебойно в течение нескольких лет. 12) синтез для дальнейшего развития аммиачной промышленности, при давлении 2000 фунтов на квадратный дюйм, синтез аммиака из смеси азота и водорода также может быть хорошим без специальных катализаторов.
При 850°C и −1500 атм фактический выход NH3 составляет 97%.Особое значение имеет тот факт, что наличие различных примесей в подаваемом Газе не влияет на процесс сверхвысокого давления IRN. 13) В дополнение к прямому синтезу аммиака из элементов, цианид, разработанный в TJ05, имеет некоторое промышленное значение в связывании азота воздуха. Последнее основано на том, что карбид кальция, полученный нагреванием смеси извести и угля в электрической цепи при 1000°с, вступает в реакцию со свободным уравнением»тогда:
Cacnj + C + 2 + N g» + 70 ККА.1.Кальций, полученный таким способом, представляет собой порошок серого цвета (от примесей углерода), как Na, так и амил (Ca = s N-C«N).Под действием пара (то есть нагретого выше 100°G) он разлагается с выделением аммиака: CaCNj +ЗНаО = Cacoj + 2ni l-g 53 KMI. я. 14) печь для производства цианида кальция (рис. IX-6) представляет собой цилиндр из огнеупорного материала, через который проходит труба с внутренней стороны вдоль его оси Нагревательная обмотка. Загрузка измельченного CaC2 в печь Пеклет плотно закрывается и подается азот.
Поскольку образование Цианамида сопровождается выделением тепла, то достаточно нагреть исходную смесь до| 000°С, после чего реакция протекает естественным образом. 15) разложение цианамида кальция водой протекает медленно при нормальной температуре. Поэтому его можно использовать непосредственно в качестве азотного удобрения(правда, его вносят в почву задолго до посева).
Присутствие кальция особенно хорошо для подзолистых почв. «Цианамид играет роль не только азотного удобрения, но и известкового fertilizer. In кроме того, известь является свободной добавкой азота» (Д. И. Прянишников). 16) удобным способом получения Nflj в лаборатории является обработка твердого вещества N1I»C1 насыщенным раствором кон. Генерируемый газ может быть освобожден от прохождения Через емкость, заполненную твердым KOH или свежим прокалевым оксидом кальция (CaO).нельзя использовать Н2$ 0 «и CaC12 для сушки, так как аммиак образует с ними соединения.
17) пирамидальная структура молекул NH3 с энергетической точки зрения только на 6 ккал / моль лучше, чем плоская структура. Молекула эта норария (|i-1.47) и ее потенциал ионизации равен 10.3°. Характерной особенностью муфты N11 является то, что средняя энергия ультразвука колл моль (и постоянная силы до sss 6.4).Но для энергии непрерывной диссоциации атомов водорода приведены значения 104, 95 и 81 каммоль.
Пол при нормальном давлении аммиака разжижается при температуре −33 ° С и затвердевает при температуре-78 ° С. Теплота плавления NHj составляет 1,4 ККА.\ 1 моль. Критическая темпера Диаграмма IX-5. P: «im^’) прогрессия реакции HML Сон отдых JMUIUKJ. Рисунок 1×6.Схема пианамида: соевая печь. Аммиак равен 132SS. Критическое давление-112 атм баллоны, содержащие его, должны быть окрашены в желтый цвет, а на них имеется черная надпись «аммиак».
18) интересным свойством молекул аммиака является их способность структурировать нервы. т. атом азота «выворачивается наизнанку», проходя через дно пирамиды, образованной атомом водорода(рис. IX-3).Поскольку потенциальный барьер для этой инверсии составляет 6 ккал} моль, только молекулы, которые достаточно богаты энергией, не могут действовать в любой данный момент(см. IV§ 2, 8).Скорость инверсии относительно низкая, в 1000 раз ниже скорости ориентации молекул NHj из-за электрического поля.
Инверсия связана с излучением строго определенной частоты (v = 2.387-I0to sec•’). на ее основе было создано оборудование для очень точного измерения времени. С помощью таких «молекулярных часов», в частности, можно было подтвердить, что продолжительность земных суток увеличивается с каждым годом на 0,00043 секунды.
19) аммиак сильно раздражает слизистые оболочки, даже если содержание его в воздухе составляет 0,5%.Острое отравление аммиаком вызывает поражение глаз и дыхательных путей, одышку, пневмонию. Первая помощь-свежий воздух, промывание глаз большим количеством воды, вдыхание пара. Хроническое отравление аммиаком вызывает расстройство желудка, катар верхних дыхательных путей и глухоту.
Предельно допустимой концентрацией перьев в воздухе производственных помещений считается 0,02 мг/л. 10-28 об.%Содержит NTI3, аммиак и воздушную смесь. Взрывчатые вещества. 20) когда строка аммиака пропущена через хэатед отрезок, она окислит и станет свободным азотом. Окисление аммиака озоном приводит к образованию NH4NOj.
Интересно, что обычный молекулярный кислород, смешанный с озоном, также, по-видимому, имеет некоторое участие в этом окислении. Аммиак является превосходным горючим реактивным топливом (II§ 3 стр. 9).Удельные импульсы, развиваемые им в смеси с кислородом, достигают до 270 секунд, в смеси с озоном, а в смеси с фтором до 290 секунд-до 255. 21) подобно воде, жидкий аммиак сильно связан, главным образом из-за образования водородных связей.
Однако в этом случае она будет относительно слабой(энергия связи составляет около 1 ккал / моль). вязкость жидкого аммиака составляет почти 7 минут 1 от вязкости воды. 0.03と0.GI г / см3, соответственно-33 и + 20°С) и диэлектрическая проницаемость (при-00 и+20°С, соответственно, 27 и 17) также значительно ниже. Больше, чем скот. Схема NH3 + NH, NH * + NHJ при электролитической диссоциации пренебрежимо мала, так как жидкий аммиак фактически является током или нет: ионный продукт[NH *] [NHJ] = «-2 * 10» «33(-30°С). 22) его высокая испарительная теплота (5,6 ккал / моль) связана со встречей жидкого аммиака.
Критическая температура NHj-это высокая температура (+ 133°C), которая при испарении забирает много тепла из окружающей среды, поэтому жидкий аммиак действует как рабочее вещество для охлаждения si a w и U. Схема покульзая чиллера на рисунке 1 IX-7.При движении поршня а вправо в змеевик/>поступает нагретый сжатием NHj, охлаждаемый снаружи водой (или воздухом).Охлажденный аммиак также разжижается при давлении в системе (7-8 арг) и поступает в ресивер B.
Затем жидкий аммиак поступает в змеевик G и испаряется за счет вакуума, вызванного движением поршня A. тепло, необходимое для испарения, поглощается из окружающего пространства змеевика G. Если непрерывно повторять весь цикл процесса, то это пространство будет непрерывно охлаждаться. 23) над 0°C (:: давление od), жидкий аммиак смешан с водой、 £ Гвида; «г- Рисунок I. V7.Схема J MJUIIMM. Соотношение. Показано, что в сильном растворе воды в аммиаке при 30°С ионизация происходит small.
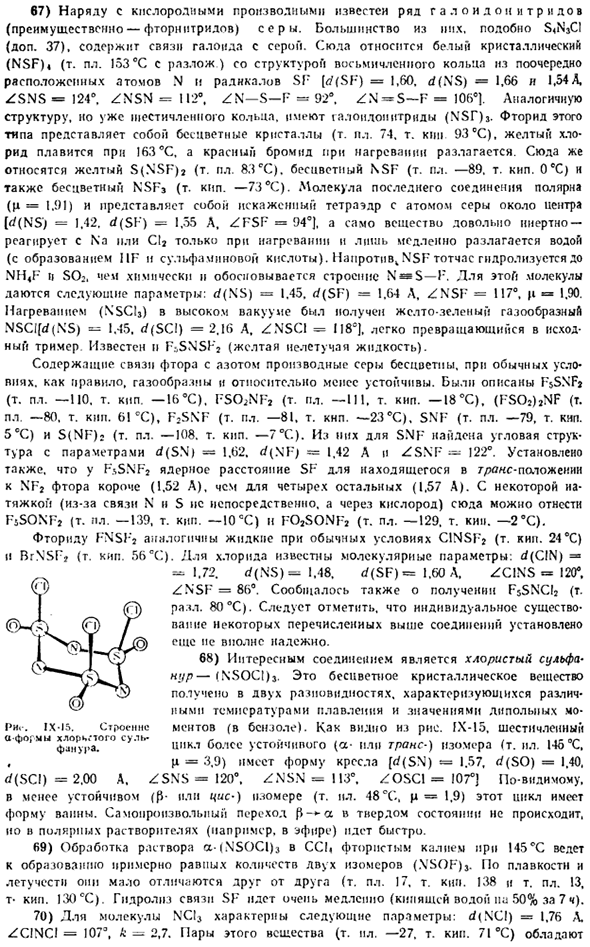
So для 9-м раствора это[NHjj [OH*] / [H2Oj » = 1•10-11. 24) жидкий аммиак является хорошим растворителем для многих органических соединений и многих неорганических соединений. Например, элементарная сера хорошо растворима в жидком аммиаке, а ее сильный раствор красного цвета (при температуре менее+18°С, сольват S (NH3b?)).。 Среди солей наиболее растворимыми производными являются аммоний и щелочные металлы, а в серии C1-Br-I-растворимость солей increases.
An примером могут служить следующие данные (c / 100 g N11 «при 25°C): NH» CI N’H «Br NH» I KS! КБР ки информацию agci Агбр АГЛ 103238369 0.01 13.5 182 0м 5.9 207 Аналогичные изменения растворимости галоидных солей характерны и для других катионов. Многие нитраты I и KMnO также легко растворяются в жидком аммиаке).Наоборот, оксиды, фториды, сульфаты, карбонаты. Как правило, нерастворимы.
Как n у воды (v§ 2).Растворимость солей в жидком аммиаке существенно зависит от состава равновесного с твердой фазой насыщенного раствора. Показателем в этом отношении является NaCl (рисунок IX-8). 25) используя разницу между растворимостью солей в жидком NH3 и воде, можно обратить вспять обычно наблюдаемые реакции ионного обмена.
Например, равновесное состояние по схеме 2AgNOj-BaVr * t * 2AgBr + Ba (NCbh в водной среде перемешивается почти полностью вправо (из-за нерастворимости AgBr).Аммиак средне-левый (из-за нерастворимости Бабр)?это не. 28) свойство аммиака как ионизирующего растворителя заключается в замечательном выравнивающем влиянии на диссоциацию различных электролитов.
Например, они отличаются друг от друга, но в водной среде они диссоциируют т. Шестнадцать 1А —— — __К _ка Джи!1 грамм * 30 Диаграмма IX-9.Растворимость щелочных металлов в жидком масле (г атом * 1/100 л NH3). NSJ и HCN в жидком аммиаке характеризуются почти идентичными константами диссоциации (5 10 * 3 и 2 10 3).Соль действует как средний электролит или слабый электролит в жидком аммиаке(например, K 2-10 5 для KBr).
Обычно хлорид несколько менее диссоциирован, а йодид-чуть более релевантный бромид. 27) особенностью жидкого аммиака является способность растворять наиболее активные металлы (рис. IX-9). кроме того, последний ионизируется. Например. Разбавленный раствор металлического натрия синего цвета и, по-видимому, содержит катионы а *(аммиак и сольватация) и анионы (NH5)〜которые текут по току, как обычный раствор электролита. Чубу Th > 20. (ИЗ Рис-8.
Растворимость в жидком аммиаке VaCl (g / lQJ g NH)|、 * JJ001 0.0’OJ ко.»Другие、 −10°С Рисунок IX-I0. Электрическая проводимость раствора жидкого аммиака XA. Такой сложный Анон представляет собой свободный электрон, который имеет поляризованное взаимодействие с окружающей средой (то есть полярности).при более высокой концентрации Na раствор принимает форму бронзы, что указывает на металлический проводящий Фрис.
10).То есть он содержит аммиак вместе с сольватированной водой. Очевидно, свободные электроны тоже. При температуре менее −42°С синяя и бронзовая фазы могут сосуществовать без перемешивания длительное хранение раствора натрия в жидком аммиаке сопровождается обесцвечиванием в результате очень медленной реакции, но по схеме: 2Na-4-2 \ LJ * 2NaNH*+. Аналогичная реакция протекает через несколько минут (растворимость NIIj 50 г на 1000 г 25 г).
28) склонность к расщеплению валентных электронов в металлах, растворенных в NHj, создает возможность проведения своеобразной реакции замещения. Например, растворимость в жидком аммиаке Ko и нерастворимые в Чвго. Калий можно заменить кальцием, по схеме 2KCI + Ca CaClj-f 2K. 29) имеются интересные признаки того, что пропитка жидким аммиаком значительно повышает пластичность древесины.
Это позволяет относительно легко придать определенную заданную форму, которая сохраняется после удаления аммиака. 30) растворение аммиака в воде сопровождается выделением тепла (оно становится 8 ккал / моль).Влияние температуры на растворимость описано в следующих данных, которые показывают количество частей по массе NHj.
Поглощается 1 тяжелой частью коровы(под давлением атмосферного аммиака): Температура. Это очень важно……. 0 10 3) S) » 0 100 Непонятно, сколько именно…….. 2.78 O. J » 7 0.63 0.40 0.23 0.13 0.07 В нормальных условиях, раствор аммиака около 3 ppm показывает максимальную электрическую проводимость. Растворимость в органических растворителях значительно ниже, чем в воде. 31) гидроксид аммония сам по себе совершенно нестабилен в нормальных условиях, но он всегда присутствует в аммиаке water.
As упомянутый в тексте 1 объем воды поглощает около 700 объемов аммиака. Если бы имело место только простое физическое растворение NHj (как при сжатии газовой системы), давление пара на раствор было бы неизмеримо выше того, что фактически наблюдается. Из 2-х основных причин, по которым давление растворенного МПЗ может резко упасть таким образом. 1, ионизация по схеме NH3-fH20NH * +ОН. Из-за своей незначительности она не может играть решающей роли.
Поэтому эта роль должна быть отведена гидратации молекул NHj, что является второй мыслимой причиной. Это связано с образованием 2-х типов водородных связей H3N HOH и HjO-HNH *(IV§ 3 add.7) может быть выполнено путем: водород более положительно поляризован в воде и имеет протонное сродство к азоту(v§ 5 дол.5) выше кислорода, поэтому взаимодействие в основном приводит к образованию молекулы Hjenhoh или NH 0 0H, то есть гидроксида аммония.
Средняя продолжительность жизни отдельных молекул Н3ХНОН в растворе аммиака явно очень коротка (порядка 2-10 секунд).Такие молекулы постоянно разрушаются и вновь возникают (равновесная характеристика NHj +Н«0 ** h3nhoh) значение K * = 0.2) низкая стабильность, поэтому присутствие гидроксида аммония (NHOH OH) часто полностью игнорируется (даже в качестве промежуточного продукта электролитической диссоциации: H, N —f HOH ^ Zt4oh). NH * 4-OH’) — по существу, такое отрицание основано на ионных выражениях, которые действуют сознательно или «бессознательно». Одни только соображения\ I4ON-типичный пример метафизического подхода.
Для метафизика объекты и их ментальное изображение, то есть понятия, являются отдельными, неизменными и застывшими. Другой»(Ru- Гель.)Между тем, все соли аммония произведены от NH. Он уже имеет право на существование в химической практике, независимо от природы или стабильности внутримолекулярной связи(см. I§ 3 additional 2). Анализируя данные о распределении NH между водой и органическими жидкостями, можно увидеть, что более 90% всего аммиака, растворенного в воде, находится в гидратированном виде.
Для газовой фазы над раствором аммиака, 2NH5 +Н20* * 2N! Равновесие устанавливалось по схеме Lj-lbO + 18 ккал, и при 20°с оно характеризовалось величиной K = 1•10-4. 32) в присутствии молекул NHj в растворе одновременно с NH4OH(гидратированным и»просто»растворенным по 2-му типу) выражение константы диссоциации гидроксида аммония может быть описано в следующей уточненной форме. (Нью-Хэмпшир«Оли+ НСЗ | Однако многие другие системы электролиза (такие как SOj + lfoO) находятся в аналогичном положении, поэтому в этом случае нет особых причин для конкретизации.
Температурная зависимость константы диссоциации NH4OH показана на рисунке. V-18.In обычный водный аммиак, рН = 11.6.In нормальный 11.1 и нормальный 10.6. 33) коммерчески доступный аммиак обычно содержит около 10%аммиака. Он находит медицинскую помощь use. In в частности, вдыхание или проглатывание паров (1 капля от 3 до 10 капель на стакан воды)используется для облегчения тяжелой интоксикации. Если кожу смазать нашатырным спиртом, то эффект от укусов насекомых будет reduced.
It удобно протирать окна, мыть полы, окрашенные масляной краской с очень разбавленным аммиаком, удалять следы сильных мух. Чистые серебряные или никелированные предметы. При удалении пятна часто следующий состав(объем) дает хороший результат: а) 4 части аммиака. Эфир 5 частей и винный спирт (денатурат) 7 частей. б) аммиак 5 частей.2 части бензина и 10 частей винного спирта. в) 10 частей аммиака.7 частей винного спирта. Хлороформ 3 части и бензин 80 частей. г) аммиак 5 частей. 3 части ацетона и 20 частей спиртового мыла solution.
It рекомендуется сначала протереть масляную краску на одежде ватой, смоченной скипидаром, а затем с помощью ammonia. To для удаления чернильных пятен, как правило, достаточно обработать аммиаком и промыть водой. 34) кислотная диссоциация неаммония по NH * NHS + H «соответствует следующему постоянному значению: 0°C при 8-10 м. B-10»: 25°C при 0 и 50°C при 3-10®.Таким образом, диссоциация очень мала и не может сравниться с диссоциацией аммониевых Солей по обычному типу.
Кислотная диссоциация самого аммиака (по схеме NH, II * — N1 I) соответствует постоянному значению порядка 10’^. его реально не существует, а электронное сродство радикалов NH оценивается в 25 ккал / моль. 35) в газовой фазе ионы NH * могут связывать молекулы NHj. Тепловой эффект реакции обусловлен схемой NH *(NH3) n + NHj ^ NH ^ NII.)^, увеличение n(ккал / моль): 27 (n«0). 17(1). 16.5(2). 14.5(3)、7.5(4)。
38) высокотемпературный хлорид аммония («аммиак») вступает в реакцию с оксидами металлов и обнажает чистые металлические поверхности. в е-ом его применение основано на пайке металла. Часто вводят в состав дымовой смеси (такие смеси могут включать, например, 50% по массе NH4CL, 20 нафталинов, 10 древесных углей, 20KClOj). в электротехнике «P4C1» используется для производства»сухих» гальванических элементов. Отхаркивающее средство может быть назначено перорально (в виде передозировки) в медицине.
В этом отношении интересен аммоннфлюорнд (NH «F»).Растворим во льду(до 10% по массе).Аммиачная селитра (NH4N03) является основой комплексных азотных удобрений, что также помогает при приготовлении взрывчатых смесей. С В NH4CIO4 его часто добавляют в твердотопливные печи. Когда порошок NH » XO » смешивают с водой (1: 1 по массе) и охлаждают до −13 Кнюхсо], сульфат аммония получают в сельском хозяйстве в больших количествах в качестве азотного удобрения.
При нагревании до 357 СС аммиак частично удаляется и разлагается, но чистый NH4HSO4 не только плавится, но и кипит без разложения(mp 251. mp.490°с).Карбонат аммония (NH «HCO») используется в хлебопечении (в основном в кондитерской промышленности).в его основе лежит NH4HCO4 = NHj +Н20+СОспособность легко разрушаться при нагревании по схеме.
Сульфид аммония [(NH4) 2SJ является одним из основных реагентов аналитической химии 1 — g 808. 37) взаимодействие NH C1 C1 с оксидами металлов при нагревании происходит по следующей схеме: 4MeO + 2NH C CI = 4H20 + M2 + + MeCb + 3Me и MeO + 2NHMC1 =eMeCb + 2NH3 + H ^ O. In в первом случае основным процессом является восстановление оксидов аммиаком.
Направление такой реакции характерно для оксидов относительно инертных металлов (например, Cu). Во 2-м случае взаимодействие сопровождается появлением только летучих хлоридов при нагревании. То есть, простая реакция ионного обмена. 38)» сухое » 1 устройство типа гальванического элемента схематично показано на рисунке. IX-II. катод представляет собой внешнюю цинковую оболочку элемента (а), а анод-углеродный стержень(5).
Вокруг него, смесь тонкоизмельченного графита и Mn02 окружена ножнами из ткани (B).Зазор между анодом и катодом заполняют влажной пастой (Г) из мухи И NH4CI. Налейте слой смолы (D) сверху в контейнер, чтобы предотвратить испарение воды. Работа элементов протекает по схеме Отрицательный электрод положительный электрод ЗН = ЗН *#+ 2С + 2NH * + 2е = 2NH4 И (вторичная реакция): 2NH4 =-2NH3 + 2H 2H + MnOj-Н20+ MnO 2NH3 +2Н20= 2NH4OH Сухие элементы на самом деле используются очень широко.
39) взрывной распад NJ ^ noj происходит в основном распаде по формуле: 2NHtNOj4П20+ N2 4 02 + 57 ккал. Аммов используется в практике взрывных работ Это близкая смесь аммиачной селитры (72%), алюминиевой пудры (25) и угля (3%).Эта смесь будет только детонировать от взрыва.
40) твердое реактивное топливо состоит из полностью гомогенизированной (то есть равномерно восстановленной) смеси окислителей, топлива и специальных присадок (что способствует ускоренному сгоранию, стабильности хранения и др.).Присущий ему импульс почти такой же, как у смеси спирта и кислорода(II § 3 постскриптум 9).
Наиболее подходящими окислителями являются: отель NH 4 Кло 4 および NH NO NO、なびになどの合成ポリマーは 、 燃料料として機能し 通常、такого топлива, например, 755%の НХ co4 4 、 、 得られた 可燃性 горючих полимеров и 3%の特な 添加剤加剤を 含加In отсутствие топлива, пиролиз chloronoxyanmonium протекает преимущественно по следующей формуле: 4NH4CIO4 =6Н20+4ПС1 + + 2n2 операций-±502 + 157 ккал. Для твердого реактивного топлива существует монография.
41) коксовый газ всегда будет служить источником промышленного производства (NH4) 2S04, наряду с различными другими веществами, включая аммиак. В среднем 1 тонна кокса перерабатывается на кокс * Григорьев А. И. твердый реактивный верхний обод. М..«Химия», 969.Но、 Рисунок Х-11.Схема сухого элемента. Сульфат аммония 12 кг.Последний является значительно более концентрированным азотным удобрением, чем manure.So при внесении в почву 1 кг комбинированного азота, около 200 кг удобрения или 5 кг (NHO2SO4.
- 42) как правило, аммониевые соли того же структурного типа более устойчивы к нагреванию, а образующие их кислоты более сильны (если кислота действует как окислитель).Таким образом, термическая стабильность соли снижается в ряду:HI-HBr-HCI-HF-HSH-HOH.
Давление диссоциации NH SH SH превышено.Искусство.Уже при комнатной температуре.Но константа диссоциации кислоты HSH (AS, «MO7») несравнимо велика. В этих условиях фактически образуются 2 кристаллогидрата-состав соответствует 2 \Н3 ~ Н20 и NHj-H20, соответствующий оксид аммония [(NII «hO) и его гидрат (NH» OH). как видно из рисунка IX-12.Первое соединение плавится (разлагается) при -78. 2-й -77°C. кристаллогидраты также известны как h3-2H20 (mp.- 97°с).
Так, соединения аммиака с водой будут находиться в стабильном свободном состоянии только при низких температурах. Людмила Фирмаль
Кристаллы NHOH OH основаны на водородных связях (в скобках указаны расстояния между крайними атомами) OH-N (2,78 а), NH-0 (в среднем 3,25 а), OH-O (2,76 л), связи NH – N отсутствуют. Благодаря сильному охлаждающему взаимодействию аммиака с эфирным раствором Н202 получены производные аналогичной перекиси водорода— NH3 (mp – 24°C) и (NH4) a02 (MP-93°C). В отличие от NH4OH, первое из этих пероксидных соединений имеет конскую структуру.
43) взятие хлорида аммония соединением накаливания (NHi) jS04 + 2.\ aC1 может служить так называемым примером.Транспортная реакция.Его особенностью является формирование конечного продукта, независимо от величины расстояния от оригинала.Такой процесс обычно происходит в среднем газообразном состоянии phase.So в рассматриваемом случае, когда исходная смесь нагревается, мы получаем Nra3SO » + 2NHjf.Транспортированные реакции могут быть использованы для выделения, очистки или выращивания кристаллов.
Есть специальная монография. 44) на примере хлористого аммония удобно коснуться общих точек различных понятий, присутствующих в современном chemistry.So в NHC CI степень окисления атома азота (ziachost) равна -3. ковалентность 4. электровалентность-j-1 и суммарная валентность 5.И для его эффективного заряда было предложено значение -0,45. 45) попытки выделения радикалов аммония (KH“) в свободном состоянии потерпели неудачу, поскольку в нормальных условиях они уже разлагались на аммиак и водород в момент образования по схеме:2NH- — 2NH3 + Hj.
Тем не менее, при очень низких температурах, этот радикал присутствует из-за сильного замедления реакции разложения.Видимо, может. Когда NHJ воздействует на синий раствор металлического натрия в жидком аммиаке, он становится бесцветным в результате реакции по схеме: Na-f-NH «l в N» 1-f-NM4.In в этом случае развития водорода не наблюдается, а поскольку образующаяся бесцветная жидкость легко прилипает к йоду(вероятно, по схеме 2NH»•+•12 2NHAJ), она гораздо чаще содержит свободный NH4.
Замечательное разложение последнего с образованием водорода начинается только при температуре -40°С и выше. Связь между молекулой NH3 и атомом водорода явно обусловлена межмолекулярными силами.Существует предположение, что свободный аммоний является важным компонентом планет Уран и Нептун.
1-н-. Иш-П2. Температура системы NHj-HjO nd1-Olen. * W » fer G. Hnmmchs’km: транспортная реакция.Пер он и..Эд.П. Luzica. М. «Мир», 19W. 189 секунд 46) Как уже упоминалось в тексте, некоторые нитриды могут быть получены прямым взаимодействием металла и азота при нагревании. Например, марганец выше 1200°C будет светиться в атмосфере азота и образовывать MnjNj. На основе аммиака свободные металлы часто могут быть заменены их оксидами или галогенидами.
И реакция протекает по уравнению, например: 3Cu20 4 — + 2MNz = ZN20 + 2CujN или CrClj 4-N113 = 3HCI + CrN. Прохождение этих процессов обусловлено летучестью воды или Галогенида водорода при высоких температурах образования нитритов. Во многих нитридах валентность металла видна, но состав совместим с его обычным значением, в других случаях самая простая формула сама указывает на сложность structure.
So, среди уже рассмотренных нитридов металлов к первым типам относятся Mii3N2, M » jN2, CrN, MoN, WN. Во-Вторых-Мнен5. Mn, N. Mn N N, Re3N, Re2N. Cr2N, M03N, Mo2.\ , W2N. есть монография по нитридам. 47) помимо нитридов, продуктами, полностью заменяющими металл аммиачным водородом, являются также более сложные производные, такие как собственный оксонитрид, черный нитрогалид NReF и NMoCl, а также коричневый NM0CI3.
Оранжевый NWCI3.Желтые соли состава K ^ ReOjNj и K3 (MoO3X).Для коричневого типа Lb3Ns (E — Cr, Mo, W) [Reojn’J2-ion, задается следующий параметр: d (ReO)= 1.80.d (ReN)= 1,65 A. Ar (RcO)= 6.24.to (Рен)= 7.95.It также сообщалось, что NWCIj, который имеет полимерную группу и стабилен до 340 eC в воздухе, был сообщен. 48) нитрильные производные металлоидного элемента, которые уже были изучены, серы наиболее разнообразны.
Наиболее важным из них является нитрид состава S»N», который обычно называют азотсодержащей серой. Последний образуется при взаимодействии серы и жидкого аммиака: I6NH3-f-6 (NH4) 2S 4-S «N».Равновесие этой обратимой реакции может быть сдвинуто вправо добавлением Agl. Связывают не-S2 по схеме: (N.’H4) 2S 4-2Agl = Ag2S | — f 2. \ H » I. при испарении из фильтрата выделяется закись азота.
ОИА также может быть очищен вакуумной перегонкой Перекристаллизация из сероуглерода или безола. Аналогичное производное азота известно для Селена, но нитрид теллура соответствует формуле TesN. 49) теплота образования азотистой серы из элементов отрицательная (-110 ккал / моль).Молекула S4N4 (0,52 в q = бензоле или 0,72 в CS2).Для нее 2 из них были показаны на схеме.
IX-13 разнообразие пространственных структур. Большинство исследователей рассматривают правильный формат/>.Валентное отношение последнего неизвестно. По-видимому, NN связей нет, и реализуется слабая, но все же истинная валентная связь между атомами серы(то есть, в конце концов, азот имеет 3-валентность, а сера-4-валентность). Энергия связи МС оценивается в 73 ккал / моль (без учета связывания СС).
Чистый азот серы образует оранжево-желтые кристаллы (mp 179°С).в очаге он нерастворим, но очень медленно разлагается при контакте с ним. В основном по схеме: 2S4N + 15N. 0 = 2(NH4) 2Sj06 4-(NH4) 2S203-f 2NH3.С помощью концентрированной гидроиодной кислоты можно восстанавливать H2S и NH3 по схеме: S4N4 4-20N1-4H2S 4-4NH? 4-1012.При нагревании выше температуры плавления (и при столкновении) азотсодержащая сера взрывается и разлагается на элементы. Оранжево-красный Se <N » 4 и желтый Te3M4 еще более взрывоопасны.
Первая теплота получения этих соединений составляет-163 ккал / моль. / моль. 50) за счет взаимодействия SJI с хлоридом серы получается бледно-желтое твердое вещество S4NjC1, а в отсутствие воды и воздуха GA7L 2.581 Рисунок IX П. SC. ch. L1 znichnich структура молекулы S«. Ст. * Самсонов Г. В. Нитриды. Киевская «Наукооа Думка», (060,390 сек Высокая термостойкость (разлагается в вакууме только при 170°С) известны и некоторые другие соли катионов S4N3(например, Br», NCS», NOJ, HS0″).
Согласно генетическим структурным данным, 1 SS-связывание (d = 2.06 A) и 6 NS-связывание (среднее d-1.55 A).Валентные отношения в нем неизвестны, и, несмотря на наличие этих данных, структура, указанная на рисунке IX-I4 (XII§ 2 add.30) представляется вероятным. 51) при пиролизе паров азота и серы (0,01 ° С под давлением 300 мм рт. ст.) получают бесцветный SgN’.Летучие (с запахом йода), растворимые во многих органических жидкостях.
Внезапная деградация этого нитрида и элемента уже была вызвана его измельчением или нагреванием до-f30°C. Для хранения при низких температурах большое значение имеет обычный растворитель (- S-N — = S = N -) * S x. In влажный воздух, димер главным образом получен. Во время сушки-полимер. Послсдин-золотисто-желтый с металлическим блеском n в сжатом состоянии и обладает полупроводниковыми свойствами.
52) в присутствии CS2 закись азота получают нагреванием S4na с серой до 110°С (под давлением) с последующей отгонкой продукта реакции в высоком вакууме (формула SsNj была принята ранее).Его молекула представляет собой 2-членное 6-членное кольцо типа S (=N-S -).Это темно-красное вещество плавится при температуре+ 23 ° С. Но затвердевает только в сложных случаях (потому что легко переохлаждается).оно имеет очень сильный запах и растворяется во многих органических жидкостях (но не по своей воле).В нормальных условиях S2 медленно взрывается при 100°C.
It также сообщалось, что был получен растворимый в НИТРИДАХ CS2 Sn \ ’2 (т. е. температура разложения 150°C).Это связано с бициклической конической структурой с N — S-N группами, общими для 2 колец атомов серы. Есть обзорная статья об азотных соединениях серы. 53) синтез NaNHj посредством реакций, описанных в тексте протекает хорошо при температуре 350°С. структурные параметры в NH™Иона (РФ (ХН’) = » 1.03 А. ZHNH = 104, к =» 5.7]находится рядом с соответствующими данными аммиака.
В расплавленном состоянии, Амид натрия (Мп 206°С), проводит электричество, среди других амидов, только производные наиболее активных металлов являются относительно стабильными за отопление, а остальное можно легко раскладывается(в некоторых случаях взрыва).Например, Cr (NH * b уже начнет разбирать аммиак) 100 * C Амид металла, растворенный в жидком аммиаке, действует как типичное основание(см. v§ 5, 4).Жидкость n’J лучше всего плавится В амид Cs.
Растворимость Rb и K. еще хуже, а производные других металлов слабо растворяются или практически нерастворимы. 54) имид металла плохо изучен. Производные наиболее активных металлов используют реакцию в жидком аммиаке, амидах (например по схеме 2LiNH2 = NH3 * + Li2NH) и некоторых других(например Go. Вы можете получить его, нагревая его тщательно (Sn).
При дальнейшем нагревании имид металла переходит в соответствующий нитрид или полностью разлагается(что может повлечь за собой взрыв). 55) в отличие от металлов, производные нмидов очень характерны для серы. Это и есть natural. In в частности, 2 валентности имино group. As в результате он становится валентным, как атом серы.
С точки зрения структуры часть атома серы образуется непосредственно из молекулы S * путем замены атома серы в ней радикалом N11(рис. VI11-9).Во-первых, это относится к S / NI1 (гептасульфурий и m).1. это один из продуктов химического взаимодействия серы и жидкости ammonia. In эта молекула, d (NS)= 1.73 A и ZSNS = 116°, остальные параметры очень Н. Н. Н. Н Рисунок| \ −11.Расчетная структура ионов — Виртуальная реальность. * Вознесенский С. А..
Успехи в химии, $ 195. Си 4.- Нет. Близки к данным элементной серы. Неустойчивый в нормальных условиях, этот бесцветный твердый водород (mp 113°C) может быть заменен атомами или радикалами, как металлическими, так и полуметаллическими. Например, известны зеленые натриевые соли(NaNS;) и красная сульфоновая кислота (SjNSOjU).Благодаря взаимодействию гептасульфуримнила и хлорида серы (SC12 или S2X2), HCl удаляется и образуется желтоватое нитридное производное, S (NS?), добавляемый. A (mp 137°C) или Sj (NS7) a (mp 100°C с разложением) является formed.
it это не так. Обе этнические группы хорошо растворимы в дисульфиде углерода и гораздо более стабильны, чем другие азотированные серы. Их гидролиз под действием водного раствора сильных щелочей происходит только при длительном нагревании. 56) кроме S / NH, известны S (NH) 2 (3 изомера). S «(KHh (2 изомера) и S4 (NH) 4.
Все этносульфимиды имеют структуру 8-членного кольца (радикалы NH отделены друг от друга атомами серы) и представляют собой бесцветные кристаллические вещества с водородной подвижностью, аналогичной S; NH. Хорошо изученный-S «(NM) » получают путем тщательного восстановления S N |(например, хлорида олова в спиртобензольной среде).Йод окисляется действием (например, Br2) и легко окисляется снова до первого нитрида. S4(N’h) — это «плоское 8-кольцевое кольцо» [средние и предыдущие значения: d(SN)= 1.65, d (NH)= 1.04 A. ZSNS= 126 и 129°,ZNSN = 109 и 111°).
57) нагрев S «(NIi) » в воздухе сопровождается добавлением атомов кислорода к сере и(OS) i (NHb).Тетрамер Teton nimid-можно считать (OSNH).) Органический растворитель. Например, некоторые соли из пего также известны, например, бесцветное серебро-(Оснаг). 58) S»N » и взаимодействие жидкого аммиака дает красное твердое вещество с S2N3H3 composition. It соответствует структуре HN = S = N-S-NH. Когда он растворяется в жидком аммиаке, очень неустойчивая желтая соль KjNjS в KNHa? Но некоторые производные тяжелых металлов вызывают деградацию H3N3S.Из-за плохо растворимых соединений этих металлов и продуктов их разложения образуется осадок.
Например, известны красно-коричневый TI (NS) 3 и желтый HgNjS. Последняя соль производится из серы и не отделяется без примесей серы и S-XH2.День сульфидов-S (NH * h известен только в виде органических derivatives. An примером этого является (CHjhNSNfCHjh).Интересно, что в этом соединении| rf(NS)= 1,69 AJ координация атомов азота почти плоская. Обобщение азотно-серных связей характеризуется следующими данными: rf(N-S)1.68 A. энергия 50 ккал / моль, d (N = S)= 1.58 A. энергия 80 ккал / моль.
59)В дополнение к замене гидро-kenil, аммиак водород также может быть смешан с другими metaloid радикалов. Пример F5SNH2(Мп.43°с). Подобные производные серной кислоты изучены лучше других. Его диаметр образуется под действием газа NII3 на раствор SO2Cl2 в хлороформе, в частности. Реакция протекает по схеме: S02Cl2 + 4NH3 = 2N !!»Ди-Ф С02(nн 2) 2.Это соединение, сульфамид, представляет собой бесцветное кристаллическое вещество. пл. 92°с).
Легко растворяется в воде. А под действием щелочи аммиак частично удаляется и переносится в соль соответствующей имидсульфоновой кислоты. NH2SO: NH2 4-KOH = NH3 + NHaSOjOK. Для ионов [SOsNH*], d (SO)= 1.46 и rf (SN)= 1.67 A. Также известны некоторые соли селеновой кислоты (NH2Se020H). 60) свободные амиды сульфофорная (в противном случае кислота) кислота-Nhjojoii — это водорастворимое бесцветное кристаллическое вещество (mp 205cC decomp. it это не так. Хороший способ получить его-нагреть фторсульфат аммония с сильным раствором NH3.
Кислотные свойства сульфаминовой кислоты очень выражены(к = 1-10″’), и в целом соли с ее растворимостью в большинстве случаев сходны с соответствующими нитратами. Также были получены фторангид и Сульфаминовая кислота NHsSOgF(mp 8°С). ) 61) л!? Другие аммиачно-водородного замена продукции производится, таким образом, также известно: по их Oodisulfonium [ИИН(Бого!1) 7J и нитролитрисульфоноо (N (SOsOH) A) кислота.
Последние получают только в виде солей, которые образуются в результате реакций при взаимодействии нитритов с сульфитами. Например: KN02-Ф 4KHSO «= ы=, (SOjK) 3 + KsSOj4-2Н* 0 илн(так что » K) для АПЛ облигаций длина 2 кристалла, я нашел значение 1.66 А. Интересно, что не только я-гидроксильной группы, но и азота-привязка группы могут быть заменены с металлических на рассматриваемом соединении. Особенно.
Получен коричневый сульфаматный состав Агсойнаг? И многие сульфамидные соли, например SOj (NHAg) 2, известны. Это свойство особенно выражено в illusd дисульфамиде nN (S02HN2) 2.Его Индий водород диссоциирует почти так же сильно, как соляная кислота. Бесцветный HN (S02F) 2 (mp.170°C) и HN (S02CI) 2 (mp 37°C) также были получены. Некоторые соли известны для первого из этих веществ, и серебро-AgN (S02F) j-представляет интерес для them. It растворим в бензоле.
62) водород в аминогруппе кислый, а в аминохлортриоксиде («перхлориловый рудник») он является HjNCIOj. Сущность такова. I cioj и слабая дигидроксикислота (K1 = 3-10 / C2®1 10: 2), которая является 1 из продуктов взаимодействия аммиака, известна в виде некоторых солей. Как кислотные, так и умеренные соли бесцветны, стабильны в нормальных условиях (но могут быть оторваны нагреванием или ударом) и в основном растворимы. Они аналогичны по структуре перхлоратам и сульфатам соответственно.
63) бесцветный тионилимид-ОСНХ (Мп. Вы можете получить 85 (5C).Власть постоянно подключен 0 «= С Н С = Н! Близки друг к другу по своим молекулам (=8,7 и 8,3), d (SN) равен 1,51 А. известны также соли ртути-Hg (NSO)?И галогенид тиоимид-i’NSO(G CI. Br. 1). для хлорида были найдены следующие структурные параметры:.
Согласно полимеризации очень легко.Дает органическому растворителю нерастворимый коричневый полимер. С солями HOSN (например, NaOSN) отсутствует тенденция к полимеризации.Красная аммониевая соль (NH «OSN») постепенно теряет часть аммиака и образует желтый имидодисульфинимои-llN (SONi 13) g.
Оминосульфиновая кислота[NMjSOOH n NH (SOOH)]], в которой аммониевые соли образуются за счет взаимодействия диоксида серы с Nhj, связана с последним замещением аммиака сульфонатными радикалами (- SOOII).Взаимодействие аммиака и SOj приводит к образованию твердой смеси многих веществ (например, сульфаниламиновой кислоты), рассмотренных выше.
85) сульфидный Мономер (HNS02) не был получен, многие соли являются известными производными trnmer|(IINS) j). n-тетрамерная соль серебра[(AgNS02) » L. Scsmsmr сульфидов — (II \ SO.)Е получали взаимодействием S02 (N ‘ H2) 2 + HN (SOjCl)} «P» 150 * C в вакууме.
Некоторые из его солей также являются known.In случай Селена, только часть взрывчатой соли подобного Транмера — (HNSe02) J. Аммониевые соли (NH»KSOF») фторзамещенных сульфонамидов могут быть получены (наряду с NH»F») взаимодействием SOF с аммиаком.Когда эта соль нагреется, ни!F разрезается и образуется вязкий бесцветный полимер (S (F) (O)=> N-] *.Бесплатные HNS02F, которая представляет собой бесцветную жидкость, был синтезирован(МП 43 УК).
66) тиоилимид связан с оксонилсульфонатом серы и SjN’.O (красная жидкость с меньшей стабильностью) получается. SjNjO * (желтоватые кристаллы, mp 1P | * C) и SjN20 $(бесцветные летучие кристаллы).Их структура, вероятно, соответствует формуле OS (NS) S(NS02) и OS (NS02) 2.Для рассматриваемого 2-го соединения это было подтверждено прямым структурным определением.
Взаимодействие OSCI и жидкого аммиака (затем окисление раствора кислородом в атмосфере) ylmi привело к образованию светло-желтых кристаллов состава NH ^ S ^ O. 67) кроме производных кислорода известно много галогенидов и серы tr и do (главным образом фторхинолидов).Большинство из них. Как и в S4N3CI (дополнительно 37), галоген содержит Серные связи. Это включает в себя 8-кольцевую структуру SF (tf (SF)= 1.60, где N атомов и радикалов чередуются. D (XS)= 1,66 и 1 белые кристаллы (NSF) » (mp 153 ° C с разложением). 54A, ZSNS = 124°, ZNSN =112е, ZN-S — Ф =92е.^ Н = З-Ф = 106°!。
Сходные по структуре, но уже 6-членные кольца, тлоидоитриды(NSPjs. Они представляют собой бесцветные кристаллы(точка плавления 74.(Точка плавления: 93°С) желтый хлорид плавится при 163 ° С, а при нагревании красный бром разрушается. Это также включает желтый S (NSF)*(mp83eC).Бесцветный NSF (mp.- 89.КД.0°C)и бесцветный NSFj (bp. −73®с).Молекула последнего соединения Полярная (q = 1,91), представляющая собой искаженный тетраэдр с атомом серы вблизи центра(rf (NS)= 1,42.РФ (СФ)= 1.55 В, ZFSF = 94°).
Достаточно инертный-реагирует только с ка или С12 при нагревании и лишь медленно разлагается с водой(с образованием ИИФ и сульфаминовой кислоты).Эта молекула имеет следующие параметры: rf (NS)= * 1.45. РФ (СФ)= 1.64 А. ^ НФС = 117°, м 1.90.Нагрев в высоком вакууме (NSCI3), желто-зеленый газообразный NSCIfrf(NS)= 1,45,</(SC!) = Сгенерировано 2.16 A. At ZNSCI= 1/8°1, стало легко стать первым тримером.
Он известен для FaSNSFa (желтая нелетучая жидкость). Производные серы, содержащие фтор-азотные связи, при нормальных условиях бесцветны conditions. In в целом, стабильность относительно низка в газообразной форме. F $ SNFj (mp-110.Mp. — 16°C) было описано. Фсойнф «(Мп.- Плохо, депутат.-18°C), (FS02) 2NF (mp.- 80.Мп.61 УК), F2SNF(Мп.-81, Мп Кип-23°с), ОЯТ (Мп.-79, депутат.5°C)и S(НФ) «(Мп.108.Мп.(-7°С).Из них х параметров д (ЗП) −1.62, ТФ (НФ) −1.42 и ZSNF-122°.
Найдена угловая структура NF. Кроме того, Ф. в iSNFj, 77 *?Установлено, что ядерное расстояние фтора при его расположении до NF2, SF, короче остальных 4 (1.57 A) (1.52 A). в определенной степени, растягиваясь(соединяясь прямым соединением N и S, но не кислородом), FsSONF *(mp.-139, Мп.-10°C) и FOjSONFj (mp.- 129. Т. сигналы.-2°С).
Фторид FNSF2 является нормальным состоянием C1NSF2(b. k. 24 ° С)и BrNSF (b. p. 56SS), подобным жидкости. Для хлоридов известны молекулярные параметры: d (CIN)= 1.72. д(Н)= 1.18. d (SF)= 1.60 A. ZC1NS 120 120e, ZNSF = 86°. F5SNCI2 (Мп. Прием 80°C) также был reported. It следует отметить, что присутствие некоторых отдельных из вышеперечисленных соединений пока не очень надежно установлено.
68) интересные соединения сульфид сульфид «МИП — (NSOCI) Дж».Это бесцветное кристаллическое вещество было получено в двух типах, характеризующихся различной температурой плавления и дипольным моментом (в бензоле).Стабильная (а-или транс -) изом-па(т. е. 14°C, t = 3,9) имеет форму стула (rf (SN) −1,57, d (SO)= 1,40.d (SCl)= 2.00 A. ZSNS = 120°, ZNSN = 113°,^ OSCl = I07°J по-видимому, менее стабильные (fi — или цис -) изомеры (т. е., ill. At 48°с, μ-1,9), этот цикл не происходит в ванне-спонтанный переход fl * -твердое состояние, но происходит быстрее в полярных растворителях(таких как эфир). 69) раствор a-(nsocl) 3 CC1кали при 145°c, обработанный фторидом калия, образует 2 изомера (\’SOF) 3, приблизительно в том же количестве.
Но они мало чем отличаются от легкоплавких и летучих (Мп.17, вып. Знак.138 Об. П.3, вып. ВР.130СС). Гидролиз SF-связей происходит очень медленно (кипячение воды;: 7% за 50 часов). 70) для молекулы ncl3 характерны следующие параметры: d (NCI)= 1.76 A. ZCINCI = 107°, k = 2.7.Пар этого вещества(Мп.27.Т. Кий.71°с) Укрытие.- » IX-15. А-Пхо структуры; мы являемся хлора. Он сильно влияет на резкий запах и слизистые оболочки.
Раствор в некоторых органических растворителях при отсутствии света не меняется довольно долго time. In вода, NCI3 почти неразрешима и медленно разлагает в NH и HOC1.Пиролиз хлорированного азота протекает по формуле: 2NCI3 = N * — f-3Cl2 + h-110 ккал. 71) аналогичные производные NCI3BROMIDE образуются в результате взаимодействия раствора аммиака с избытком брома (наилучшие условия-Br2:Nils = 2,5 и pH = 4,5).
Воздействие паров брома на избыток аммиака при пониженном давлении и последующее охлаждение продуктов реакции до −75°с позволяет получать темно-красные вещества в составе NBr3-6NH3.Взрываются и разлагаются уже при −70°C 72) под действием йода на сильный раствор NHj выделяется темно-коричневый осадок так называемого иодида азота.
Это фактически соединение Nlj, содержащее переменное количество аммиака (или продукт неполной замены водорода йодом).Медно-красные игольчатые кристаллы состава Nlj-Gh’NZ были выделены в отдельных состояниях. При нагревании до более чем 26°C, он взорвется азот и соотношение атомов йода 1-.Вещества, содержащиеся в 3, явно получены действием газообразных NHj и двойных соединений KBrlBr по следующей формуле: 3 (KBr-iBr) — f 4NH * — * =ЗКВг + 3nh » br-f NLJ. После промывки продуктов реакции водой остается черный осадок Nlj.
Йодный азот очень нестабилен, и когда он высыхает, он взрывается при малейшем прикосновении. 73) в отличие от других галогенидных производных, фторированный азот (NF3) является экзотермическим соединением(производящим тепло 30 ккал / моль) и невзрывоопасен. Oi может быть получен электролизом расплавленного гидрофторкарбоната аммония (NH4HF2), а также образуется при взаимодействии аммиака и фтора:4NHj + 3F? = 3NH | Ф + КF3 ’.
Однако если реакционную смесь не сильно разбавить азотом, то эта реакция протекает очень интенсивно, поэтому большая часть исходного продукта разлагается на HF. 74)Н-Ф3 молекулы пирамидальная(РФ (НФ) −1.37, Ар(П)= 4.5.ZFNF = 102°). V n, который характеризуется потенциалом Нойисанина 13.2, является слегка полярным (q = 0.23). это связано с его низкой полярностью.
Очевидно, противоположное направление диполей 3 F * — N и N * 2 относительно пары свободных электронов атома азота (рис. IX-16). При интерпретации полярности молекулы NH3 необходимо отметить аналогичное описание последнего диполя, которое часто used. Illegal. In в отличие от обладающего большим количеством свободных электронов и действующего на электронную оболочку N атомов из внешнего атома фтора,
Протон находится внутри этой оболочки. Результатом является, по-видимому, сохранение сферической электронной симметрии молекулами NH3 (ионами N3 «) и образование дипольных моментов только за счет полярности связей HN. Значение электрического сродства (111§ 5, дополнительный 13) и рассчитанное с использованием структурных данных значение с фактически совпадают с экспериментальными значениями, и то же самое относится к молекуле HjO (111§ 6, дополнительный 4) и Галогениду водорода (VII 4). 75) фторид азота представляет собой бесцветный газ (Мп.- 206.Мп.-129 СС).
Ионы очень стабилизированы оперируя понятиями топления и различного химиката influences. In в частности, в нормальных условиях NF3 реагирует с сухим стеклом. Ртуть, вода и даже коп. Но это так poisonous. In вода, NF3 почти нерастворима. Взаимодействие с водяным паром начинается только под действием электрической искры и идет медленно по схеме: 2NF3-fЗНгО-6hf-ьn203.Реакция с водородом при тех же условиях сопровождается взрывом, а продукты СЕ состоят из HF и
76) при взаимодействии F3 с F *и SbF3 или AsF3 (под давлением −78°С или с тихим разрядом) были получены фторсодержащие аналоги солей аммония-(NF]] SbF6 и (NFJAsFe).Приблизительно 300°C, 2-й глаз-это радужная оболочка 270°C. 2NF „3F6 +14Н“ 0 = 2NF, — f Ch +2НЭ (он)» — по схеме F nhf он плавно взаимодействует с водой. Т. Н»») Семнадцать Рио IX 16. схема ФО:> — малронин дипольного момента N ’ F3. NF * катионный представляет собой тетраэдр с атомом азота в центре.
Частичное формирование на основе схемы НФ+ Ф? NF *HF * + HFJ возникает четко, когда NFj и lJ растворяются в жидком IIF. 77) известны также смешанные галогениды NF: C1 (mp.-190.Mp.-66°C) и NFCI *(mp.- 2°с).Для первого из них задается параметр TF (NF) — > 1.38. d (N’clj) 1.73 A. ^ FNF «103°,^ FNCI» 105°.Энергия связи NCI оценивается в 35 ккал / моль.
78) с точки зрения стабильности и реакционной способности, соотношение NFj и NCIj! 0 и CBO: объем. Также производные хлорида взрывоопасны, но фторид стабилен и химически сильно инертен. Энергия связи различных галогенов и азота оценивается по следующим средним значениям: 65 (N-P), −16 C|), 43(N-Br) nZb(N-I) ккал / моль.
Приведены значения последовательной энергии диссоциации связи NFj (ккал / моль). 55 (НФ2-Ф). 80(NF-F), 55 (N-F). 79) из продуктов неполного замещения галогенидов аммиачным водородом относительно хорошо изучены только хлорамины(NHjCl).Представляет собой бесцветную маслянистую жидкость с резким запахом(Мп.- G0°C).Количество аммиака, рассчитанное из расчета, получается действием NaOCl.
После этого жидкость перегоняют в вакууме и дистиллят обрабатывают безводным K2 CO2 (в сочетании с водой). NHjCl также может быть получен реакцией 2NHa + Cla NH C CI-f NHjCl, если исходный газ достаточно разбавлен азотом. По структуре молекулы хлорамин напоминает аммиак(рис. IX-3).
1 водорода заменяется хлором frf (NCl)= 1.75 A. ZCINH= 104e. ^ HNH 99°J. It очень хорошо растворим в воде, но склонность к прилипанию и основные свойства, связанные с ней, выражены очень слабо(к = 1-10〜!4).Его кислотные свойства слабо выражены. В растворе NHjCI он подвергается гидролизу по схеме M12C1-fH20NH NHj 4-POS1.
Это объясняет его характерные окислительные свойства. При хранении водных растворов различные вторичные реакции вызывают постепенное разложение хлорамина. Некоторые из его органических производных используются в медицине для стерилизации и деаэрации воды (уничтожения токсичных веществ).
80) хлорамин также получают действием хлора на сильный раствор NTH 8,5 получают хлорамин, но в диапазоне рН 4,5 ч-5 продуктом реакции является хлорпромин (NHClj), который не выделяют в индивидуальных условиях. Последние имеют кислую природу и могут существовать только в области pI = 5 h-8. 81) известно также, что фторимин-NHF2 разлагается при взрыве (mp. −116. Mp.-23 ° C).Его молекула полярна (q = 1,93), что характеризуется следующим параметром: d(NF)= 1,40. < / (НХ)= 1.03 А. ^ сят = 103°. Для постоянной силы сцепления ^ HNF = 100°приведены значения fc(NH)= 5.6 и/ r(NF)= 4.1.Есть обзорная статья о химии фтора. • 82) связь N-O молекулы \ \ PHON характеризуется длиной 1,48 А. постоянная силы k = 4,4 и энергия диссоциации 63 ккал / моль(но по другим данным 48 ккал / моль).
При пониженном давлении гидроксихирамин(Мп.33°C) может быть перегоняется без разложения(МП на 22 мм рт.58°с).С другой стороны, он разлагается при нагревании выше 100°C (часто со взрывом).В нормальных условиях он постепенно разлагается. Расплавленный NH2OH является подходящим растворителем для некоторых salts.
In вода, она образует гидраты и дрокиламиноамины (Мигон-НПО), характеризующиеся слабо выраженными основными свойствами(к-2-10 и). ее можно использовать в качестве реактивного топлива в сочетании с дымовым соединением HNOj. При использовании кислот гидроксиламин будет производить соль. Из этих солей легко растворимый хлорид-NHjOH-HCl (mp 151CC)-является обычным безрецептурным, плохо растворимым фосфатом. * Фоки и А. В.. Косой Ре в к). М..
Достижения в области химии. i9t> 6. II. / S07、 король (3NH?0H * HsPO?) Может быть получен безводный NH2OH (при нагревании под пониженным давлением)с использованием. Основой образования соединений является присоединение протонов к атому азота гидроксиламина. Для диссоциации полученного гидроксиламмониевого Иона по схеме «HNHjOH * * Н» + NHjOH приведено значение K-L0.4, то есть он гораздо более кислый, чем Ион аммония(добавлено 34).
Интересно, что связь no кристаллов NH2OHHCl значительно короче, чем свободный гидроксиламин (1,38 а), и также описан нестабильный продукт замещения гидроксильного водорода в некоторых металлах (Na, Ca). Разбавленный водный раствор солей гидроксиламина достаточно стабилен, но сильные (особенно в присутствии щелочей) быстро разлагаются и образуют NHj. Ндж и Нджо.
Этот распад значительно ускоряется в присутствии подвижной платины. Окислители, как правило, конвертировать indoxylamia в Н20. В N2, например, по следующей реакции: 6NH2OH + 4HNO, 3N20 + 4NO + 11I20 или 2NH2OH + HOCl = N2 + 1101 + 311.0 В случае гидроксиламина функция окисления также очень характерна. Например. Fe (OH) 2 можно окислить до Fe (OH) 3. Например, от H2S03 до H2soa.
Эта окислительная функция становится более выраженной в кислых средах, но наиболее характерным восстановлением гидроксиламина является щелочность. Когда свойства среды изменяются, поведение гидроксиламина может полностью измениться. Например, в среде уксусной кислоты она уменьшается от 12 до HI. In сильная соляная кислота-она окисляет Hi до 12.
83) гидроксиламин водород (и аммиак) может быть частично или полностью замещен сульфонатными радикалами (- S020H). в результате образуются различные гидроксиламинсульфоновые кислоты, которые в основном известны только в виде солей. Получена производная, соответствующая всем 5 возможным вариантам (буква R обозначает радикал-S020H). R4 R4 LF R \ R \ > Н-О > Н-О / Н-или N-или> Н-0г \ в ГХ \ в \ в Ф?
Примером может служить бесцветный гидроксиламина сульфонат-Хон(S03Kh. Когда гидроксил образуется, он постепенно плавится в растворе. Миосульфонаты (UONHSOjK) и бисульфат калия. 84) если гидразин получен по общей схеме, описанной в тексте, то хороший выход гидразина может быть достигнут только в присутствии некоторых органических веществ.
Обычно в реакционную смесь добавляют 0,2% желатина. Сама реакция, по-видимому, протекает в 2 стадии по формуле KH3 + NaOCI = NaOH + NH2Cl1 (быстрая реакция) и NH2Cl + + MIE + NaOH = H2O + NaCl + N2H4 (медленная реакция), причем роль желатина, вероятно, 2nh2c в предотвращении вредных побочных эффектов! + N2H4 = N2 + 2NH » CI. Такой процесс подтверждается, в частности, возможностью получения гидрохлорида гидразина за счет прямого взаимодействия хлорамина и аммиака.
NHrC1 + NH3 = N2H » HCL. Гидразин также частично образуется при освещении аммиачной струны лучами ртутно-кварцевой лампы. 85) молекула гидразина Полразия (q = 1,83).Его трехмерная структура (то есть взаимное пространственное расположение атомов) является наиболее энергетически выгодной в структуре, показанной на рисунке 1. IX-17.N-N связи гидразина характеризуются длиной d(NN)= 1,45 а, постоянной силы k = 2,5 и энергией диссоциации 48 ккал / моль (60 ккал / моль, согласно другим источникам).
Угол NNH равен 112e, d (NH) s = 1,02 A. углы поворота обеих групп NHj относительно близки и I составляет около 90°. Барьер свободного вращения связи NN составляет 2,8 ккал / моль. Потенциал ионизации (9,6 o) молекул гидразина несколько ниже, чем потенциал ионизации аммиака. Интересно, что в свободном радикале NH2, значительно выше(11,2 и). Для энергии диссоциации связи n2h3-I приведено значение 78 ккал / моль. Рисунок 1X17.Конформация молекулы гидразина.
86) свободный гидразин (Мп.2. mp.113°C) может объединять молекулы воды для получения гидразингидрата-NjH• * H20.Последний представляет собой бесцветную жидкость (mp. 52. Mp. 119°C) и является слабым основанием (/Ci = 1-106). Добавление второй молекулы воды уже затруднено, и соответствующая константа диссоциации очень мала (L’2 = 9-10’*).связывая молекулу кислоты, гидразин может образовывать 2 ряда солей, например NgH ^ HCl и N2H4-2HCl. Обычно выделяется малорастворимый сульфат\ 2H4-H2S04 (mp 254°С с De comp).
87) гидразин-ионы последних 2 солей имеют трансовое расположение С d (NN)= 1.43 A. его электролитическая диссоциация(схема N2HJ * < * N’, HJ + H#И NT2Hj ZT * N; H4-f Nf) характеризуется значениями K \ = * — I * 10-1 и K * 1 −10 * \ т. гидразин-ионы более кислые, чем ионы аммония (34 добавлено).
88) в отличие от аммиака, гидразин является эндотермическим соединением (тепло, выделяемое элементом, составляет 23 ккал / моль).Его пары могут гореть фиолетовым пламенем, в зависимости от реакции: N2I 1 < + 02 = 2H20 + N2 + 139 ккал. На этом основано использование гидразина в качестве реактивного топлива.
Этот особый импульс в сочетании с кислородом достигает 270.In Озон-до 280.In фтор-до 300 секунд(то есть гидразин несколько эффективнее аммиака).Метилзамещенный гидразин еще больше effective. So [(CHi)] NHI может дать определенный импульс с кислородом 310 csk.
89) жидкий гидразин характеризуется высокой диэлектрической проницаемостью (у При 20 ° С= 53) и является хорошим ионизирующим растворителем для многих солей. Его собственная электролитическая диссоциация невелика: [N’jh*] [N. H-Js * = 2-10 г \гидразин взаимодействует с металлическим натрием по схеме: 2Na4 — 2N2H4- = * 2NaN2Mj-f P2.Полученный гидразид натрия представляет собой очень взрывоопасное желтое твердое вещество и легко растворяется в избытке гидразина.
90) в водном растворе гидразин восстанавливает йод до йодистого водорода, соли серебра и ртути-до металлов, соли меди-до закиси азота, etc. It сам окисляется до свободного азота, но основной процесс обычно осложняется побочными реакциями. Гидразин до \ 2 может окисляться только при строго определенных условиях (например, pll = 7×7,2 йода).Интересно, что CrCl2-2NT: дихлорид хрома с составом H4 (VIII§ 5 add.66) и практически нерастворимые в воде двойные соединения обладают высокой устойчивостью к окислителям, хотя оба компонента являются восстановителями.
Гидразин практически не имеет окислительной функции. Очень мощное гелеобразование (водород в момент evolution. By действие «Sn* \ Ti»’), его можно свести к ammonia. In в виде разбавленного водного раствора гидразин является антикоррозионной добавкой, подходящей для воды.
Паровые котлы (для удаления растворенного кислорода и в то же время провоцирования слабощелочной реакции) гидразин и его производные токсичны. К ним прилагаются специальные монографии. 91) продуктом частичного или полного замещения атомов водорода в молекулах гидразина и сульфонатных радикалах являются различные гидразинсульфоновые кислоты, такие как гидроксиламин (добавлено 83).
Примеры включают гидрадитат калия (KSOjhN-NtSOjKh. Раствор этой соли нейтрален и не осаждается в BaCl2.Гидразин дисульфин-(HOOS) HN-NH (SOOH) образуется при взаимодействии гидразина и диоксида серы. 92) в соответствии со схемой 4 \ p3-j взаимодействие NF3 при нагревании с углем (в псевдоожиженном слое). c =: получен фторсодержащий аналог CF4 + 2N2F4, N’2H4-Тетрагидразин (N * F»).
Его молекула характеризуется параметром D (SN)= 1,40. РФ (НФ) 1.37 А. ZFNF = 103°. Последние’Ф = 101°и maropolaria (Р = 0.26).Пот. * 1 пит Тл. О Г».Химическое вещество hydrazine. In английский. Я м. Варшавская м. от dltnlpt. 1(13-1.237 С. Диапазон ионизации составляет 12,0 В, а энергия связи N-N составляет 20 ккал / моль(поэтому эта связь намного слабее, чем у гидразина).
В нормальных условиях тетрафторгидразин представляет собой газ (Мп.- 162.Mp.-73°C).однако его критическая температура относительно высока (4-36°C). как в газообразном, так и в жидком состоянии он частично диссоциирует на свободные радикалы по схеме: N2F » 2NF2 (при 25°C степень диссоциации составляет 0,02%.Радикальные НФ2 | РФ (НФ)= 1.36 А. ZFNF находится в 103 гр. в. д).
Присутствие «пустых» электронов обладает относительно высокой стабильностью, и тетрафторэфиргидразин был предложен в качестве окислителя для реактивного топлива. 93)для успешного завершения реакции образования НГХЗ, описанной в тексте, достаточно кислой средой является necessary. It удобнее получать азотную кислоту и ее соли на основе азида натрия, который образуется в результате реакции, протекающей при 190°С по схеме: N’axmi 4-N30 =Н20-f NaN. *
94) молекулы HN3 являются полярными a (q = 0,83) и характеризуются следующими структурными параметрами: rf (hn) −0,98. д(Н, Н2)= 1.24. rf (N, N.)= I, I3A. ZHNN = 115e. N ^ионы имеют линейную структуру с 2 равными расстояниями d (NN)= 1.17 L Властные отношения по отношению к-13.7.Его структуру можно представить в следующем виде: — ± Лоя |: Н = Н = Н: Дж 6.v (экстремальное значение)= = −0.53 и 6.v (среднее значение)= 4-0.06.
Сродство радикалов к электронам оценивается в 81 ккал / моль. 95) функция кислоты HN3 (mp.- 80.ВР.4-37°с) характеризуется значением/ с-2-10″.N.\ 3 Когда пар нагревается выше 300°C, он разлагается с сильным взрывом. Главным образом реакцией: 2Н\ ’ 3-Н2-f 3N2 4-141 kcal. In Безводное состояние, азотная кислота не только взрывается при нагревании, но также может взорваться, если вы просто встряхнете container.
As реакция его разложения (однако формула HNs4-Н2О= N2 4-NH5OH) очень медленная. пар HN3 очень токсичен, а его водный раствор вызывает воспаление. Кожа. В дополнение к кислотной функции, iin3 также характеризуется окислением. Взаимодействие с HI сопровождается выделением 12 и образованием продуктов восстановления азотной кислоты (N2 и NH3). N. \ 3 и смесь сильных HO растворяет золото и платину, когда heated. It работает аналогично царской водке.
Когда HN3 воздействует на металл, он вызывает не только соответствующее соединение, но и его образование. Перо N2 h также включено, но свободный водород нет released. In все эти реакции, азотная кислота подобна азотной кислоте. Основной причиной такого сходства, по-видимому, является наличие Пятикнижного азота в молекулах обоих соединений. Функция уменьшения HM характерна, но она все еще взаимодействует с некоторым сильным oxidants.
In в частности, азотистая кислота быстро окисляет HN *по формуле HM02 4-UN’s-N2 4-4-20.Эта реакция может быть использована для количественного анализа азида. Соль HN3 обычно бесцветна. Производные некоторых наиболее активных металлов могут растворяться без разложения, разложение на металлы и азот происходит только при слабом сильном нагревании.
Например. К. \ 3 плавится при 343 ° С и разлагается при 355 ° С. Азид свинца (PR =2-10®) взрывается от удара при температуре 327 ° C. 96) в дополнение к соли, водород-замещенных продуктов HN3 paraharide известны. Фторазид (FN’3) образуется при взаимодействии Р \ 3 и 1: 2 в потоке азота по формуле 4HNj-f2Fj-NH»F4-N24-3FNj. It является зеленым газом(т. илл.-152, Т. Сигналы.- 82 УК).Медленно распадаются по схеме: 2FN3 = 2N2 4-N2F2 97) N2F2-соединение ойлофлоиадина-образуется как один из продуктов при действии фтора на электролиз фтористого водорода (add 73) или иатриадина динда (1).
Более прямым методом является фторид калия с фтороимином (дополнительный 81 уравнение:2KF-f 2HNF2-2KHF2-f N2F2.Бесцветный газ, который поступает с почти 100%выходом (запахи похожи на N (2)), нестабилен, и при нормальных условиях он медленно разлагается уже из Nj и F2.Тем не менее, он » и разделен на 2 фракции, образованные ЦИС или гранью молекулы F — N = N-F(см. Рисунок 1V-27).
Несколько стабильная форма СМЕ (теплота, выделяемая из элемента, составляет −16 ккал / моль, Мп-195м или менее. МП-106°С)имеет полярность(μ-0,16) и характеризуется параметром TF(NN)»=». 1.21.Rf (NF) » 1.38 (по другим источникам-1.41) A.£NNF = 114 e. для формы g / me(тепло, выделяемое из элементов— 19 ккал / моль, mp 172 bp-111°C) эти параметры несколько отличаются: rf (NN)= 1.23.д (НФ)= 1.40 А. ZNNF ■ 106″. Энергия связи NF оценивается в 68 ккал / моль. Есть обзорная статья о фторидных производных азота. *
98) х л оразид (CIN3), согласно схеме, получают взаимодействием азотной и хлорноватой кислот: UN + IM » * * 20-F CIN3.In в кислой среде реакция протекает в щелочной среде слева направо-олененок с правой стороны. Хлораз-это бесцветный газ в нормальных условиях (Мп.-100.Т. ВР.-15 * С).Соответствующее производное бромида представляет собой красную жидкость(т.-45®).Желтоватые кристаллы иолазила I2-Ag1?3 = Agl-IN3, возникающий в результате взаимодействия между AGI и йодом.
Все галогениды очень взрывоопасны. С водой они постепенно разлагаются гидролитически. Thioirajide(так (Н3) 2), серы fS02 (Н3) 3], fluorosulfuryl азид[я С02 \ 3]известно. Дисульфид[S204 (N3)2]и миражид хрома (Cr02(N3) 2].Из продуктов, подобных сульфату гальпепа, получают неизвестный Кант в свободном состоянии аэросульфоновой кислоты (N 3S03H). — КС03Н3.
99) взаимодействие ON’3 (когда хлор положительно поляризован) и некоторых хлоридов металлов (когда хлор отрицательно поляризован) приводит к смешанным азидным хлоридам. Например, по схеме:\ VCI » 4-ClN3-Cl2 + WCljty3.Разложение этого азондо-хлорида при нагревании осуществляется по формуле CIsWNa = N2 + CljWN + CI 100) среди продуктов разложения HNj под действием разряда обнаружены диимиды (Н— N = N —Н), возможно образованные по следующей схеме: HN3 — * N2 + NH3 + NH + N2 + N2 + N2.Это вещество не изолировано, но оно смогло блокировать часть своей энергии properties.
In в частности, энергия связи N = N составляет 104 ккал / моль, а энергия диссоциации радикалов NH-92 ккал / моль. Для гораздо более стабильного SI» —N — N — CH3 было найдено rf (NN)= 1.25. д (НЗ)= 1.48 А. З СNN » = номер. 101) полиамид-(NH)*, аналогичный по составу N * 2H2, при охлаждении жидким азотом осаждается продукт пиролиза HN3 при температуре около 1000°С (по схеме: HN3- * N2 + NH).Это голубое вещество, нерастворимое в жидком азоте, уже превращается в NH N3 при ~ 125%.
Смотрите также:
| Подгруппа селена | Комплексообразование |
| Подгруппа хрома | Кислородные соединения азота |

