Оглавление:

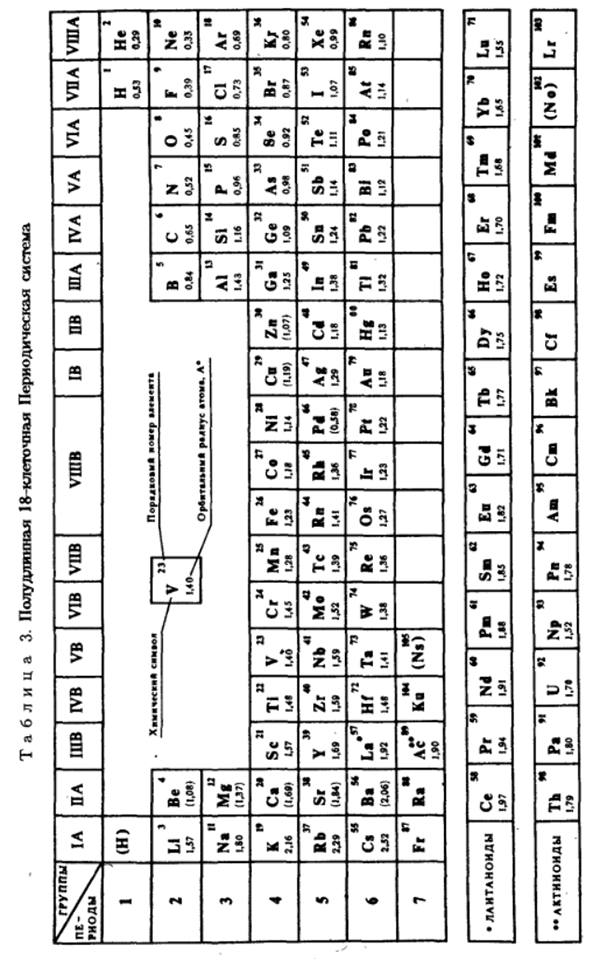
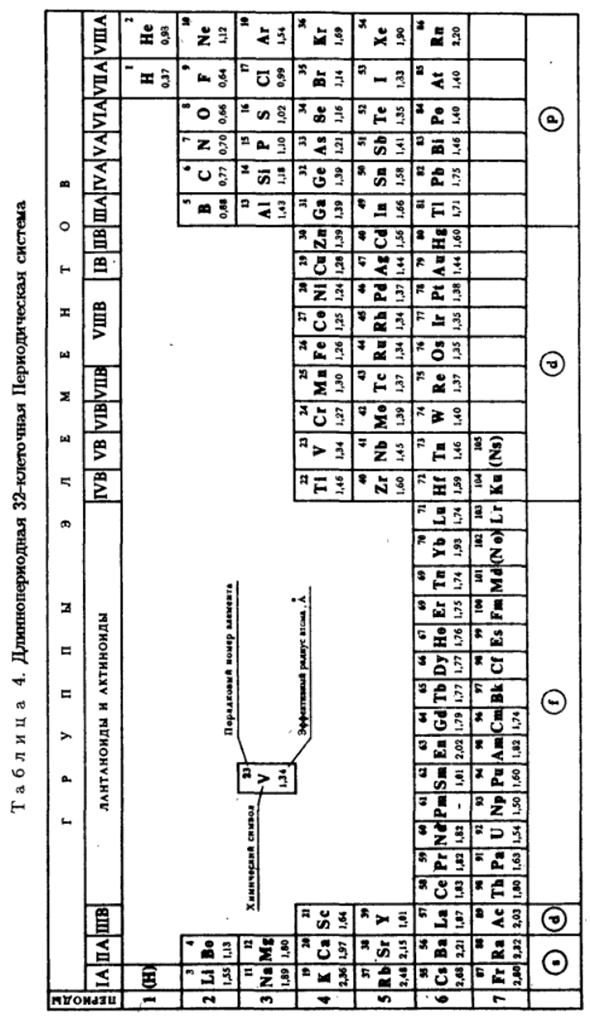







Строение электронной оболочки и свойства элементов
- Структура электронной оболочки и свойства элементов. Электронная структура Оболочка атома химического элемента периодически изменяется с его ростом Серийный номер изделия. Потому что свойство-это функция структуры Оболочка, они должны полагаться на регулярную зарядку Да, ядро атома.
- А на самом деле, из-за самых разнообразных свойств эле Для полицейского эта зависимость представлена периодической кривой: Серия взлетов и падений. Даже такой, казалось бы, непериодический Характеристики, как удельная теплоемкость вещества, частота рентгеновского Тщательный анализ спектра элементов и др., регулярно Чески. Давайте подумаем о самом простом Важны циклические свойства элемента.
Это объясняется тем, что периодичность присуща всем электронным устройствам Это оболочка атома, а не только его внешний слой. Людмила Фирмаль
Сродство с потенциалом атомной ионизации К электронным.1. одно из важнейших свойств химического элемента、 Непосредственно связано со структурой электронной оболочки Потенциал ионизации. Последняя представляет собой необходимую энергию Отделяет самые слабые электроны связи от обычных атомов Государство. Это первичный потенциал ионизации、 Процесс е = е + + е〜.Энергия ионизации может быть выражена в любой единице измерения、 Энергетические измерения-это, например, килоджоули, но они чаще выражаются Электронный Bolt.
In в случае многоэлектронных атомов, как правило, очень много Энергия ионизациичисло электронов в атоме. Из химических атомов Потенциал ионизации, представленный Болтом, численно равен значению энергии Ионизация в электронных вольтах для работы электронной десорбции под действием электронов Поле — это а-КУ-Эл. Где E-заряд электрона. / — Потенциал ионизации Испытание. Значение 7i, 12, 1$…Электрон, идентифицирующий деление 1-го, 2-го и т. Они называются потенциалами ионизации, такими как 1-й и 2-й соответственно. Заказ- Бухточка.
Элемент может извлекать все электроны непрерывно, и сообщает дискретное Значение потенциала/ Б / 2,/ 3 и т. д. Пять Различные потенциалы ионизации первого элемента 2 периода цикла системы. При сравнении значений ионизации Потенциал разных порядков атомов одного и того же элемента притягивает Внимание уделяется сравнительно легкое разделение электронов в наружном слое. Так… Для атомов лития удаление одного электрона во внешнем слое 2s1(/ 1 = 5.39 в)
Это происходит легче, чем 2 электрона во внутреннем слое (/2 = 75.62 И 7c = 122,4 в), то есть/ x <12 < / 3-азот для отделения первых 5 электронов Для 2-го слоя сердечника (n = 2) все, что вам нужно, это несколько десятков электронных вольт, и удаление 2 электрона во внутреннем слое главного квантового числа N = 1 Сотни электронных вольт связаны с потреблением энергии. О 2-м элементе Продолжительность таблицы. Показаны 5 границ быстрого увеличения энергии ионизации Жирная линия.
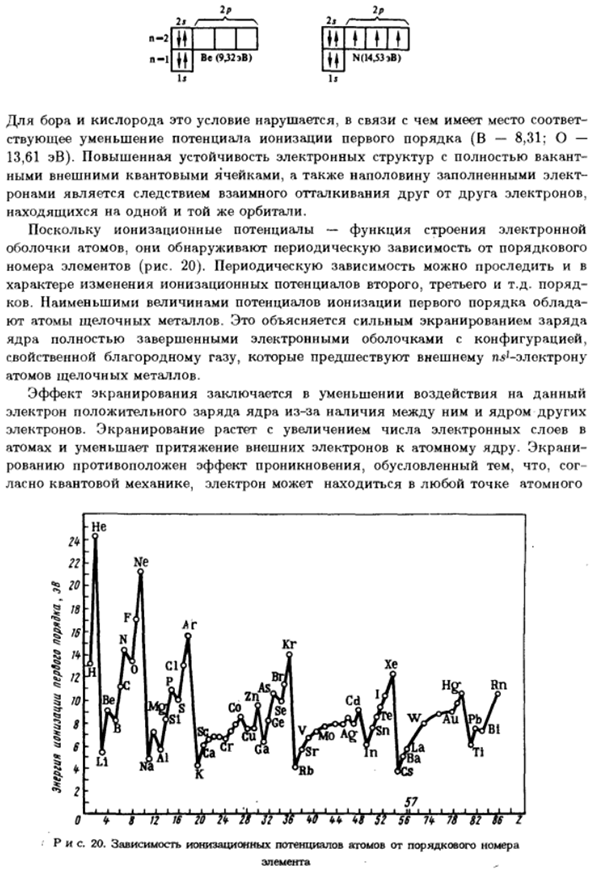
Следовательно, энергия ионизации отражает дискретность Структура электронного слоя и оболочки атомов химического элемента. Таблица данных. 5 могут быть связаны более тонкие изменения энергии ионизации Он обладает свойством наполнять электронную оболочку. Об элементах второго периода При переходе от лития до неона, увеличение ионизирующей энергии наблюдается. Это Это объясняется увеличением заряда ядра, когда число электронных слоев постоянно.
В то же время внутри происходит увеличение энергии первичной ионизации периоды ri являются non-monotonic. So например, с бором и кислородом, выраженное Уменьшение на 1 \по сравнению с предыдущим элементом-бериллием и Азот. Аналогичное нарушение монотонности при смене фигур Первый потенциал ионизации также является особенностью других периодов системы. Это потому, что атом есть Внешняя электронная орбиталь, или электрона вообще нет(нет Lillium), lib наполовину заполнен (азот): *
Внешняя орбиталь всех описанных атомов (Be, N, B, O) равна 2p. В случае бора и кислорода, из-за нарушения этого условия, соответствующие Соответствующее снижение потенциала первичной ионизации (B-8.31; O- 13.61 эВ).Улучшена стабильность электронных структур в полностью свободном состоянии Внешние квантовые ячейки и наполовину заполненные электроны Рон-это результат отталкивания электронов друг от друга. Он находится на той же орбите.
Потому что потенциал ионизации является функцией структуры электрона Оболочки атомов, они показывают периодическую зависимость от порядка Номер элемента (Рисунок 20).Вы можете отслеживать повторяющиеся зависимости Характер изменения потенциала ионизации, например 2-го или 3-го порядка- Бухточка. Минимальное значение первичного потенциала ионизации равно Атомы щелочных металлов. Это связано с сильным экранированием заряда.
Сердечник с полностью законченной электронной оболочкой конфигурации Характеристики благородных газов, предшествующих внешнему n*] — электрону Атомы щелочных металлов. Эффект щита является специфическим Электрон положительного заряда ядра для присутствия между ядром и другими ядрами Электронный. Экранирование увеличивается с увеличением количества электронных слоев Уменьшает притяжение внешних электронов к ядру. Экран Проникновение противоположно проникновению и、 В квантовой механике электроны могут быть размещены в любом месте атома Космос.
Поэтому во внутренней области Вероятность нахождения атома вблизи атомного ядра Даже внешние электроны достигают финала Количество. Радиальное распределение плотности 3 ″ вероятность электронов натрия Внутри этого электронного проникновения в к- I слой атома (рис. 21).Эффект проникновения Увеличивает прочность связи электронов и ядер. Эффекты экранирования и проникновения Но с одной точки зрения D формально они являются способом учета P и s. 21.Радиальное распределение взаимного влияния электронов.
Если нет Вероятность нахождения других электронов в соответствии с уравнением ^Атомы натрия электронов (III. 27), энергия рассматриваемого электрона Она зависит только от заряда ядра Z и основного квантового числа n. Когда вы превращаете электрон в данный электрон, Z и n уменьшаются. Е =т. е. А11. Тридцать шесть) Где ff-эффективный заряд ядра. PSFF-эффективный первичный Квант Number. In в этом случае щит приводит к эффекту EFF 20 (Z-9), и Атомы натрия? eff = 2.2 при Z = 11.In стол. Показано влияние величины 6 Низкие s -, p -, (I-и/ / czrbitals щелочных металлов и металлов подгруппы меди.
Главное квантовое число, N, в скобках.、 Соответствующие эффекты, с учетом эффекта проникновения, нумеруются. Таблица 6.Ядфф значение некоторых металлов Из таблицы данных. 6 показывает максимальный эффект проникновения s-электроны, меньшие-p-электроны и еще меньшие-d-и/или-электроны. Последний. (Точнее, 4 / электрон) практически не характеризуется проникающим действием The phenomenon. In кроме того, эффект проникновения характерен для тяжелых атомов.
- Существует большое количество электронов во внутреннем слое, проходящих через него Внешний электрон. Наконец, проникновение внешних электронов и Р-электронов внутрь Атомы выражены очень сильно по отношению к радиочастотным элементам периодической системы. Однако с увеличением количества электронных слоев расстояние значительно увеличивается. Внешние электроны от ядра уменьшают энергию ионизации. Например、 Щелочные металлы играют доминирующую роль по сравнению с увеличением Эффект проникновения.
Поэтому, для алкалиа, сверху донизу Для металлов наблюдается незначительное снижение(за счет поступления внешнего электричества Rona) первичная энергия ионизации. Вставка в несколько десятилетий, ионизация Потенциал изменяется относительно незначительно при переходе от 1 электричества. Еще один полицейский. (/- Элементы, среди относительно большой энергии Ионизация металла характеризуется следующим lanthanides.
Для заметного эффекта S проникновение электронов в металл энергия ионизации вставленных десятилетий Выше, чем в основной подгруппе металлов. Людмила Фирмаль
It объясняется Это проникновение be-электронов под двойной «экран» 5rf и 4 / electron. Сродство к электронам также периодически меняется. Под последним надо понимать Энергия, которая высвобождается, когда электрон связан с нейтральным атомом mu, то есть энергия процесса E + e «= E».Наибольшее сродство к электричеству Группа VII характеризуется Р-элементами. Минимум (и даже отрицательный) Сродство к электронам-это атом с расположением внешних электронов. ns2 и благородные газы.
Ниже приводится значение электронного сродства. Отдельные элементы: Сродство электронов далеко не определено для всех элементов. Но… Квантово-механические расчеты типичного неметалла имеют сродство Атомы до 2 и более электронов всегда negative. So электронный Вторичное сродство атома кислорода составляет −7,6, в то время как вторичное сродство атома серы составляет −3,5 эВ. Таким образом, многозарядные одноатомные отрицательные ионы типа O2 и типа S2、 N3 ″ — это свободное состояние, молекула или Страз.
Кроме того, наличие твердых электролитов и ионных проводников Это является доказательством существования в них независимых ионов. Под влиянием Под действием приложенного электрического поля происходит дополнительная поляризация В твердом состоянии образующиеся ионы Наблюдается ионная проводимость. Вода, соль, кислота и Основания под действием электричества (без готовых ионов) Электролитическая диссоциация протекает в области полярных молекул воды Электролиты растворяются с образованием гидратированных ионов.
Радиус действия atom. In термины квантовой механики, изоляция Атомы не имеют строго определенного размера, потому что электронная плотность Теоретически он исчезает только на бесконечном расстоянии The kernel. At в то же время, электронное облако уже очень сильно рассеивается на следующем расстоянии В нескольких десятках нанометров от ядра. Поэтому для определения абсолютной величины Атомы невозможны. Сначала у нас было представление об эффективном радиусе атома、
В своих действиях, а именно соединениях. Эффективный Радиусопределяется по экспериментальным данным о межъядерном расстоянии Ниям молекул и crystals. It предполагалось, что атомы представлены Это несжимаемый шар, который касается поверхности Соединение. При определении эффективного значения радиуса между ядрами Расстояние общей молекулы означает общий радиус、
Рассчитайте их по данным кристаллов металла-Металл DiUS наконец, эффективный радиус, рассчитанный для Кристалла По существу, ионная связь была названа ионной radius. To сделайте это, вы решаете Вы рассчитали ионный радиус и ионный радиус других элементов КС по экспериментальным данным о межъядерных расстояниях в кристаллах Листья lattice.
So, используя оптический метод, расчет является Определяли радиус аниона фтора, равный 0,113 Нм. И расстояние между атомами Na и F решетки NaF были установлены равными 0,231 Нм. Следовательно, ионный радиус Na +равно 0,231-0. 113 = 0,118 Нм. Радиус металла, полученный делением Половина расстояния между центрами 2 соседних атомов в Кристалле Металлическая решетка. Общий радиус неметалла также рассчитывается следующим образом
Половина расстояния между ядром молекулы или кристалла Простая субстанция. Эффективный радиус одного и того же элемента (Доля, Ион, металл) не соответствует. Это Доказать свойства атомов, а также зависимость эффективного радиуса、 Однако характер химических связей, количество координационных*и другие факторы также Ров (см. таблицу 4).
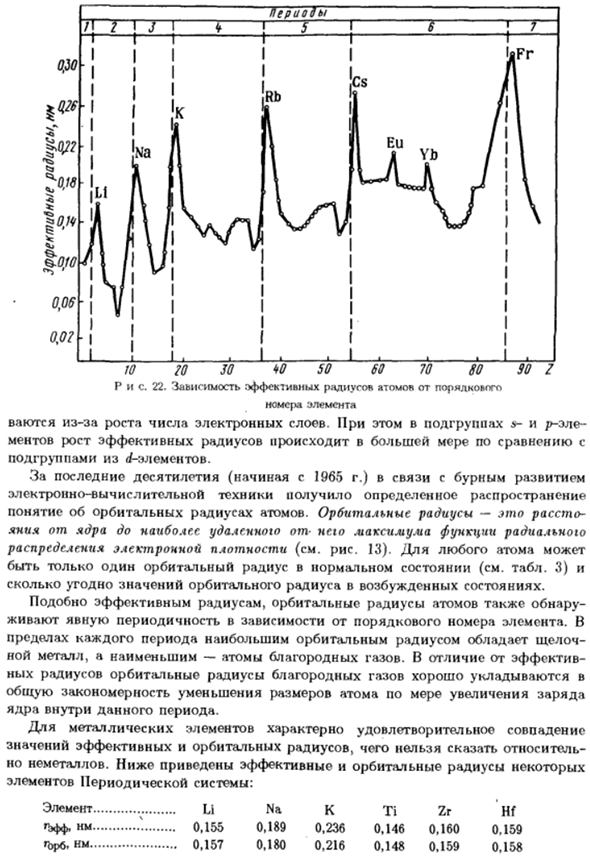
Изменение эффективного радиуса атома носит периодический характер Характер (рис. 22). в период с увеличением заряда ядра эффективный радиус Атомы уменьшаются по мере того, как электронный слой сжимается до ядра (В определенном количестве за определенный промежуток времени).Максимальное сокращение шипы S и P элементов. крупномасштабные наблюдения d-и / / элементов Более плавное уменьшение эффективного радиуса, соответственно называется d — и / или сжатие.
Эффективный радиус атома благородного газа Период работы системы закончен и эффективный радиус значительно превышен Перед ними/ (- элементы. Величина эффективного радиуса благородства Газ (см. таблицу 4) берется из межъядерного расстояния этих кристаллов. Вещества, которые существуют при низких температурах. И в благородном Кристалле В отличие от газов, слабые Ван-дер-Ваальсовые силы, например молекулы, действуют Галоген, который имеет сильную ковалентную связь.
В подгруппах периодической системы, эффективный радиус атома увеличивается * Эффективный радиус часто называют видимым. * ’Coordinating tea(c. h.) — число ближайших соседей в молекуле Или кристаллы, которые равноудалены от конкретного атома. В связи с увеличением количества электронных layers. In сложение, подгруппы s-и/> — ele- Рост ментов, эффективный радиус、 подгруппа элемента d. В связи с бурным развитием последних десятилетий (с 1965 г.)
Компьютерные технологии получили некоторое распространение Понятие орбитального радиуса атома. Радиус орбиты равен Влияние функции излучения от максимума до самого дальнего ядра Распределение электронной плотности (см. Рисунок 13).Для любого атома В нормальном состоянии имеется только 1 орбитальный радиус (см. таблицу 3).
То же число, что и значение орбитального радиуса возбужденного состояния. Кроме эффективного радиуса, также обнаружен орбитальный радиус атома В зависимости от серийного номера элемента, он будет жить с очевидным frequency. In В пределах каждого периода щелочь имеет наибольший орбитальный радиус Металлы, и самые малые, атомы благородного gases.
In контраст к эффективному Радиус пути движения благородного газа Общая закономерность уменьшения размера атома с увеличением заряда Ядерный в определенный период. Удовлетворительное совпадение-это особенность металлического элемента. Эффективный радиус и значения радиуса траектории, которые не являются относительными Но неметаллический. Ниже приведены некоторые эффективные и траекторные радиусы Элементы периодической системы: Из концепции орбитального радиуса видно, что она близка к истине.
Эффективный радиус * больше атомного size. In контраст с эффективной траекторией Радиус является свойством свободных атомов или ионов и является независимым От природы химических связей и др. factors. To предсказать между атомами Расстояние между молекулой и кристаллом требует знания его орбиты. Диаметр атома одинаков не только в нормальном состоянии, но и в возбужденном состоянии.
Но Задача расчета орбитального радиуса также с помощью мощного компьютера Возбужденное состояние атома еще не решено. По сравнению с возбужденным состоянием、 Общий радиус ion. In случай катиона натрия, например, его орбитальный радиус Расстояние от ядра до максимальной электронной плотности 2p- Поскольку Na не имеет 3 электронов, можно использовать электроны (I-слои на рисунке 21).
Теоретический расчет орбитального радиуса аниона аналогичен расчету Соответствующее нормальное состояние radius. In стол. 7 будут давать Орбитальный радиус и эффективный радиус нескольких ионов и нейтральных атомов. Таблица 7.Радиус следа и эффективный радиус Некоторые атомы и ионы Переход от нейтральных атомов к катионам (например, отменить Na — > Na +; Внешний электронный слой) с резким уменьшением орбиты Радиус.
Этот факт согласуется с теорией Бора[опорное уравнение (III. 7)], и Вывод квантовой механики (см. рис. 13).в то же время анионы (F — > F «и Орбитальный радиус нейтральных атомов практически не изменяется. В порядке. Однако, поскольку образование анионов обычно не связано с возникновением Новый электронный слой и оболочка. Например, при образовании ионов С1、 3-й электрон встречается с внешней 3 ^крышкой, на которой атом хлора равен 5 Электронный.
Таким образом, орбитальные атомный и ионный радиусы хлора существенно различаются. Они не отличаются друг от друга, равны 0,073 и 0,074 Нм, respectively. So … Таким образом, эффективные радиусы катионов и анионов в несколько раз больше Он превышает радиус орбиты. Это、 В общем, самостоятельные ионные кристаллы и кристаллы.
Те же доказательства Расход энергии на отделение 1 электрона от атома металла всегда равен «/Относительность и субъективность эффективного радиуса по крайней мере видна оттуда Дело в том, что в случае кислорода атомы определяются по Брэггу 0,066, Гольдшмидту-0,132 По опросу-0,140, по Слейтеру-0,060 Нм. 1 больше чем высвобождение его когда один электрон связывается с таким атомом F, C1, O, S и др.
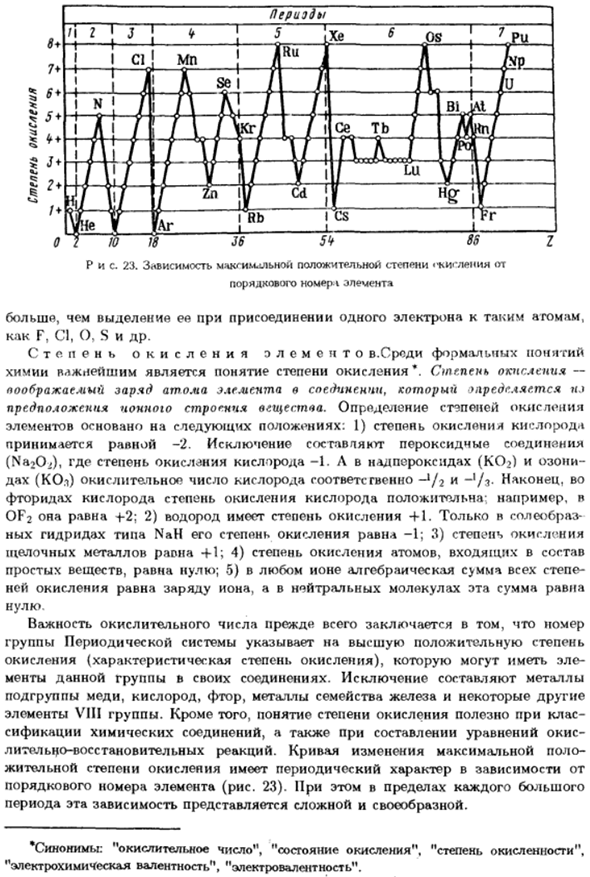
Состояние окисления element. In формальное понятие Наиболее важным в химии является понятие степени окисления*.Степень окисления- Атомный заряд элемента в соединении Предположение об ионной структуре вещества. Определение степени окисления Элементы, основанные на следующих положениях: 1) степень окисления кислорода Она будет равна −2.
Исключение составляют перекисные соединения (Na2O2), состояние окисления кислорода −1.И в перекисях (O2) и Озоне- dah (KOh) число окисления кислорода, соответственно — ’/ 2 и- ’ / s-наконец、 Кислород фторида, степень оксидации кислорода положительна; например Равно OF2 +2. 2) степень окисления водорода равна+1.Только в соленом виде Nah тип гидрида, его состояние окисления −1. 3) степень окисления Щелочных металлов равна+1. 4) степень окисления составляющих атомов
Простое вещество, равное нулю; 5) алгебраическая сумма всех порядков, с любыми ионами Скорость окисления равна заряду ионов, а в нейтральных молекулах эта сумма равна Обнулить. Важность числа оксидации главным образом Группа периодических систем показывает самую высокую положительную степень Окисление (характерное состояние окисления) Копы в этой группе соединений. Исключение составляет металл Подгруппы металлов, таких как медь, кислород, фтор и железо Элементы группы VIII. In кроме того, понятие окислительных состояний является
Классификация соединений и построение уравнений окисления Окислительно-восстановительная реакция. Изменение кривой максимального значения Важное состояние окисления、 Серийный номер элемента(рис. 23). кроме того, каждый большой Период, эта зависимость кажется сложной и своеобразной. * Синонимы: «число окисления», «состояние окисления», » состояние окисления«」、 «Электрохимическая валентность», «электрическая валентность». Пятьдесят пять » Несмотря на широкое использование в химии понятия окислительных состояний, оно является Это чисто формально.
В настоящее время экспериментально Истинный атомный заряд соединения не связан со следующими степенями Окисление этих элементов. Следовательно, фактический заряд атома водорода и Хлор молекулы HC1 делится на+0.17 и −0.17 (и состояние окисления) соответственно. +1 и −1). В кристаллах сульфида цинка ZnS заряды атомов цинка и серы равны + 2 и −2 вместо формального состояния окисления+0,86 и −0.86. Даже невозможно определить степень окисления по валентности элемента. Их абсолютные значения совпадают.
Валентность атома определяется как число Химическая связь, с которой связан этот атом Он имеет знак (+или -) и может быть равен нулю. Поэтому особо не получилось Выражение «положительная и отрицательная валентность», в частности «ноль» Валентность», все еще присутствующая в химической литературе. Например, метан МФ, метиловый спирт Снзон, формальдегид, муравьиная кислота HCOOH и CO 2 CO 4, валентность углерода равна 4、 Его окисление, соответственно-4、-2、0、+ 2、+ он будет равен 4.Также установить Для определения валентности атома необходимо знание его химического строения и определение Состояние окисления проводят изолированно от структуры вещества. Официально.
Смотрите также:
| Многоэлектронные атомы | Химическая связь и валентность |
| Периодическая система элементов и электронная структура атомов | Энергия химической связи |

