Оглавление:










Искусственная радиоактивность
- Искусственная радиоактивность. Детальное изучение взаимодействия алюминия с α-частицами полония показало, что этот процесс протекает по общей схеме(Кюри и Жолио, 1934).) после удаления источника а, эмиссия нейтронов немедленно прекращается. Напротив, выброс позитронов продолжается, его интенсивность уменьшается по закону радиоактивного распада (§ 1).Реакция задачи пришла к тому, что она протекает в 2 этапа: нервный по схеме Реакции 27al + а = 30р + Н Образуется радиоактивный изотоп фосфора («радиофос- В случае») » он добровольно делится по схеме пнп = = ор х \ + е *
- Период полураспада^ P составлял 2,5 минуты. Открытие искусственной радиоактивности показало, что помимо распада и 0 распада, существует также распад позитрона. Поскольку высвобождение позитронов сопровождается уменьшением положительного заряда атомного ядра на единицу, закон смещения требует, в данном случае, перехода в левую сторону продуктов распада периодической системы(без изменения массового числа).
Из-за характера распределения скоростей позитроны подобны 0-лучам(рис. XVI-3). Людмила Фирмаль
После работы Кюри и Жолио было обнаружено множество других случаев возникновения искусственной радиоактивности. В настоящее время уже известно около 2000 радиоактивных изотопов, и они получены для всех химических элементов. Радиоактивные изотопы обычно получают путем обстрела ядер положительно заряженными частицами (p, d, a) или нейтронами. Иногда также используются очень жесткие Y-линии. Часто одни и те же радиоэлементы могут быть синтезированы несколькими различными способами.
Например, «радиоактивный азот», 3N образуется по следующей схеме: 10B + a, 3N + p, 2C-f p, 3N + y i » N + d -, 3N + 3H «N++, 3N + 2 n» C + < f — «l3N + ft MN + Y -^, 3N + N + D -, 3N + n» n «c + < f -» L3N + ft MN + Y -^, 3N + N + D + d + D Преобразуется по схеме J3N -«, 3C -} — V, а период полураспада составляет 10 минут. Для регистрации образования радиоактивных элементов и траектории других ядерных реакций часто используются сокращенные методы. „Со + Н „1“ со + Т и со (н, г) „совместное Эли + / Т = 3ч + а“ Ли (/т, а) 3Н Радиоактивный кобальт “ Co (P, y распад, T = 5,3 л)», полученный в первой реакции обычного b9Co, имеет множество практических применений.
Во 2-й реакции получают тритий, который преобразуют по схеме®Н=3Не-f — 0, с периодом полураспада 12,3 л. 2 * 3 Как правило, искусственные радиоактивные элементы распадаются с выделением электронов или позитронов, и наблюдаются следующие закономерности: относительно тяжелые (по сравнению со средним атомным весом этого элемента) радиоактивные изотопы испускают электроны, а относительно легкие-позитроны.
Довольно часто происходит также одновременная изоляция dais. In в этом случае, как исключение, происходит типичный распад членов естественного ряда радиоактивности. Еще одной особенностью большинства искусственных радиоактивных элементов является однократный распад (то есть прямой переход от радиоактивных исходных продуктов к нерадиоактивным конечным продуктам).
Период полураспада большинства искусственных «радиоэлементов» относительно короткий, чаще всего порядка секунд, минут, часов или дней. Это редко бывает более 1 года. Исключение составляют только радиоизотопы с периодом полураспада более 1000 years. So, в природной смеси изотопов»радиоактивные элементы» практически отсутствуют. Искусственное производство «беспроводных элементов» обычно приводит к образованию ничтожного количества, а в дальнейшем распределяется повсеместно Масса источника material.
In в связи с этим именно химические методы исследования играют очень большую роль в изучении искусственной радиоактивности. Без их помощи можно решить 2 основные задачи в данном случае-установление характера активности носителя и выделение радиоэлемента в концентрированном состоянии. Поскольку химические свойства изотопов почти идентичны (§ 2), каждый «радиоактивный элемент» ведет себя химически так же, как и соответствующий нормальный. Это является основой для решения обеих вышеперечисленных задач.
Например, если предварительно подвергнутая нейтронной бомбардировке железная пластина растворяется в азотной кислоте, в раствор добавляется небольшое количество соли марганца, действует подходящий окислитель (KSY3), MnO2 осаждается, и железо остается в растворе. Другое исследование растворов и осадков показывает, что в последних концентрируется радиоактивность, то есть ее носителем является «радиоактивный марганец», что в основном означает саму схему трансмутации: ^ ИП + ^ МН-ф п В то же время было установлено, что полученный»радиоактивный марганец»(Р, гамма-распад, T = 2,6 часа) концентрируется в осадке MnOg.
С другой стороны, идентичность химических свойств изотопов позволяет получить прямое и убедительное решение многих важных химических и биологических проблем с помощью»радиоэлементов«.Дело в том, что частичная замена некоторых элементов в соединении радиоактивными изотопами не изменяет химических свойств этого соединения, но последнее становится радиоактивным. Поэтому, используя высокочувствительный метод установления радиоактивности, можно отслеживать все последующие превращения этого соединения (точнее, радиоактивных атомов, которые оно содержит) в ходе различных processes.
As упомянутые выше радиоизотопы приобретаются искусственно для всех стабильных элементов. Таким образом, радиоактивное маркирование, как правило, становится универсально применимым методом для экспериментальных исследований различных научно-технических проблем. Многие подобные исследования с использованием «меченых атомов» уже проводились. Важным достижением для химии в целом является синтез элементов, отсутствующих в земной коре-технеция (ТК), Прометия (ПРГ) и астатина (Ат).I.
It было заполнение пустого пространства в периодической системе Менделеева. Для каждого из них было получено несколько радиоактивных изотопов. Для определения атомного веса такого элемента, который неизвестен в стабильном состоянии, обычно используется массовое число изотопа, которое является наиболее прочным или лучше изученным(чтобы отличить его от обычного атомного веса, заключенного в квадратные скобки). Большое значение имел синтез микроэлементов, то есть атомный номер более 92 элементов.
При взаимодействии ^ U с медленными нейтронами образуется^ U, и его распад вызывает появление нептуния (Np) и плутония (Pu) по первой 2-членной схеме трансуранового ряда: 338 ″» + РТ? J9r, 0 339vt_r zzogl. И U — > 92 U > 93 Np — — — > 9 ″ Pu G-23 и G Tt * 2.3 AN Сформированный таким образом ^ Пу характеризуется периодом полураспада» — конверсии (с переходом на 235 У)» и 24 400 годами. Следующий супер элементов урана, америция(9sAm), кюрий («ст»), беркулисом (97Bk), Калифорния (J в»МВ), Эйнштейниум (Уэс), и фермия. (ooFm), Мендель (ioiMd), norberium (102N0), Лоуренс (Юз ^ Р),
Чик чат (iwKu), и элемент? 105-очень быстрые частицы СС синтезировались бомбардировкой более тяжелыми ядрами соответствующих атомов с более низким атомным номером. Все они очень радиоактивны и поступают только в очень малых количествах. Как видно из вышеизложенного, изучение ядерного превращения урана и последующих элементов имеет большое фундаментальное значение не только для него самого, но и для всего периодического закона.
Еще важнее то, что в результате таких исследований удалось получить первое решение проблемы практического применения энергии в атоме. Добавь 1) простой «радиоэлемент» -это нейтрон, который может самопроизвольно разлагаться по схеме: n = p-f {$- |- v-f0.78 eev, период полураспада 12 минут. Из-за того, что это время является относительно длительным, нейтроны, которые возникают при определенных условиях, обычно захватываются в каком-то ядре еще до его распада. 2) типичный пример трансмутации, которая приводит к образованию «радиоэлементов».
Сравните следующее: параллельно с основным уравнением указаны сокращения его обозначения и Период полураспада конечного радиоактивного изотопа. » Ы-ф а — ► » сл + Д » (Е, D)> 4CI * ХЛ — ► » с + ф + г 32 м Компания MSI + а — ► «п + п» Си (а, п) «п РГ — ►» з + п 14.3 Ди «Фе + а —►» ини-ф Н $ <Фе(с, н) » жни «энвила» НЛ —► 5 * со + 1.6 Ди «С + д *> р + а»(д, А) * П. СОП — ► » Си + 2,5 м «Si-f d — ►» Si + p «Sl (d, p) 3, SI» Si — * 2.6 часов «Ка-ф д -» СК-ф Н «Ка(р, n)°СК°СК — ►» Са + е * + г 3.9 ч «П-ф п-►н. з-ф А» Н (Р, А) «С» с — ►•«б-ф 20.4 м В 0Zn + п — * 70га-ф-Н «ЗН (р, н) 70га 70га — ►’ ®Гэ-ФП + г 21 м Мкр-ф п — ►5, МН-ф г * °Ср(р, г) с ’ J, МН е МН — ► 51 пр-Ф З. * 45 м IMi 4-n — ► » V-A IMP (l. o); 5V s? г — ► » СГ-Ф р + м 3,8 м •»Y + n — ► * ® Sr-f P * * ® Y (n, p) S9Sr 99 Sr — ► 53 дня 9TAu + н -► ’» ас + г, 97 ас (н, г) iasAu, МАУ —► 2,7 дня «Мг + г — (Ю. 24Na — ►» мг-Ф ►» Ма + Р » мг центр + г 15.0 ч. .9Ф + г ->, СФ-ф-Н — * Ф(Я. Н) 19р его Ф-*•10+ в * 1,8 ч
В процессе столкновения различных частиц с сырьем、 Радиоактивность постепенно возрастает, и через некоторое время (3Degrees периода полураспада) достигает своего практического максимума. Дальнейшие толчки не приводят к заметному увеличению выхода излучающего элемента, поэтому его уже нет purpose. In наличие ампул с источником нейтронов Радий-берилл, многие радиоактивные элементы можно получить в любой лаборатории.
Обзорная статья по производству радиоактивных изотопов * имеются специальные монографии. 3) возможность образования и кратковременного существования радиоактивных изотопов гелия с массовыми числами 5, 6, 7 и 8.Наиболее изученными из них были «2 схемы, JC-f p — * — eHe-f bp n Mg + A -» He +» Mg. It будет разделен следующим образом(T «= 0,18 секунды): «нет-*- + 4 С-П + в-f9Be — «не +»нет.
4) интересна нейтронная радиоактивность, 7N (G = 4,1 С), которая была впервые обнаружена при изучении радиоактивного азота. Ядро последнего проходит, высвобождая частицы Р * Мурин А. Н. Нефедов В. Д. Ют Лендов И. А.. Успехи в химии. I9S5, M. 5. 527. * * Левин В. И. достать радиоактивные хот-доги. М. Это не первый раз пара была замечена вместе. / 972. 256 секунд В возбужденном ядре {, rO} он немедленно стабилизируется путем высвобождения нейтронов: «N-■{、70)--、bO + i-
Если в искусственно генерируемых ядрах наблюдается значительный дефицит нейтронов (по сравнению со стабильной областью-рис. XVI-19), то, по-видимому, возможна протонная радиоактивность. б) помимо описанных выше способов преобразования радиоактивных элементов, для некоторых из них весьма характерен переход ядра в устойчивое состояние за счет захвата электронов из собственной электронной оболочки.
Такое преобразование называется захватом электронов (EZ). в результате электронного захвата атомный номер элемента уменьшается на 1.Например. S7Ar (G * 35 дней) преобразуется в * CI, (7* = 0.9 L) — * T1, etc. In помимо рентгеновского излучения, обусловленного перестройкой электронной оболочки, захват электронов часто сопровождается ядерным гамма-излучением. Эй. В большинстве случаев захватывается электронная оболочка / C. Однако в этом нет необходимости.
Например. При 10tTl (G-12 дней) захват электронов в оболочке L происходит примерно с одинаковой частотой (отношение L / K составляет 0,9±0,3). ^ Pb(G-3-10’l)/. в случае-захвата это еще более характерно. 6) поскольку вероятность захвата электронов зависит от плотности электронов вблизи ядра, природа окружающей среды может существенно влиять на легкие атомы.
Было показано, что коэффициент конверсии 7Be (Г»= 54 дня) несколько отличается в зависимости от серии (be (metal)> BeO> BeFf). 7) в частности, необходимо отметить e6Hg (rt, y), e7Hg, образованные реакцией»хорошая ртуть«, t7Hg. преобразование в wAu через e-capture происходит с 2 различными периодами полураспада-24 часа и 65 часов. Это явно указывает на наличие в 1WHg ядерной изомерии, которая довольно часто встречается среди радиоактивных элементов. Рассматриваемая реакция интересна и с другой точки зрения-как фундаментальная реализация мечты алхимика о получении золота из ртути.
8) из-за наличия ядерной изомерии захват электронов часто является лишь 1 из 3 возможных способов стабилизации ядра. Пример-40K (§ 3 add.2). Процесс, уже происходящий после образования земной коры по схеме MK + + e — * — <Arn, по-видимому, является причиной быстрого распространения^ Ar в атмосфере по сравнению с другими изотопами и другими инертными газами.
Радиоактивное происхождение большей части атмосферного аргона, в частности, подтверждается исследованием минерала Карни.1 кг природного KCl содержит^ NT 0,5 si3°Ar, который не содержит смеси других изотопов. 9) например, используя «радиоактивную серу» ^ S, она характеризуется относительно медленным 0 распадом(G = » 88 дней).Неравенство обоих атомов серы в тиосульфат-ионах, отсутствие полного экранирования сернистой кислоты без серы, наличие такого экранирования без сульфата и др. можно было бы прямо доказать.
- Аналогичным образом было непосредственно доказано наличие ионного обмена платиновых комплексов. Самое интересное, что [PtX *! «В типе ионов Cl * — Br »-1″ — CN-это то, что параллельно с увеличением устойчивости Внутренней Сферы вдоль ряда обменный курс не уменьшается, а увеличивается. Галоген, изотоп, eF, * Cl(r. Г= 3-105 л) и характеризуется r. он характеризуется y-распадом * C1 (T » 37 м). «БР [Т = 353 H) и? ’H(7 » = 8 дней).Например, установлено, что в водных растворах обмен свободных галогенов с соответствующими галоген-ионами происходит почти полностью instantly. It не происходит в нормальных условиях. Обмен с алкилгалогенидами происходит в водных растворах, но такой обмен осуществляется с другими растворителями(спиртами, ацетоном).
Обмен брома с Альбном происходит быстро, в случае алкилбромида, и только медленно, когда бром присоединяется к бензольному кольцу, процесс атомарного обмена происходит как реакция одной молекулы е. Используя C, мы обнаружили, что обмен углеродом не выполняется даже при 200°C между CO и CO2.Аналогично, при относительно низких температурах не происходит серого и газофазного обмена между SO и SOj. А задница-как атом, содержащий мышьяк. Напротив, MMP (e-capture) между миганиганом и перманганатом. Y, T■ » 303 день) замена очень быстрая. Возможно, процесс здесь действительно протекает через обмен электронами, а не атомами.
Фосфат не обменивается в водном растворе Раствор, содержащий атомы Р, содержащие фосфиты или гипофосфаты. Людмила Фирмаль
Наличие очень быстрого обмена такого типа, в частности, MFe (r. T был установлен с использованием 45 дней). Метод радиоактивной маркировки может быть использован для измерения давления паров нелетучих веществ, растворимости труднорастворимых соединений. Адсорбция небольшого количества газа из-за твердых частиц и так далее. С его помощью особенно удобно контролировать целостность осадконакопления и разделения в аналитической химии и др. Имеется монография по использованию радиоактивных изотопов в химических исследованиях.
10) Радиология aNa (c*, EZ. Y, T = 2,6 л) является обычным исходным материалом при производстве позитрония (§ 3 add.7).Вместо сложного рентгеновского устройства часто можно использовать рентгеновский снимок 0Trn(r. Y, T-128 дней) или u7Pm(r. «=»- =2.7 l).Некоторые радиоактивные изотопы-Sr (r. T = 27,8 л). , 44Се, (R. Т = «285 дней), m7рш, WCS, 0RO и др.- была предложена конструкция»атомных» электрических элементов. Есть много других самых разнообразных применений радиоизотопов в промышленности. I) схема»атомарного» элемента показана на рисунке. XVI-42 (а-вакуумный металлический контейнер./ > —
Внутренний электрод. B-изолятор, G-радиоизотоп).Если радиоизотоп является Р-излучателем. a когда излучатель возвращается, полюса распределяются, как показано на рисунке. Атомные элементы могут производить очень высокие напряжения (порядка десятков тысяч вольт), но сила тока очень мала(порядка 10 миллиардов 1 ампер).Они (или батареи, собранные из них) могут быть пригодны для использования в радиотехнике И оборудование. В
ремя работы (и другие характеристики) определяется природой применяемого радиоактивного изотопа. 12) поиск нефти и других полезных ископаемых в разведочном бурении, часто используется нейтронная морковь. То, что схематично показано на рисунке 2, медленно опускается в скважину. Блок XVI-43.Его нижняя часть содержит источник нейтронов, встроенный в свинцовый слой (обычно из Po-Be, потому что он не дает y-линии).
Окружающие блок породы частично поглощают нейтроны. Радиоизотопы формируются и их излучение создает импульс в ионизационной камере (ИК).Нейтроны частично отражаются. На это указывает импульс счетчика нейтронов (НС).Свойства их и других импульсов (регистрируемых приборами на поверхности) позволяют судить о природе породы, через которую проходят блоки с источниками нейтронов.
13) нейтронное облучение исследуемого материала является обычной первой стадией радикального активационного анализа. Радиоактивные изотопы, возникающие в результате излучения, определяют состав исходного образца или наличие в нем примесей. Главным преимуществом этого метода является необычайно высокая чувствительность. 14) интересно изучать человеческие волосы с помощью радиолокационной активации analysis. It оказывается, в нем содержится много химических элементов в ничтожных количествах. Например, в среднем она составляет 5-10%, причем у мужчин этот процент больше, чем у женщин.
Напротив, ас в женских волосах больше, чем в мужских волосах. * м Th Вы Ряса. В XVI-42. схема «томной» метрики «Лем * и-та». NA ООН х Диаграмма Xvi-43.Схема схемы блохи cn*. * Нефедов В. Д. Торопова М. А. .. Крнвохецкда И. В.. Снотова Е. Н. радиоизотопные и химические исследования. М. и»химия.»1965.300 секунд 1: 10000.То есть анализ радиоактивности (достаточно 1 волоса) будет служить судебно-медицинской экспертизой examination. In в частности, исследование волос Наполеона(стрижка на следующий день после смерти) показало, что он пристрастился к мышьяку, и что последние 4 месяца его жизни отравили его. 15) искусственные радиоактивные элементы имеют важное применение в биологии, поскольку они могут непосредственно контролировать распределение веществ в живых организмах и их метаболизм.
Например, если растворить соль в воде, содержащей смесь»радио натрия» 24Na. Если вы дадите этот раствор пить человеку, который положил руку на счетчик ионизации, счетчик ионизации начнет записывать радиоактивность через несколько минут. Это означает, что ионы Na *, попав в пищеварительный тракт, попадают в кровь практически сразу из пищеварительного тракта, и она разносится по всему организму. body. In аналогичным образом было обнаружено, что негалогениды текут почти так же быстро, как кровоток, а к-ионы примерно в 2 раза медленнее.
Эксперименты с 3F показали, что организм животного хорошо всасывается из пищеварительного тракта. Неорганический phosphate. It также было показано, что поглощение фосфора отличается между нормальными и раковыми тканями. Рисунок XVI-44 представляет собой снимок ломтика помидора, сделанного радиоактивным цинком radiation. It поглощается растениями из питательного раствора. На фото хорошо видно, что цинк концентрируется в семенах.
Используя N, было показано, что ячмень может фиксировать небольшое количество свободного азота в процессе роста. Изотоп » С. большая возможность открылась для биологии, 4С. характеризуется распадом Р и Т = 5760 л. Этот изотоп также очень широко используется в археологических исследованиях. Однако следует отметить, что исторические даты, установленные с его помощью, всегда считаются не спорными. 16) радикал кобальта mCO, полученный из нормального * °C с использованием реакции(l, y) или(d, p), является отличной альтернативой Радию для медицинских применений в лечении рака и т. д.
То же самое касается 37Cs. Т= 29,7 л). путем канюлирования хлорида натрия с дейтероцином J4Na, он легко получен реакцией (d, p), поэтому его можно также ввести сразу в тело, без страха долгосрочных вредных последствий. Особый интерес с этой точки зрения представляют радиоактивные изотопы элемента, которые избирательно поглощаются отдельными частями тела (X 2 postscript 103).Уже есть успешные попытки использовать подобные «радиоэлементы» в медицине. Например, изотоп ieaau (P, y, T-2,7 суток), который накапливается преимущественно в печени, помогает как в диагностике, так и в лечении злокачественных опухолей, которые в ней формируются.
17) обратите внимание, что известная радиоактивность является свойством человеческого организма itself. In факт, человеческое тело содержит около 0.08 g °K и 1-10 «’ °G Ra. Эти 2 типа естественно радиоактивных атомов производят только около 4 а распада и 2 млн р распада в секунду. Космические лучи проникают постоянно, некоторые из них вызывают образование искусственного радиоактивного элемента.
Из последних при распаде около 3000 р в секунду образуется только 1 радиоактивный углерод (его содержание обычно оценивается в 1: 10).Таким образом, общее число радиоактивных атомов, распадающихся в организме человека каждые 1 секунду, составляет менее 25 000. 18) учитывая широкое распространение соединений водорода, радиоактивность самых тяжелых изотопов воды имеет большое значение от химии до биологии. •• ’Ф’ в ’ ч. Диаграмма Xvi-44. R * dio1 » ломтик помидора tohrchf. Род-тритий (T).Последний преобразуется по схеме р с периодом полураспада около 12,3 лет 3H — * — 3He-f. то есть он очень долговечен.
Основная трудность в использовании радиоактивного дисплея обусловлена очень низкой энергией Р-излучения (0,0186 МэВ).Использование трития, в частности, позволило добиться того, что атмосферная влага может проникать в организм человека через кожу. Известно, что более 10 ядерных реакций приводят к образованию трития. Простейшей является дейтронная бомбардировка соединений дейтерия, в которой параллельно протекают 2 процесса.2Д (д, л) 3Не и 1Д (д, п) * T. Если существует мощный низкоскоростной Источник нейтронов, Илай(л. А)9Т реакция эффективна.
Такие процессы, происходящие под воздействием космических лучей, обеспечивают постоянное содержание незначительного количества трития в обычной воде (а также наличие «не в атмосфере»). заключая тритий в закрытую стеклянную емкость со стенками, покрытыми подходящим люминофором(XII§ 3 add.86), может создать источник света, который не требует постоянного энергоснабжения. Есть монография о тритии. 19) еще один элемент, имеющий большое значение в химии и биологии-кислород-известны только радиоизотопы с очень коротким сроком службы.
Период полураспада » Yu (e*). ’Yu ( * ♦ ), (p, y) и * 0 (R. y)составляют 71, 124, 29 и 14 секунд соответственно. 20) наличие 3 стабильных изотопов (’S, T0, 30) в кислороде и изотопов (’H, D, T) в водороде создает возможность образования молекул воды весьма разнообразного состава. Из них»самая сверхтяжелая» вода-туя-характеризуется, пожалуй, следующей константой. 9, т. 104 ° C плотность 1,33 г / с * 3. 21) ниже сравниваются характеристики излучения Tc, Pt и At, а также урана*°Fr той же серии AsK. «ТС —►» РН + 0(7-2. 1 * 10 * л) слов в минуту—►, 47Sm + П(7 * −2.7 л), 0At — ► * ’°по + г(7 *-8 3ч)МФР — ► » 3АсХ + р(г-22 м) Астатин может быть получен реакцией Бифа. 3n),, 0At, прометий-начиная с неодима: l46Nd (n, y) U7Nd, M7Nd, 4, Рш-FP (t = 11,1 дней).
Наиболее сложным является синтез технеция (через промежуточное ядро возбуждения): * Mo(l, y) wMo, затем * Mo {^ Tc} 4p (T = 67 часов) и, наконец. {**Тс) » тс + г(т = * 6.0 ч). 22) само оборудование в стабильной форме Tc и Pt соответствует правилам изотопной статистики, нет 2 стабильных nzobar с только 1 различным ядерным зарядом. Соседи технеция (Mo и Ru) имеют сумму всех стабильных изотопов, которые непрерывно различаются по массе на единицу в диапазоне 94-102,а соседи Прометия(Nd и Sm) находятся в диапазоне 142-150.
Атомный вес ТС и ТЧ должен находиться в указанных выше пределах, поэтому предполагается, что в природе вообще не будет устойчивых форм этих элементов. Невозможно сделать подобный прогноз для Астатина и France. It это потому, что соседняя страна имеет радиоактивность. Однако последняя ситуация сама по себе противоречит наличию стабильных изотопов в обоих этих элементах. 23) о большинстве трансурановых элементов известны некоторые зотопо*некоторые данные о них сравниваются в следующем: * E и E в E. тритий и его комбинация. М от английского пер. Лцшюдат, 1970.309 секунды Элементарный атомный номер.
Изотопы известны в пределах массового числа. Самый длинный изотоп L имеет период полураспада (AR » распад> НП 93 227-241 237 2.10 Л Ри * Л 232-246 244 8.I07 л AM 95 237-246 243 с. 10 секунд. Cm%23Я-252247 2.I07 L ВЕЛИКОБРИТАНИЯ 97 242-251 2471-10®Л CI 98 242-254 251 I. I05 L Эс 99 245-255 254276 дней Ласты 100244-237257 80 дней МД 101 255-25. 4 258 54 дня Постановление № 102 251-257 255 3 м LR 103 266-259 236 24 секунды Ку 1SCH 257-261261 70 секунд 105260260 1,6 секунды Для менее прочных изотопов рассматриваемого элемента следует отметить, что он характеризуется распадом 249b *(7 *™314 дней) 0 и y2cg (T = 2,65 л).В этом отношении интересен изотоп JMPu(o, T = 6.4 l).Это, по-видимому, лучший источник энергии для устройства искусственного сердца. 24) трансурановый элемент был впервые синтезирован по следующей схеме:
Радиоуправляемый(стр. Г)240Pu(р, г) м, Пу (П) 341 Ам 2 ″ — Эс(Л. Д. Г)2S4Es (П) 284Fm 2WPu(а. Н) Вт, см 253Es(а. л) 25eMd 341 ам(а, 2л)aobk 24vSt (2С).4л)2Вт 2.2 Cm (a.2l) 244Cf 252Cf (, 0V. 5l)2S7Lr 2MU («4Н.6л) 246Es 242Pn(реакция 22ne.4л)?90ку 24SAm («не.5л) — 40105 Существует множество монографий о трансурановых элементах*. 25) длинный столбец радиоактивности генерируется из 257Np. It это называется серия нептуния.: И 2% «2,’ J и — Мистер тг-г’ а И5Ас — > ■ 221 fr — * 2.7 at — > ■ 2 «v» 47 m 209pb-г0 * В1 10 в 4.«И 0,03 секунды ’Л и Р и А в * Х и И. А.. Золото. М.
Издательство Академии Наук СССР. В 1958.128 стр. Х а м д Я.. З а б р р Г. трансурановых элементов. На Английском Языке. Я. А. Смолоцкий. М.. От света даттана. 1959.206 ПП. Гольданскип У. И. Л. И. элемент Джойса периодической системы Менделеева. Х.„Я не собираюсь этого делать“, — сказал он. 1064.280 секунд S n b r r r G. искусственно » ультра-урановые элементы. С английского, Изд. А. К Лаарухмо! М.: ой! Айди.1, 965. Чжу с、
Характеризующаяся мангровой массой типа 4π-FI (I-целое число), эта новая серия естественным образом дополняет ранее известные сортовые серии тория (4l), урана (4l + 2) и актиния (4l + 3). 26) 4. значительное количество ответвлений всех радиоактивных колонок было также получено искусственным путем. Их обычными предками являются различные изотопы самого тяжелого-самого тяжелого-зулемита. Например, * * Phi производит следующую ветвь урана в серии. ААА! «Ри, Ри-azots- »» й — * МРТ — * мрн-Р * С 9 часов 21 день 31 и 39 секунд 0,03 секунды
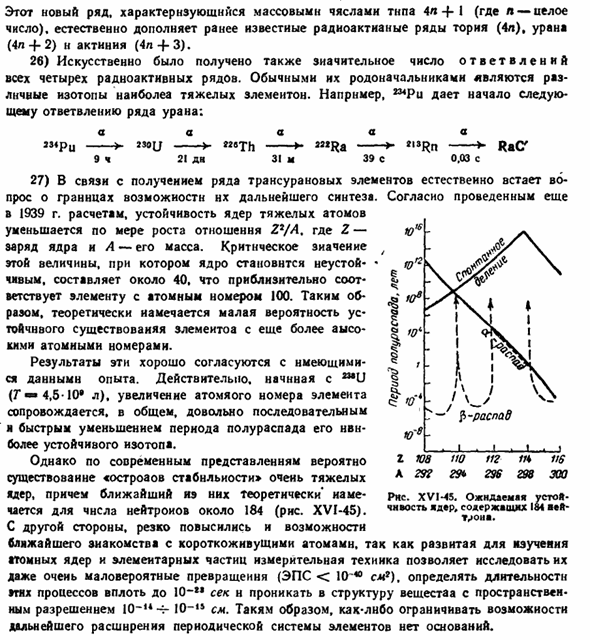
27) в связи с образованием большого количества трансурановых элементов естественно возникают проблемы с ограничениями возможности дальнейшего синтеза. Согласно расчетам, проведенным еще в 1939 году, с увеличением отношения Z * / A устойчивость тяжелых ядер снижается. Где Z-заряд ядра, а A-его масса. Критический коэффициент этой величины, при котором ядро становится неустойчивым, составляет около 40, что примерно соответствует элементу с атомным номером 100.So, теоретически, если атомный номер еще выше, то вероятность стабильного существования невелика.
Эти результаты хорошо согласуются с имеющимися экспериментальными данными data. In дело в том, что начиная с mU(T 4,5-10 * L), увеличение атомного номера элемента обычно сопровождается довольно последовательным и быстрым уменьшением периода полураспада наиболее стабильных изотопов. Однако, согласно современным представлениям, существование устойчивой структуры возможно для очень тяжелых ядер, а ближайшее из них теоретически оценивается по числу нейтронов-около 184 (рис. XVI-45).
С другой стороны, разработанная методика измерения объема ядер и элементарных частиц позволила исследовать очень редкие превращения (ЭПР <10 40 см9) для определения длительности этих процессов, что привело к быстрому увеличению вероятности близкого знакомства с короткоживущими атомами. «10-Л4-10-проникает в структуру вещества в пространстве 10-с разрешением. Поэтому нет оснований ограничивать возможность дальнейшего расширения периодической системы элементов. г ЮА 112 11 * 116 а 292 29 * 296298300 Рисунок Xvms. Ожидается стабильность » дер, содержание 184 аэфт- Т ^ее.
Смотрите также:
| Состав атомных ядер | Деление ядер |
| Превращение элементов | Термоядерные процессы |

