Оглавление:
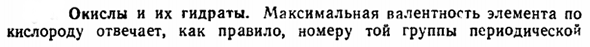






Окислы и их гидранты
- Оксиды и их гидраты. Максимальная кислородная валентность элемента, как правило, соответствует числу его групп в периодическом законе Система, в которой он находится. Существует относительно мало исключений, к ним относятся инертные газы (кроме Xe), Cu, Ag, Au, H, F, некоторые лантаноиды(Ce, Pr. ТБ) и большинство актинидов. В большинстве случаев соответствующие характеристические валентные свойства оксла (и особенно его гидратов) являются наиболее важными детерминантами химических свойств рассматриваемого элемента. Поэтому такие оксиды сами по себе можно назвать свойствами. Они не считаются в первую очередь инженерными, так как наиболее интересны с точки зрения общей систематики.
- Теплота образования (связывания) характерного оксида сравнивается с рисунком Xv-39.Из рисунка видно, что элементы от 1 до 6 рядов аналогов соответствуют величине теплового эффекта, которая значительно больше, чем элементы от 11 до 16 рядов. Эта ситуация тесно связана с различием в структуре внешней электронной оболочки соответствующих ионов, которое можно обобщить в виде следующих правил: образование химических соединений из 18 электронов или незавершенных внешних химических соединений и аналогичных катионов тепла.
Оболочка значительно ниже катиона инертного газового типа с таким же зарядом и близким radius. Людмила Фирмаль
An примером такой закономерности является следующее сравнение теплоты образования некоторых оксидов(ккал / г-экв:— На * КР * С.*Если 2°Pb4 * РБ * ти * Ср ’ * ПБН Улу Радиус, А •. •0.98 0.98 1.06 1.03 0.87 0.84 1.49 1.49 1.27 1.32 0.78 0.78 Структура раковины 8 18 8 18 8 18 8 18 + 2 8 18 + 2 8 16 Теплота образования на экваторе•••••49.5 20 76 31 65.5 16.5 39.5 21 70.5 26 72 29 Большинство характерных оксидов более или менее трудноразрешимы. Их относительно немного exceptions. Do к ним относятся газы, в основном жидкие Clos при нормальных условиях CO2? Mn207, твердые, но очень растворимые Ru04 (25) и 0s04 (41 ° С), а также легко возгоняемые N ^ Os (32) и SO (43°С).Наиболее тугоплавкими оксидами являются Be, Mg, Ca, Zr, Hf, Th, а их температура плавления находится в диапазоне 2500-3000°С.
Интересен рост плавления и летучести между CO2 и SiO2.Первое из этих соединений сублимируется при −78,второе плавится при 1723°С и кипит при 2590 ° С. Все характерные оксиды короткопериодных элементов бесцветны. Наоборот, многие из них тянутся на длительный срок. Среди более низких оксидов элемента процент окрашивания все еще намного больше. Характерное отношение оксида к воде можно увидеть из следующего сравнения:-• «•
Особенности отношения к воде Химическое взаимодействие с образованием растворимых гидроксидов растворяется без выраженных химических взаимодействий химическое взаимодействие с образованием преимущественно нерастворимых гидроксидов Ru, Os щелочных и щелочноземельных металлов, B, C, N, P, As, S, Cr, CI, Mn, Re Be, Mg. Актиниды Sb, Sc, Y, La, лантана и большинства других элементов Гидроксид, который соответствует последнему типу оксида, получают только indirectly. In вода, почти все они (за исключением теллуровой кислоты) практически нерастворимы. Гидраты оксида Cu \ Ag + T Au *и Hg2 *уже разделяют воду в нормальных условиях.
- Поскольку свойства гидроксидов ранее изучались достаточно подробно (XIII§ 3), приведено лишь краткое сравнение их типов с перечнем элементов, для которых эти типы наиболее характерны below. In для сравнения также рассмотрены наиболее важные производные низших оксидов. Характеристики гумукического оксида Валентность Е Характерный тип Кислый Оснаев Совместимость Ионный. Е (О) Е (О) 4 \ Н ео、} №} Н eo4 Ne4 КС, РБ. К. На, ли, ти С). (АГ.) (Au) Re, Bi, Sr, Ca, Mg, Cr, Mn, Fe Co, Ni, Cu, Cd (Hff) La и лантаноиды, Y, Sc, Ir, Rh, Fe. Би, ти Че, ХФ, ЗР, У Се Па Zn, Be, Pb, Sn В, Алабама, Джорджия, Пр、 СБ, Ас ти, ПБ, ЗП, Пт, т е та. Nb У НП. Pu Br, CI Б, Как. П. Н Си, с, ВР. Se. С V. Sb, As, P, N、 Я, Бр, Би, ж, МО, КР, Тэ, СЭ, С. млн Ре. Ос. Ру МН, ТС, Ре, си, я Я И затем в IV В ВИ VII
Снизу вверх (или наоборот) для каждой подгруппы периодической системы, в общем случае, свойства характерных оксидов и их гидратов изменяются достаточно сильно naturally. In кроме того, из сравнения (родственной) теплоты образования уже известно, что аналоги элементов малого периода в данном случае являются именно членами аналогов 1-7-го ряда, а соответствующие представители 11-17-го ряда отклоняются от общего хода изменений учитываемой величины: ЕАО ЭО Е20,ОР * е, ОВ, ЭО, ЕАО / Li быть в C N 71.5 71.5 51 24 1 На Мг А1 С1 П С Ки 49.5 72 67 55 36 16 −4.5 К Си Са ЗН СК Джорджия Ти Ге В Качестве СГ ГП Мп ВГ 43 20 76 41.5 75 43 56 33 37 22 23 7 13? Дело в том, что при перемещении каждого ряда аналогов сверху вниз наблюдается регулярное ослабление кислоты и увеличение основности высших гидроксидов.
На это указывают и химические свойства гидроксидов. Людмила Фирмаль
Напротив, CuOH является более слабым основанием, чем NaOH (и LiOH), и гидроксид магния является только основным свойством, но Zn (OH) 2 амфотерен[и по своим свойствам приближается к кислотным свойствам Be (OH) h), Ga (OH) 3 выражен сильнее, чем A1 (OH) 3. В случае гидроксида H2O05 элементов IV группы имеются значения следующих констант диссоциации: Е С Си Оэ Kt 4 * 10 ″» ’3-U» 1 * MO «’Kt b» IG11 2-KG1 ′ 2.10″ » По величине Ki Германий «прыгает» позади Silicon. In группа V, прочность фосфорной и мышьяковой кислот примерно одинакова. Это видно из сравнения их диссоциативных синергетических факторов. Т Тыс. КДж N5P04 7.10 «’6 * 10» * 4 * ю «14 Н «Азо»6 * 10″ «1-10» «3-10» » Что касается серной кислоты (/C2 = 1 * 10-2) и Селена (/C2 = 1•10-2), то то же самое происходит с VI, но хром (/C2 = 3 * 10-7) слабее их.
Аналогично, группы VII, хлорной кислоты и бромата близки по силе, и йодистая кислота является относительно слабой(/ с = 3-10-2).Все эти экспериментальные данные находятся в полном согласии с основными положениями принципа электронного аналога (VI§ 4). 「-」」 Добавь I) температура, которая может быть достигнута при сжигании различных элементов с кислородом, схематично показана в RNS. XV-40.As как видите, он самый большой в цирконии и бериллии. Имеется профессиональный справочник по оксидам металлов*. * Функо химические свойства «оксид«.Эд. Г., В. Сайсонова, М. «Металлурги», 19 Мая. 455 секунд.
2) из рисунка XV-39 видна характерная особенность изменения теплоты образования оксидов в периодической системе: по мере увеличения числа периодов происходит максимальный непрерывный переход от одновалентных (Li) к двухвалентным (Be, Mg, Ca) и трехвалентным (Y, La) элементам. Эта особенность явно связана с соотношением объемов. На их важность указывают также диаметрально противоположные изменения теплоты образования оксидов Е20 (например, Li20) и Еог (COj и др.) с увеличением радиуса е (рисунок XV-39).Действительно, что делать, если мы рассматриваем оба оксиды как производные, соответствующие типам AB? (То есть OE2 n E02), можно видеть, что в обоих случаях теплота образования изменяется одинаково.
Увеличение с увеличением отношения/?д //?в: А О2-С4 * Си4 * ТУ4 ′ Zf4 * Ли б * н * к * РБ * О2- * А / * Б•*…….. 1.69 1.34 0.99 0.89 0.11 0.30 0.49 0.66 Теплота образования (единицы эмэ), ккал…….. 71.5 49.5 43 39.5 24 55 56 65.5 3) интересным материалом для оценки роли объемного соотношения служит сравнение теплоты образования соединений различных элементов с металлоидами, такими как хлор и кислород, которые близки по активности. Поскольку первый атом единичен, а второй атом имеет 2 * валентность, относительное число полуметаллического атома в хлориде в 2 раза больше, чем у соответствующего оксида. Эта ситуация влияет на производимое тепло, поэтому мы можем видеть из приведенного сравнения соотношения хлоридов (на г-экв).
Уменьшите радиус E. увеличьте валентность E. * Ли быть внутри 1.37 0.78 0.68 0.27 Na Mg Al Si 1.98 1.07 0.84 0.77 В Ка-Ка Тл 2.42 1.26 0.95 0.86 РБ-Старший. 2.67 1.40 1.03 0.89 В CS Ба Ла привет 2.80 1.54 (.)19 0.90 И соответствующий оксид (хлорид / океан): когда каждый ряд аналога движется вверх, то есть чем меньше радиус Е, тем меньше координационное число оксида, что приводит к большему сдвигу теплоты formation. It наблюдается также при движении слева направо вдоль ряда одинаково составленных электронов, в той же, но еще более острой степени, и одновременно с уменьшением радиуса, увеличением валентности occurs.
So, объемное отношение выражается в том, что при увеличении заряда и уменьшении положительного нерадиуса тепло образования больших величин передается от хлорида к оксиду. 4) аналогично изменяется соотношение тепла образования сульфида / оксида: 20 30 Вт 50 60 аттомов Рисунок XV-40.Температура сгорания элемента в кислороде (°к•10*). И затем 0.75 Что? 0,9 Дж К 1.19- С » 1.05 Rb 1.06 Это было. 9.72 Это 0.39 М » 0.53 СР 0.77 ла и Б 80 мне 0.19 Аль 0.43 0.66 17 Б. В. Некрасов
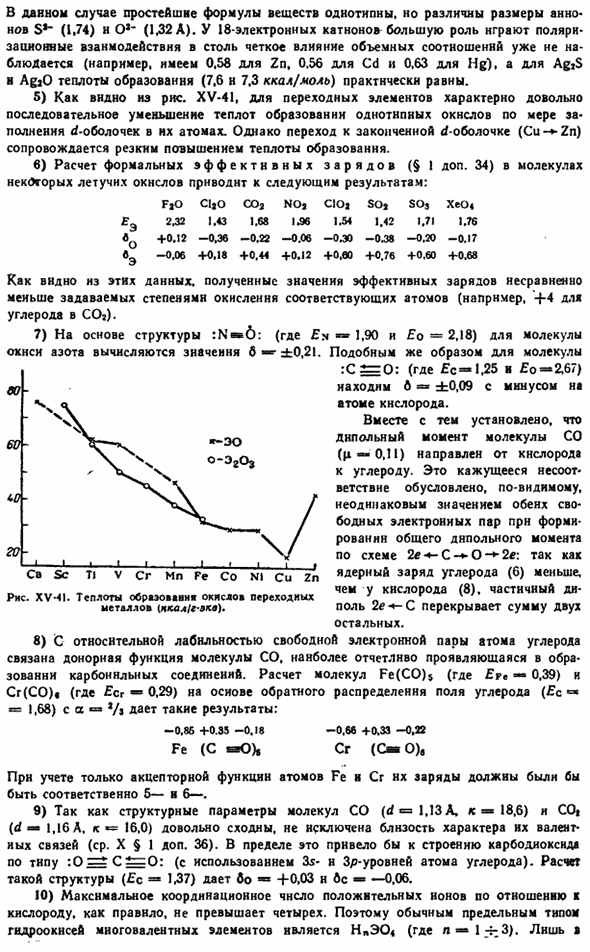
В этом случае самая простая формула для вещества того же типа, но размер аниона S * — (1.74) n O1-(1.32 A) отличается. В 18-электронном Катоне взаимодействие поляризуемости не играет существенной роли в столь явном эффекте объемного соотношения (например, в Zn имеется 0,58, в Cd-0,56, в Hg-0,63). В случае AgjS и AgaO результирующая теплота (7,6 Н 7,3 ккал / моль) практически равна. 5) переходный элемент XV-41, Как видно на рисунке, характеризуется достаточно последовательным снижением теплоты образования такого же типа оксида, как и d-оболочка, заполненная атомами.
Однако переход к полной d оболочке (Cu- * — Zn) сопровождается резким увеличением теплоты образования. в) расчет официального эффективного заряда (§ I добавление 34) в молекулах некоторых летучих оксидов приводит к следующим результатам: FjO CljOC02NOj ClOj так * Сос Хео«ј э’2.32 1.43 1.68 1.96 1.54 1.42 1.71 1.7 $ «0 +0.12 −0.36 −0.22 −0.06 −0.30 −0.38 −0.20 −0.176 Э-0.06 + 0.18 +0.44 +0.12 +0.60 +0.76 +0.60 +0.68 Как видно из этих данных, величина полученного эффективного заряда значительно меньше соответствующего атома, указанного в состоянии окисления (например,+4 углерода СОА).
7) на основе структуры: N » 6: (здесь£n 1,90 и£o-2,18) для молекулы оксида азота вычисляется значение 6 «±0,21.Аналогично и о молекулах: При C = 0: (£c-1.25 и£o = » 2.67) найти B =«±0.09, где в атоме кислорода имеется минус. В то же время, длительный момент молекулы со(z—0.I) был установлен переход от кислорода к углероду. Это кажущееся несоответствие, по-видимому, связано с неравным значением обеих пар свободных электронов для образования общего дипольного момента по схеме 2eCO2e. C перекрывается с другими 2 итогами.
8) относительная нестабильность свободных электронных пар атомов углерода связана с донорной функцией молекул со. Наиболее ярко проявляется образование карбонильных соединений.■Расчет обратного распределения полей углерода (£c «= 1.68) и молекулярных Fe (CO)$(£p»-0.39) и Cr (CO) «(£02 0) на основе a » V дает следующие результаты: −0.86 +0.35 −0.18 −0.66 + 0.33 −0.22 Fe (C nO), Cr (CaO)、 Если рассматривать только акцепторные функции атомов Fe и Cr, то их заряды должны быть 5 —и 6-соответственно.
9) молекулы CO (<*«=1.13 A. K= 18.6) и COt(d = » 1.16 A. поскольку структурные параметры (-16.0) очень близки, не исключено сходство свойств их валентных связей(ср. X§ 1 доп. 36). на пределе это приводит к структуре карбодиозы по типу: 0 = C = 0: (с использованием 3S и 3p уровней атомов углерода).Расчет такой структуры (£c = * 1.37) составит 6°+ 0.03 n 6 s—0.06. 10) максимальное число положительных неоннонных регулировок по кислороду, как правило, не превышает 4.So, обычным предельным типом гидроксида поливалентного элемента является NPEO » (n-14 ^ 3).Только Рисунок Xv-41.Тепло переходного металла оксида олеаеония (nkalTs-zkv).
Очень редко координатный слой кислорода поднимается до 6.К ним относятся главным образом такие соединения, как H $ | TeOb] n HJIOj. Возможность их существования, вероятно, связана с относительно высокой деформируемостью соответствующего комплексообразователя (характеризующегося 18-электронными внешними оболочками), обладающего достаточно большим их объемом. Сочетание обонятельных факторов делает тетраэдрическое расположение ЭО » неустойчивым, пирамидальным.
Это позволяет экранировать комплексообразующий агент и дополнительно связывать ионы О, а конечное образование соответствует координационному числу конфигурации 6-Гранного тела. Поскольку заряд не-OH меньше, чем заряд не-O* -, координационное число 6 уже встречается чаще и заметнее по отношению к нейтральным молекулам H * 0 (в гидратированных ионах). II) помимо структурного типа ROH (см. Рисунок V-13) и химических свойств R, эффективный атомный заряд гидроксида зависит от характера распределения силового поля(§ I дополнительно
33) и кислорода центрального элемента. Этот символ предварительно очерчен следующим образом: так как £m < £n <увеличение положительного заряда водорода из множества ЭБУ, заданного осевыми характеристиками соединения Х-О-на, Х-О-Х, Х-О-ки. Показано обратное распределение поля гидрокси oxygen. In поддерживая подобное распределение поля центрального элемента, мы говорим об общем повышении кислотности во многих структурных типах. (Хо) 4Э(х0)С30 (Хо), ЭО, NOEE、 Соответствующее значение индекса мобильности (a) неизвестно.
Если взять ВС произвольно, как насыщенный углеводород, то длина отдельных молекул высоководных оксидов элементов 3-го цикла будет иметь следующий результат: 1 1 1 1 1 1 2 1 1 1 I 1 2 1 2 Хо. Вася (Хо) ИМГ (А)»А1 (Хо) 4slhojasio (но) ЗРО (HOJfcSOj помочь)、 0.38 0.56 0J0 0.83 1.02 J. I7 ′ 1.53 1.Ю +0.23 +0.27 +0.29 + 0LZ+0.35 +0.37 +0.42 +0.47 −1.01 −0.94 −0.78 −0.87 −0.48 −0.48 −0.34 ——0.71 −0.80 −0.36 −0.13 +0.78 + 1.34 + 1.82 +1.80 +1.35 + 1.32 +0.80 +0.26 Как видно из этих данных, кислотно-основные свойства гидроксидов могут быть очень четко коррелированы с эффективным зарядом атомов водорода и кислорода. Я 12) аналогичный расчет молекулы HONOj дает следующий эффективный заряд:+0.48 (Н). −0.32(О»), −0.11(О*). — ф0. 06(Н).
Судя по значениям 6n и bo. Азотная кислота должна быть сильнее хлорной кислоты, но на самом деле она слабее. Это очевидное противоречие заключается в том, что фактическая форма диссоциации азотной кислоты не HNO$, а H $ NO » (добавлено IX $ 3.56).Последний расчет (£K » 1.76) дает+0.44 (H). −0.41 (о.). −0.26 (ОА). +0,17 (N), то есть азотная кислота находится рядом с серной кислотой.
13) с последующим уточнением расчета гидроксидов было показано, что правильнее брать»/»для кислорода половой железы, а для центрального элемента-а-1.Рассчитаны экспериментальные показатели кислотности различных составов в структуре гидроксидов. 14) образование пероксидных производных за короткое время характерно только для некоторых elements. In большой период Члены подгруппы слева от другой группы более характерным, чем члены подгруппы справа от них. Увеличение стабильности пероксида в подгруппе обычно наблюдается сверху вниз.
Смотрите также:
| Водородные соединения | Соли кислородных кислот |
| Галоидные соединения | Естественная радиоактивность |

