Оглавление:






































Комплексные соединения
- Комплексное соединение. Обладая материалом предыдущих параграфов и разделов, можно провести детальный обзор структуры и свойств соединения, который является более сложным, чем это было сделано ранее(IX§ 2).Основа для современной интерпретации этой обширной и важной части генералогии была заложена довольно давно (Вернер, 1893), система комплексных соединений была разработана очень подробно, но их свойства до сих пор не изучены в полной мере. >
- 1, компонент Внутренней Сферы комплексного соединения, непосредственно связанного с центральным атомом, называется лигандом (независимо от типа связи).То, что соединено в комплексе, называется надстройкой. Первые понятия более распространены и используются чаще, так как нет необходимости уточнять природу соединения.. Из обычных отрицательных ионов эта тенденция наименее характерна для C107.
4 поскольку различные центральные атомы имеют различные тенденции к комплексированию, различные адденденты также имеют различные тенденции к проникновению во Внутреннюю Сферу. Людмила Фирмаль
Отдельные лиганды (общее обозначение-L) занимают разное количество координирующих частей внутреннего пространства. Это отмечается, когда речь заходит об их различном дентине. Поэтому известны такие лиганды, как мононатрий (L1) и ЦИС (L2).Вмятина переменная. Например, найти-Ион «, как правило, monosodicate, но в некоторых случаях bentotene.5-7. Если сначала рассмотреть ацильные молекулы (то есть соединения, содержащие комплексные анионы), то, например, как видно, сходство способа образования между ними и некоторыми оксигенатами поразительно, это видно из следующего сравнения:: H20 + S03 = H2 [S04] 2CH1 + PtCl2 = H2 [PtCl4] K20-f S03 = K2 [S04] 2KCI + PtCl2 = K2 [PtCl4]
Поэтому кислородную кислоту и ее соли можно считать частным случаем комплексов этого типа. type. In помимо отрицательных ионов кислорода, хлора и других элементов, кислотные радикалы, такие как CN», N07, N07 и COS», также могут выступать в качестве аддуктов при образовании кислотных комплексов. сои. Соф и соавт. Координационное число пример простого соединения пример сложного соединения координационное число пример простого соединения пример сложного соединения 1 ClF-5 PF5 MfThFj] 2, в MJHF.] 6 СФ, м3 [Алф]: м, fsif по.]; М (Сбф、) 3 BF, MfMgF.] 7 IF, M, INbF7] 4 SiF4 MJFeFJ; M (BF»] 8-M4lSnF.]; М3 [Таф、)
С другой стороны, очень многие элементы становятся комплексообразующими агентами, часто в различных валентных состояниях. Поэтому количество известных ацидоидных комплексов очень велико, а их состав весьма разнообразен. Например, мы можем сказать из приведенного выше сравнения относительно фторида (M является одновалентным металлом). В дополнение к противоположно заряженным ионам комплексообразователи притягиваются к молекулам воды-таким как H20.
В этом случае комплексообразователь сохраняет тот же заряд, что и исходный заряд, поскольку комплексообразователь нейтрален. Комплексы с нейтральными аддуктами характеризуются главным образом наличием комплексных катионов, так как они обычно являются катионами. Некоторые структурные типы часто влияют на свойства соединения более сложные, чем химические свойства его составных частей. Сам этот тип характеризуется главным образом координационным числом комплексообразующих агентов.
Последнее, вообще говоря, является переменным и зависит также от природы и добавления самого комплексообразователя, а также от условий, при которых образуется комплекс (главным образом от концентрации и температуры составляющих его частей).Например, в случае комплексного фторида циркония получается продукт следующего состава: M [ZrF8] M2 [ZrF6] M3 [ZrF7] M4 [ZrF8]] Однако опыт показывает, что многие комплексообразователи имеют специфический тип структуры, который предпочтительно формировать в различных добавках и различных концентрациях.
Это дает основание говорить таким комплексообразующим агентам о характерных (при нормальных условиях) числах корректировки. Чтобы определить координационное число центрального атома того или иного соединения, необходимо сначала получить результаты химического анализа. Например, в продукте взаимодействия серы и фтора, зная, что для каждого из атомов имеется 6 химически связанных атомов F, мы присваиваем соединению формулу SF6 и говорим, что координационное число серы в нем равно 6.
Аналогично, 4 проанализировали натриевую соль фторсилициловой кислоты и обнаружили наличие 2 атомов Na и 6 атомов F на атом Si, поэтому исходя из общих соображений по структуре комплекса, мы присваиваем соединению формулу Na2 [SiFe]координационного числа 6 кремния. Эти и подобные им корректировочные числа, установленные только на основании результатов химического анализа, можно назвать анализом. Однако одних только результатов химического анализа пока недостаточно для установления истинной формулы вещества, в результате чего координационный номер центрального атома, входящего в его состав, не установлен.
При изучении простых соединений определение молекулярной массы дает необходимую дополнительную информацию (I§ 6).Например, плотность паров всех простых фторидов, перечисленных в таблице выше, указывает на то, что их простейшая формула применяется одновременно. Таким образом, аналитическое координационное число центрального атома(рассматриваемого соединения) также совпадает с истинным. Для сложных соединений измерение молекулярной массы не всегда возможно.
С другой стороны, полученные результаты показывают, что из-за наличия в молекуле по меньшей мере 3 различных элементов значение ее структуры и, соответственно, истинного координационного числа комплексообразователя также неясно indicated. In твердое состояние, как правило, можно установить с помощью рентгеновского снимка crystallography. In таким образом, был доказан анализ многих комплексных соединений и совпадение истинных координационных чисел.® — 10
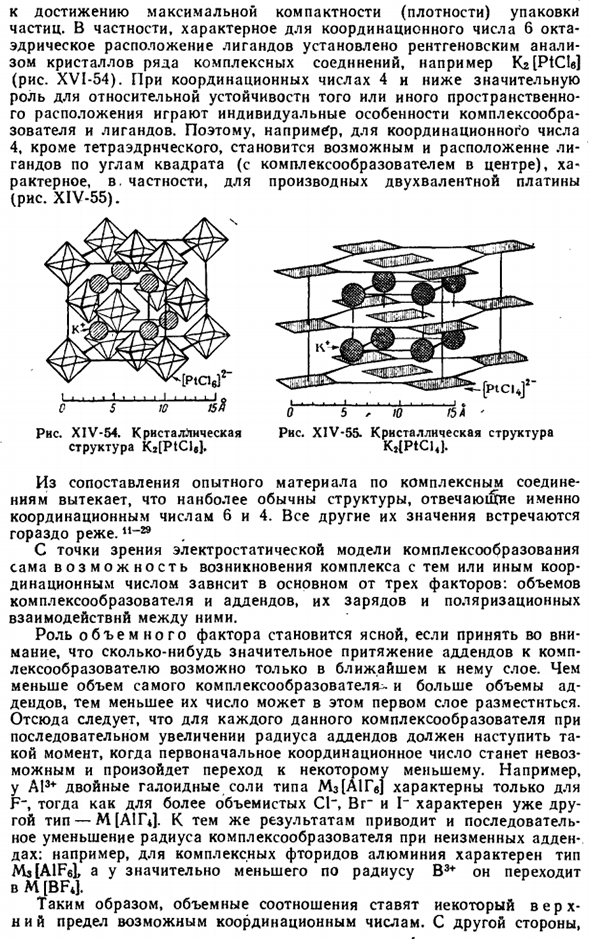
Пространственная структура внутренней сферы комплекса во многом определяется количеством регулировок и отсосов Достигается максимальная компактность (плотность) частиц packaging. In в частности, методом рентгеноструктурного анализа кристаллов многих комплексных соединений, таких как Kr [PtCU], были установлены 6 октаэдрических массивов лигандов, характерных для координационного числа (рис. XVI-54).Когда координационное число равно 4 или меньше, индивидуальные характеристики комплексообразующего агента и лиганда играют важную роль в относительной стабильности конкретного пространственного объекта. arrangement. So например, в случае координационного числа 4,
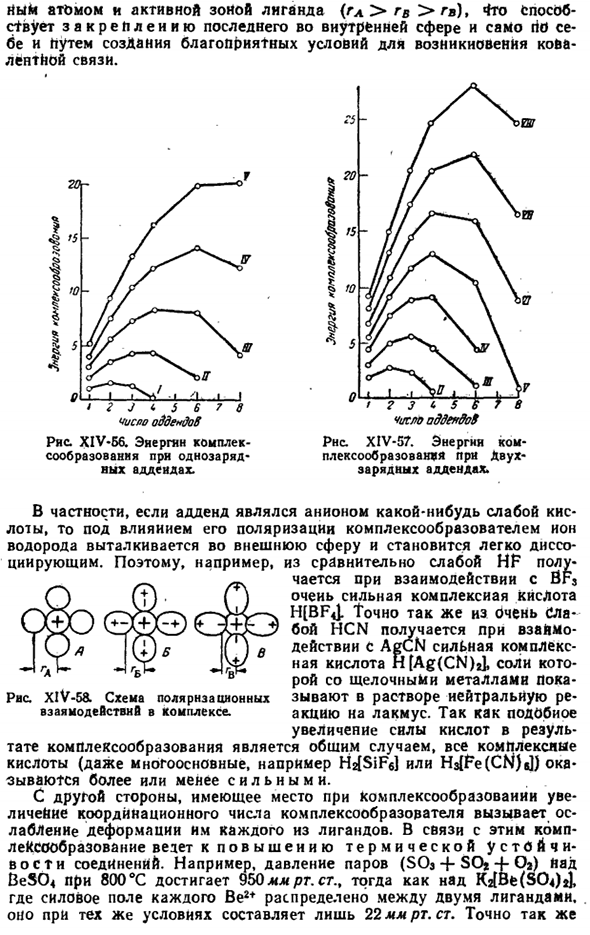
Помимо тетраэдра, можно будет разместить лиганд в углу квадрата (включая комплексообразователь в центре).в частности, для производных двухвалентной платины(рис. XIV-55). О, б, р $ л’ Диаграмма XIV-55.Кристаллическая структура K, (PtCl4J. I » ■I I 1 I 1■I I I I I I I I) 0 В 5 V15Я Рисунок XIV-54.Кристаллическая структура Kj [PtCl / J. Сравнение экспериментальных материалов с комплексными соединениями позволяет предположить, что наиболее распространенными структурами являются структуры, соответствующие координационным числам 6 и 4.
Все остальные значения менее распространены. С точки зрения электростатической модели комплексообразования, возможность образования комплекса с тем или иным координационным числом зависит в первую очередь от 3 факторов: количества комплексообразующих агентов и аддуктов, их заряда и поляризационного взаимодействия между ними. Роль объемного фактора становится ясной, если учесть, что большое притяжение аддукта к комплексообразующему агенту возможно только в ближайших к нему слоях.
Чем меньше объем самого комплексообразователя, тем больше объем надстройки, тем меньше она может вместить в себя в этом первом layer. As в результате для каждого конкретного комплексообразователя радиус добавлений непрерывно увеличивается, что делает невозможным начальное число корректировок, и должен наступить момент, когда произойдет переход к определенному малому числу. Например, A! В 3 * мг [A1Gb]тип соединения Галогенидной соли характерен только для F», но более громоздкий C1″, Br-и I » уже характерен другой тип-M [A1G4].
Таким же результатом является непрерывное уменьшение радиуса комплексообразователей с постоянными добавками: например, тип MalAlFei является свойством комплексного фторида алюминия, и если радиус B3 * значительно меньше, то он переходит в M[BFJ. Так, в отношении объема существует верхний предел количества возможных корректировок. С другой стороны、 По мере увеличения радиуса действия силы они становятся слабее, что также влияет на растягивающее усилие между комплексообразователем и аддуктом.
Таким образом, увеличение радиуса комплексообразователя влияет на координационное число одновременно в 2 directions. It это вклад ускорения увеличения за счет увеличения координационной способности и уменьшения за счет ослабления силового поля. В зависимости от того, какое из этих двух влияний является доминирующим, число реально наблюдаемых конфигураций увеличивается или уменьшается с увеличением радиуса комплексообразующего агента, и центральный Ион теряет свою способность к комплексообразованию (с этими добавками).
Это наблюдается, например, в серии B3 * — A13 + — Sc3 + — Y3 * — La3.Для Бора характерно соединение фторида М-типа [BF4], для алюминия и скандия-соединение МЗ-типа [ERV], а для более громоздких Y3 и La3 ^ » образование сложного фторида становится нехарактерным. Увеличение числа координаций сопровождается увеличением расстояния между комплексообразователем и лигандом. Например, в сериях 1.63 (A1FS), 1.69 (A1FJ) и 1.81 A (AlFj〜) значение d (AIF) будет увеличиваться.
С другой стороны, увеличение валентности центрального атома с постоянным числом координат сопровождается уменьшением этого расстояния. Примерами являются ионы[Sbbr] 3″и[SbBr$}», где d (CbBr) равно 2.80 и 2.56 A. Поскольку каждый ион стремится привлечь как можно больше противоположно заряженных ионов, структура ацидоидного комплекса должна соответствовать максимально допустимому количеству конфигураций по объемному соотношению. Однако на практике многие случаи не достигаются, потому что адденды отталкивают друг друга, и чем мощнее адденды, тем больше они накапливаются во внутреннем пространстве. sphere.
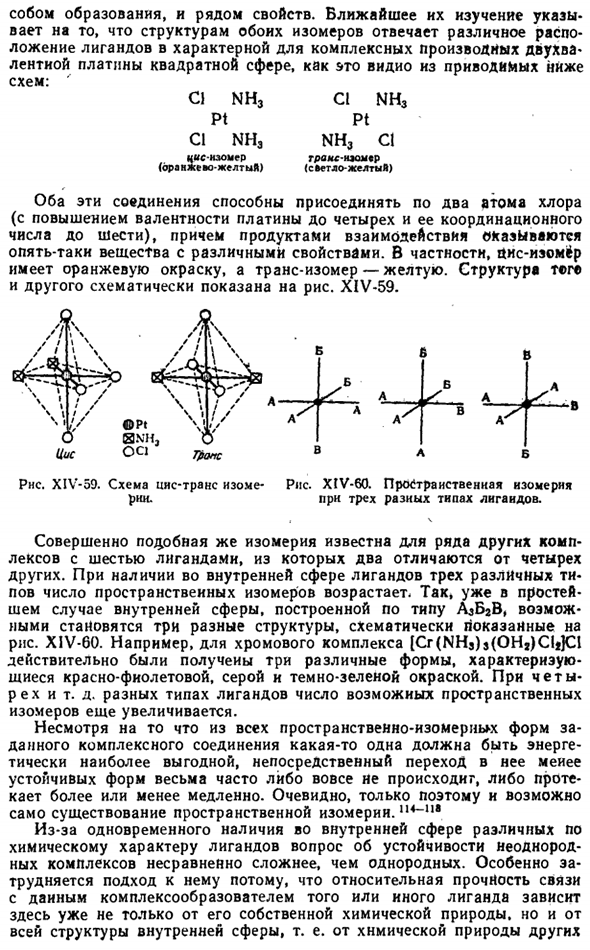
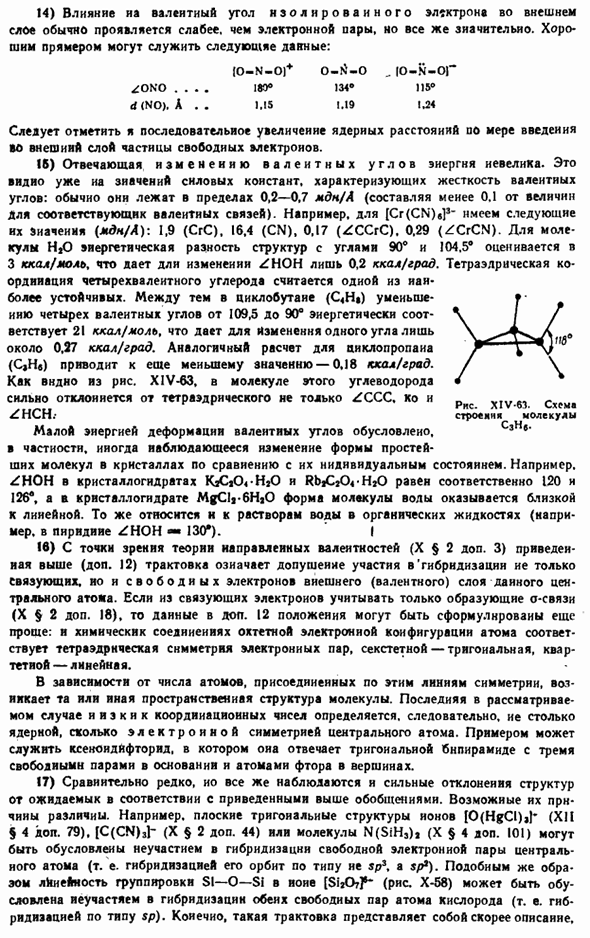
As показано, что в электростатическом расчете координационное число, соответствующее наибольшей энергии комплексообразования, зависит от заряда как комплексообразователя, так и аддукта. XIV-56 показывает характер этой зависимости от добавления одного заряда при различных комплексообразующих титрах. Например, для 4-валентного центрального атома координационное число 6 должно быть наибольшим stable. As заряд аддуктов увеличивается, их взаимная сила отталкивания больше, чем притяжение к центральному atom. So как видно из рисунка, наиболее устойчивое число корректировок, соответствующих его валентности, соответственно уменьшается. XIV-57.
Несмотря на то, что для упрощения расчетов радиусы центральных ионов и аддуктов равны, а другие их свойства (структура электронной оболочки, поляризуемость) не учитываются, результаты этих упрощенных расчетов хорошо согласуются с экспериментально определенными коэффициентами большинства комплексообразователей. Общий вывод, который можно сделать из приведенных выше результатов, заключается в том, что увеличение координационного числа сопровождается увеличением заряда Центрального Иона и уменьшением заряда аддукта. Роль поляризации при комплексообразовании очень велика.
На рис. XIV-58 схематично показаны 3 основных случая взаимодействия комплексообразователей и лигандов. Без поляризации (а), только для лигандов, без поляризации (5) и без поляризации (Б) Центрального atom. As как видно из рисунка, увеличение поляризации сопровождается непрерывным уменьшением расстояния между расстояниями* 14 Б, В, Некрасов Активная зона атомов и lnganda (ch> GV + Th метод Она помогает, интегрируя последнюю во внутреннюю сферу, удаляя саму себя и создавая благоприятные условия для возникновения ковалентных связей. pddendo нет. Тисло-ода-дов США XIV-56.Энергетическое комплексирование с одновалентными адеидами. РНС. XIV-57. 2.
Энергия образования комплекса путем добавления заряда. В частности, если аддукт представляет собой анион слабой кислоты, то под действием поляризации комплексообразователем ионы водорода выталкиваются в экзосферу и легко dissociate. So например, из относительно слабого HF, взаимодействующего с Br3, мы получаем очень сильную комплексную кислоту HIBF. Аналогично, из очень слабого HCN соль со щелочным металлом показана в растворе сильной комплексной кислоты H [Ag (CN) d, которая получается в реакции с AgdN нейтральной реакцией на лакмус.
Поскольку такое увеличение прочности кислоты в результате комплексообразования является общим случаем, все комплексные кислоты(например, Hjsife или Нз/?Даже в многоосновном, таком как Е (СЫ) в], Сила несколько. С другой стороны, увеличение координационного числа комплексообразующего агента при комплексообразовании вызывает ослабление деформации каждого из них. ligand. In в связи с этим комплексообразование приводит к повышению термической стабильности соединения.
Например, давление пара превышает Бесо *при 800°с (С03-так ф * -ф ОЖ) достигает 950 мм рт. Искусство. С другой стороны, в K ^ BfefSO^*) силовые пути для каждого Be2t распределены между 2 лигандами. При тех же условиях она составляет всего 22 мм Hg. Art. In точно так же Рисунок XIV-58.Схематичный вид поляризационной картины композита. Давление хлора на AuCl3(результат разложения по реакции AuCl3= AuCl + CU с увеличением координационного числа Au3 +до 4),
Как видно из сравнения температуры (°С), выше которой давление хлора достигает 1 атм, значительно снижается. AuCla Ag (AuCI j J K [AuCI4J Cs(AuCI4J 256294415 4S6 Эти же данные показывают влияние на термостабильность кислотно-кислотного комплекса природы катионов, присутствующих в экзосфере. Чем слабее его поляризация, тем выше стабильность. Из вышеизложенного, а также из снижения температуры видно, что увеличение координационного числа действует на термическую стабильность соединения. Из-за этого для обычных производных часто возможно получение комплексных соединений элементов с неустойчивым валентным состоянием.
Например, PbSC медленно разлагается даже при комнатной температуре, но соли Hj [PbCle]и слабо поляризованные катионы могут выдерживать деградацию до 200°C без деградации. Добавление нейтральных молекул к катионам элемента не изменяет заряда, но резко увеличивает его объем. Например, если радиус Ni2 +равен 0,78 а, то катион соединения[Ni (NH3) eP имеет радиус 2,58 А. При таком увеличении объема поляризационный эффект катиона очень ослабляется, а электролитическая диссоциация полученного из него гидроксида (основного типа) делает его очень облегченным. Поэтому все основания с комплексными катионами будут более или менее прочными (исключение в случае NHiOfci обусловлено особыми свойствами ионов H).
С другой стороны, ослабление поляризационного эффекта катойи влияет на стабильность ее соединений. Например, если Ctth не может существовать, потому что деформация I-Иона Cu2 *слишком сильна, сложный аммиак[CufNHsJJh] устраняет причину этой нестабильности. Аналогично, [Co(NH3) e] 3 * Соль более стабильна, чем, например, Co3 *соль. Таким образом, в целом комплексообразование с нейтральным аддуктом повышает стабильность compound. In в частности, именно по этой причине многие соли (например, сульфиты многих металлов), которые не могут быть отделены в безводном состоянии, оказались относительно стабильными в виде кристаллогидратов.
Поскольку нейтральные добавленные частицы не имеют избыточных зарядов, притяжение к комплексообразователю обусловлено поляризационным взаимодействием (на котором ковалентные связи могут несколько перекрываться). в то же время сила взаимного отталкивания нейтрального аддукта очень мала по сравнению с силой отталкивания, возникающей между аналогичными заряженными ионами, и в большинстве случаев она перекрывается взаимным притяжением, вероятно, из-за дисперсионного взаимодействия(III§ 7).Из-за этой ситуации стабильность комплекса с нейтральным аддуктом часто очень важна(например, из[Co (NH3) e] Cl3 аммиак начинает разлагаться только при 215°C).
С другой стороны, взаимного отталкивания нет, поэтому в гравитационной области комплексообразователей может накапливаться гораздо больше аддуктов, чем в случае ацидоида complex. As в результате A1I3-20NH3, Sn (NO3)j-20HtO hi. продукты аддукта, такие как il, могут быть сформированы. Такое большое количество аналитических корректировок не может соответствовать истинному значению, поскольку объемное соотношение, ограничивающее заполнение первой сферы, близкой к сложной, остается действительным даже при использовании нейтральной надстройки. Однако размещение избыточного числа на число, разрешенное в этих отношениях, возможно, не произошло в ионном добавлении.
Ионы во Внутренней Сфере отталкивают одноименный Ион, но нейтральные молекулы поляризуются вблизи комплексообразователя свободным концом диполя, и дисперсионная сила притягивает подобные молекулы. Таким образом, образование двойного слоя вблизи центрального атома ионного аддукта, которое невозможно при одном и том же заряженном ионном аддукте, становится возможным при комплексе с нейтралью adduct. At при этом последний, в отличие от ионного аддукта, может связываться не только с катионом, но и с анионами первых солей, которые индивидуально заполняют индивидуальное оставшееся свободное пространство кристаллической решетки комплекса, выполняя при этом роль цемента lattice.
So в общем случае пространственное распределение сложения нейтралей может быть очень сложным (особенно в случае большого числа сложений).Этот результат является»фракционным» выражением аммиака и кристаллических гидратов, иногда обнаруживаемых при анализе, таких как CuOg-Z ’/ zMNz, CdS04-273H20 nt. С. 62-79 Вышеуказанные комплексные соединения можно назвать гомогенными, так как все лиганды идентичны. Гораздо более неравномерным является комплекс, характеризующийся одновременным присутствием 2 и более различных лигандов во Внутренней Сфере.
Очевидно, что замена ионного аддукта нейтральным или наоборот должна влиять на заряд комплексных ионов в целом. Например, начиная с[Pt (NH3> e] 4+) и последовательно заменяя в нем молекулу аммиака на C1-ионы, получаем следующий набор комплексных катионов: Iptcnw * [Pt (NH3) 6Clp [Pt (NH3)<Cl2P [Pt (NH3)3CI3] * При замене другого аммиака на C1-образуется нейтральный комплекс[Pt (NH3)2Cl4].Наконец, когда последние 2 молекулы аммиака обмениваются, мы получаем комплексные анионы [Pt (NH3) CI5] «и PtCl6] 2 -.
Замещение во внутренней области некоторых других аддуктов часто сопровождается явным изменением окраски комплекса, как это видно из следующего набора хлоридных солей, например, катионных[CrAvR, A-NH3 или H20. [Cr (NH3) eP [Cr <Mg3) 5OH2P [Cr(Mg3) 4 (OH2)2p Желтый оранжевый оранжевый красный [SHGZZYONZHR * [CrfNHjWOHJ]]]*. [СГ (OH2)6р- Светло-красный фиолетовый красновато-фиолетовый Композиция [Cr (NH3) (OH2) 5] соединения C13 не была получена. Судя по изменению цвета, он должен был быть красно-фиолетовым. Кроме фиолетовых соединений, соответствующих экспериментальному CrCb-bHrO, известно более 2 кристаллических гидратов одного и того же состава-сине-зеленый и зеленый.
Используя эти 3 вещества в качестве примера、 Мы сталкиваемся с изомерией комплексных соединений, то есть наличием между ними структур, идентичных по составу, но отличающихся по структуре (X§ 2). Проблема природы изомерии гидрата CrQU может быть решена на основе различных соотношений вновь приготовленного раствора к AgN03.Под действием этого реагента фиолетовые соединения осаждают все 3 Иона хлора сразу, 2 из них сине-зеленые, и только 1 из них зеленый.
Исходя из таких экспериментальных результатов, принимая во внимание характерное число координационных чисел B Cr3*, структуру рассматриваемого изомера следует отнести к кристаллогидрату. [Cr (OH2) b] C1z [Cr (OH2)5C1] C12•H20 [Cr (OH2)4C12] C1•2H20 Фиолетовый синий зеленый Вышеприведенная формула также хорошо совпадает с тем, что при стоянии на серной кислоте в эксикаторе фиолетовый кристаллогидрат вообще не обезвоживается, а зеленый цвет отсекает только 2 молекулы воды. Как и при рассматриваемой изомерии, она известна для многих соединений, зависящих от различного расположения молекул воды (гидратационная изомерия).
Рядом с ней наблюдается ионизационная изомерия, которая связана с различной легкостью диссоциации ионов из внутренней и внешней сфер. Например, для соединения Co (Br) S04-5NH3 известны 2 изомера красно-фиолетового и красного цветов. Первый свежеприготовленный раствор из них не дает осадка с ионами Ag, но дает его со 2-м Ионом Ba * * — обратное тоже аналогично. Таким образом, изомерам соответствует следующая структура. [Co (NH3)5Br] S04 [Co (NH3)5S04] Br Красный, фиолетовый, красный.
В некоторых единичных случаях наблюдается изомерия связи, так как характер связывания Координационной группы с центральным атомом различен. Типичным примером является добавление группы N02 через кислород (комплекс азотистой кислоты) или азот (Нитрокомплекс).Нитрит комплекс является неустойчивым и самопроизвольно переходил по схеме[3 (NH3), который 50N0P + — ^ [3(Нехи)5N02p +(спонтанное сотрудничество, резус, 1р) выполняется достаточно быстро. Для соединений с 2 (или более) комплексными ионами в молекуле возможна координационная изомерия, связанная с различным распределением лиганда между обоими комплексообразователями.
Примерами изомеров этого типа являются соединения: [CoQftW [Cr (CN) 6]и[Cr (NH3) e] [Co (CN) 6] [Pt (NH3)4] [PtCl6]и [Pt (NH3)4Cl2] [PtCl4] Второй пример интересен тем, что наличие координационной изомерии связано с изменением валентности комплексообразователей обоих комплексных ионов. м -, общ Несколько отличается от только что рассмотренного случая случай противоположного пола из-за различного пространственного расположения лигандов неоднородных комплексов внутри одной и той же Внутренней Сферы.
В основном это относится к так называемой цис-транс гетеросексуальности. Например, соединения состава [Pt (NH3) 2Cl2]могут существовать в 2 формах.1 оранжево-желтый, другой 1 светло-желтый. Обе формы также отличаются друг от друга. Образование, и количество свойств. Их ближайшая работа показывает, что структура обоих изомеров соответствует различному расположению лигандов квадратных сфер, характерному для комплексных производных двухфазной платины, как видно из следующей схемы. CI NH3 Pt CI NH3 StfCIUOMeP: evo желтый) CI NH3 Pt NH3 CI РПФЛ * £HJG * » п (Светло-желтый)
Оба эти соединения могут связывать 2 атома хлора (валентность платины увеличивается до 4, а ее координационное число увеличивается до 6), и снова вступают во взаимодействие вещества различной природы products. In в частности, иономер ais является оранжевым, а транс-изомер-желтым. m и другая структура показаны на рисунке. XIV-59. Один М \ / «\ ’!’1 \/! \ \ / / Мой\ »» \ \ B & B \ » / \ Я / \ «’/\Я / / В. И. / / В. И. // ©Пт a. подробнее о NH, ci б СНГ. Престол. РНС. XIV-59.ЦИС-транзисомная схема XIV-60.Космический гетеросексуал.
Существует 3 типа лигандов. Полностью подобная изомерия известна для многих других комплексов С 6 лигандами, 2 из которых отличаются от остальных 4.Если во внутренней сфере имеется 3 лиганда, то число пространственных изомеров increases. So, в простейшем случае внутренних сфер, построенных по типу A3B2V, возможны 3 различные структуры. XIV-60.Например, в случае комплекса хрома[Cr (NH3) 3(OH.) Clj) Cl фактически были получены 3 различные формы, характеризующиеся красно-фиолетовым, серым и темно-зеленым цветом.
Для различных типов лигандов, таких как 4 типа, число возможных пространственных изомеров все еще увеличивается. Несмотря на то, что из всех пространственных изомеров данного комплексного соединения, 1 из которых должен быть наиболее энергетически выгодным, прямой переход к реакции стабильного типа вообще не происходит или протекает несколько медленно. Очевидно, именно поэтому возможно присутствие пространства. 1/4-ПВ В связи с одновременным присутствием во Внутренней Сфере лигандов с различными химическими свойствами проблема устойчивости гетерогенных комплексов значительно сложнее, чем у однородных.
Его подход особенно сложен, так как относительная прочность связи с конкретным комплексообразователем 1 или другим лигандом здесь зависит не только от его собственных химических свойств, но и от всей структуры внутренней сферы, то есть от других химических свойств. Лиганды и их пространственное расположение относительно того, что рассматривается. Особенно важным для прочности связи лиганда с комплексообразователями является характер лиганда, который является первой дислокацией. Этот принцип воздействия лигандного трансформатора очень важен для химии комплексных соединений платины и некоторых других металлов.
Потому что можно предсказать последовательность протекания реакций замещения в неоднородной внутренней сфере, а также сознательно выбрать нужный путь синтеза пространственных изомеров веществ определенного состава. Сто двадцать восемь Поскольку различные реакции комплексных соединений обычно протекают в водной среде, наиболее частым случаем замены одного лиганда другим является приобретение Внутренней Сферы воды, то есть поглощение молекул воды. Этот процесс протекает постепенно, и его скорость и неравновесность, в некоторой степени, служит мерой относительной прочности связей лиганда, получающего водное замещение у этого центрального атома.
Например, в комплексе [Co (NH3) jX3], где X-N07, SG или N07, первый из этих кислотных остатков(и аммиак) не замещается водой, второй частично замещается, третий связан с NH и N0707 сильнее, чем Co1*, последний сильнее, чем N07.129,130. В большинстве случаев приходится заниматься взаимной заменой NH3 и H20 по общей схеме. [E(LNZ) x] + * H20 ^ [StOHJJ + jNH * Равновесное положение этой системы определяет стабильность аммиака в водном растворе.
Дело в том, что в отдельных комплексообразователях очень разные вещества широко используются в аналитической химии 181 * 132 Как показывает опыт, наличие стабильного аммиака в водном растворе является особенностью лишь относительно небольшого числа комплексообразователей, а его отличительной особенностью является сочетание сильного поляризационного действия и относительно легкой собственной деформируемости. Среди наиболее распространенных ионов, Ag*, Zn2 \ Cd2 +, Ni2+, Cu2 +принадлежат в основном здесь.
Таким образом, стабильность комплексной связи аммиака по сравнению с водой характерна для случаев, когда радиус относительно невелик и структура внешнего слоя составляет 18 электронов или неполных ионов. Исходя из вышесказанного, используя понятие поляризации, можно теоретически понять важнейшие свойства комплексных соединений и природу реакций с их участием. participation. At в то же время, основываясь только на этих идеях, возникают, по-видимому, неразрешимые вопросы.
Например, при всех основных свойствах (заряд, радиус, структура внешней оболочки) ионы Fe3 *и Co3 очень близки друг к другу. С другой стороны, в некоторых свойствах их соединений наблюдаются резкие различия(например, в Со3+ аммиак гораздо более стабилен, чем в гидратах, а в Fe8, наоборот).Несмотря на такую индивидуальную неоднозначность, поляризованное выражение не теряет своего значения как основное руководство при изучении свойств неорганических соединений.
Это неудивительно, ведь на данном этапе развития науки она гораздо более систематизировала и понимала общие закономерности, которые здесь имеют место, чем в других подходах* 18С Добавь 1) определение термина «сложная связь» (IX§ 2) не проясняет природу координатной связи, обеспечивающей устойчивость внутренней sphere. In в большинстве случаев их можно интерпретировать как доиорио-акцептор (коордиатив), но есть и другие возможности (некоторые из них будут рассмотрены позже).Комплексные соединения имеют несколько монографий*.
Состояние координационной химии также отражено в обзорной статье. 2) как правило, координационное число атомов выше валентного, а иногда и наоборот. Молекулы Org3 и onf выступают в качестве примеров » (добавлено IX§ 3.63). 3) интересные примеры переходов между нормальной валентностью и комплексными соединениями дают TI$.он подобен тому, что кристаллизуется в изоморфно полной щелочи диамида тяжелого щелочного металла (Rb, Cs) и очень легко разрезает молекулы йода. Молекулы йода могут быть удалены простой обработкой органическим растворителем. Эта ситуация, согласно типу Tl (IIj), содержащего одновалентный таллий, представляет собой структуру T1I.
At в то же время T1b образует йодид щелочного металла и комплексы щелочных металлов типа MGA, где таллий должен быть 3-валентным. Детальное и окончательное решение XII решения показало, что существует равновесие по схеме: TIIj * * T1 [Pa].При добавлении йода (или йодида щелочи) это равновесие смещается влево, а при экстрагировании йода органическим растворителем-вправо. 4) различие между понятиями «лигаяд» и»адддеид» хорошо видно на примере HSNBF(XI§ I add.67).в этом соединении, помимо валентных связей обычных H — N и B — F, Диор-акцепторная связь N- » -B(IX§ 2 add.4) есть. Это очень сложно. Оба N и B могут рассматриваться как центральные атомы, имеющие только 4 лиганда (H, H, H, BFS или F, F, F, NH$) и 1 аддукт (BF или NHt) соответственно.
Термин «комплекс» удобнее использовать при статическом описании комплексных соединений, а термин «добавление» полезен при рассмотрении динамики комплексообразования. Например, это может происходить по комплексному Иону [RSCR «схема Ph * + 6C1 — или PtCI» + 2CI. In в первом случае имеется Дейд из Б, а во 2-м случае-2.С другой стороны, количество лигандов (6 в данном случае) не имеет никакого отношения к образованию комплексов. б) при работе с комплексными соединениями в растворе йода, исходя из Малой склонности ионов CIOJ входить во внутреннее кольцо, ионная сила и РН этих растворов обычно поддерживаются желательным уронием путем добавления NaCI04 и НСУ<.
Однако хожхожхожхож «» c IO ioo и внутренняя сфера еще не абсолютны, но некоторые комплексы С этими ионами известны как лиганды (например, § I add. См. 211). 6) ни один элемент не может считаться сферическим, но для сложной дополнительной формы, которая тесно связана со структурным типом, это очень важно. Например, ионы SOJ — это » тетраэдр, прямой * Грхкберг А. А. комплекс * химическое введение соединений. Эд. 4-й. Л. ..«Химия.» 1971 год. 631р. Желкговская Н. Н. Черняев И. И. сложные химические соединения. М..«Средняя школа» 1966.385 секунд Б Соло Ф. Джонс Р. химия координационных соединений.
С английского, Изд. К. В. Астахова. М..«Мир» 1966.196 секунд Лкюнсд. Р Unlkkis. Современная координация координационных соединений. Пер на английском языке.. Эд. Ю. К. Silquiaya. М.. Пламя фамильного герба. 1963.445 секунд Бэйлор. Буш Д. химия координации compounds. In английский. И. И. Черняев. М Iedathyliliitis, 1960.695 секунд * * Г р и Берг А. А. успехи химии, IMI, M 6. 755. Он не вступает в контакт с комплексообразователем, который только поступает в кислород, и занимает 1 из углов. Общее расположение ионов SOJ » во Внутренней Сфере, следовательно, оказалось соответствующим нижней и внешней треугольным пирамидам.
Это приводит к тому, что слой SO] — самый близкий к комплексообразующему агенту, который фактически занимает больше места, чем элемент Ион O1. Случай Tc, в котором SOJ заполняет 2 координационных узла, соответствует притяжению к комплексообразователю 2 кислорода, который расположен одновременно вдоль 1 из тетраэдрических ребер. 7) в отличие от»случая Иона COJ» SOJ, число зубов более характерно чем monosodium. Интересно, что 1 из комплексов (NHihllrtSOOaChMH ^ SOJ) является мононатриевым, а еще 1-двудольным.
Хорошим примером аддукта гексадеценового датирования является эттинилендиаминтетраацетат алюминия (x§ 2 add. 88). как показано на рисунке XIV-61, Анон может заполнить всю внутреннюю сферу вблизи центрального атома с координационным числом 6.Различные полидактильные лиганды могут быть связаны по названию комплекса. 8)в большинстве случаев происходит совпадение между анализом и истинным номером корректировки, но все же это всегда happens. So рентгенологическое исследование кристаллов (NH ^ JZnCU) показало, что это соединение следует назначать как(NH<) A {ZnCI «] NH » CI. Аналогичным образом, (Нг ^ alSiFyJ на самом деле (Нью-Хэмпшир<) J-типа двойного соединения (ФСС * л НХ » Ф.
В любом случае, истинное координационное число меньше, чем аналитическое координационное число. С другой стороны, присутствие комплексов (NH») j (lrCl5 ] HjO и (NH») j (FECs) H20, [ES1 $ OH «p-ионов с координационными числами обоих комплексообразователей, равно 5.А6.И 6.Кристаллы фторида циркония одинакового состава-LijZrF и KaZrF® — координация циркония различна(CN6 первого соединения и CN8 второго соединения).Особенно интересен случай при формировании глянцевого черного цвета. Простейшая формула csfauci комплекс кристаллов)]: его кристаллическая решетка состоит из Cs \ линейных ионов[AuClj] «и квадратных ионов (AuC!»Ф.)»\То есть соединение имеет как одновалентное, так и трехвалентное золото в Cs [AuCl3] Cs AuCI «]одновременно.
Последнее обстоятельство, по-видимому, обусловило черный цвет рассматриваемого соединения (XIII§ 3 add.51). 9) при оценке результатов рентгеноструктурного анализа кристаллов всегда необходимо учитывать возможность изменения структурных свойств отдельных частиц состояния под воздействием силового поля соседних частиц за счет общего состава кристаллической решетки (энергетического минимума тренда).
Хорошим примером является резкое различие в структуре и кристаллическом состоянии ГАЛОГЕНИДА RH $в паре (IX§ 5 add.58).То же самое относится и к NtO $(IX§ 3). B2C1″(XI§ I добавлено.49). Дя, (ХІ§ 2 Добавить.51)и др. Подобные случаи можно наблюдать и в комплексных соединениях. Например, мы обнаружили, что Кристалл KalCuCM ^ HsO на самом деле представляет собой плотный пакет плоских агрегатов[CuCiOnG].Ионы хлора и калия.
Другой пример: отдельные ионы (HgCl»P〜число координат ртути равно 4, но в случае KafHgCU) кристаллов HtO имеют общее число координат ртути, равное 6 (и различные расстояния-2.4, 2.8, 3.15 A —между ней и индивидуумом). Диаграмма XIV-61. Схема Результаты поиска;>inasin в ЭДТА, ацетат» * Л И Л О и Н. м. Темхина В. Я. Колпаков » И. Д. Комплксоны. М..«Химия.» 1970.417 секунд Атом хлора Alom). NH » [HgCl $ 2] в кристаллах J хлор связывается более тесно с ртутью (4: 2.96 A), чем другой. 10) наличие постоянного диполя в аддукте ионов значительно увеличивает притяжение аддуктов к комплексообразователям, но лишь незначительно влияет на силу взаимного отталкивания.
Это создает особенно благоприятные условия для образования комплексов с высоким координационным числом (если объемное соотношение этому не мешает).Очень веронично. Например, присутствие постоянного дипольного Иона CN связано с присутствием K [[Mo (CN) i] n K4lW (CN)] (в отсутствие аналогичных галогенидных производных). 11) при интерпретации некоторых свойств комплексных соединений рекомендуется выделять так называемые соединения. Переходные элементы, являющиеся членами 3-10 рядов аналога(в состоянии 2 или 3 валентности также могут быть выделены элементы свинца 11).
Наличие неполных ^ электронных (nl /-электронных) оболочек в атомах и ионах высвобождает определенные структурные и энергетические особенности, которые будут затронуты в будущем(дополнительные 83).Ниже мы рассмотрим пространственную структуру Нин, но она не осложнена такими особенностями. 12) пространственное расположение лигандов координационных чисел 2 и 3 в основном связано с симметрией направления координации центра Атом.
Атомы с полным внешним электронным слоем, или сам элемент Ион, сферически симметричны. Однако из-за прикрепления к любой из частиц появляется несколько предпочтительных направлений для дальнейшей регулировки. Общее число (2) такого направления координации можно определить как сумму числа лигандов (миодентат) и числа пар свободных электронов во внешнем (валентном) слое конкретного центрального атома.
В идеале 2 различных значения соответствуют значению угла (a) между следующими направлениями регулировки:2= 2,a = 180e. 2■ ■ 3, a-120e; 2 4.a = 109,5. таким образом, для частиц AB4 структура 2 = 2 линейна([Ag(NH) al *.LAg (CN) i] — ионы, молекулы CO, HgCI и др.), 2 = 3 или 4 —углы (ионы NOJ, ClOJ, молекулы SO * OHi и др.).Аналогично, для частиц AB $плоский треугольник (NOJ».СО} » структура молекулы (BCL * so /молекула и др.) характерно для 2 3, 2 = 4, треугольной пирамиды (non-c10j \ so}», молекулы NH $, PC1 ″ и др.).Отклонение угла от 120 и 109,5 е, вероятно, связано с поляризацией центрального атома или взаимодействием лигандов друг с другом. Последнее, вообще говоря, проявилось не только в отталкивании, но и в прнтенгине (благодаря силе рассеяния).
13) Для качественного предсказания отклонения валентного угла от тетраэдрического угла 109 (109,5°) молекул типа ABA и AB с электронными октетами в Центральном атоме часто используют модельное выражение взаимных отталкиваний свободных (b) и валентных (o) электронных пар, соответствующих ряду-sv>-sv > -o> a-o o. это говорит о том, что, например, неравенство£bOb> 109,5 e> ZXOX справедливо для молекулы oxt. Есть некоторые случаи, когда такие предположения о zxox оправданы, например, ОН * (^104.5 е), ofj (zi03e) и т. д. 0 (CH.), (^112). 0 (С10, ч.)<^ 115). 0 (CeH.), (ZI24e). OTlj (ZI3I*), OAIi (Z145e), OLif (ZI80e) — последнее указывает на то, что необходимо учитывать не только электронную симметрию центрального атома, но и природу связанных с ним частиц. it.
At в то же время он служит менее надежным примером конструктивной конструкции. О, нет. Диаграмма XIV-62. Схема упаковки Nono® KilHgCl4 | .Н20 Кристалл. 14) влияние валентного угла одиночного электрона во внешнем слое обычно слабее, чем у электронной пары, но все же значительно. Следующие данные помогут вам в выпрямлении. 10-нет)* _ ц-е-ОП Я не собираюсь этого говорить…. 180 ″ 134е 115° д(нет), а.. 1.15 1.19 1.24 Заметим, что при введении свободных электронов во внешний слой частицы расстояние между ядрами последовательно увеличивается.
16) энергия, соответствующая изменению валентного угла, мала. Это уже видно по величине постоянной силы, характеризующей жесткость валентного угла. Обычно они находятся в пределах 0,2-0,7 mdn / A (менее 0,1 от величины соответствующей валентной связи).Например, для [Cr (CN) e] 5 существуют следующие значения (ppm / A): 1.9 (CgC), 16.4(CN) и 0.17 (gGCCgC).0.29 (ZCrCN). Для молекул HiO разность энергий между структурой угла 90°и 104,5 e оценивается в 3 кл / моль, а изменение ZHOH составляет всего 0,2 ккал / град. N») 4 уменьшение валентного угла от 109,5 до 90 ° эквивалентно энергетически 21 ккал / моль, давая только около 0,27 ккал / град за 1 угловое изменение. Аналогичная вычислительная цифра для циклопропана (C, H»), как видно из XIV-63, в молекулах этого углеводорода сильно разлагается не только из zccc, ko и ZHCH, но и из тетраэдров.
Низкая энергия деформации валентного угла обусловлена иногда наблюдаемыми изменениями формы простейших молекул в Кристалле, особенно по сравнению с отдельными состояниями. Например. ZHOH кристаллогидрата KaCiO ^ HjO и RbiC20 H20 составляют 120 и 126° соответственно, а в кристаллогидрате Mg0j-6H | 0 форма волновых молекул близка к линейной. То же самое касается растворов воды в органических жидкостях(например, пиридин Жох 130).Я 16) С точки зрения теории направленной валентности(X§ 2 + 3), приведенная выше интерпретация (дополнение 12) подразумевает предположение о том, что связующее внешнего (валентного) слоя конкретного центрального атома, а также свободных электронов, участвует в гибридизации. Если рассматривать только генератор о-связи из электронов связи (X§ 2).18).
Затем добавьте данные. Эти 12 позиций могут быть далее легко сформулированы. Тетраэдрическая симметрия электронных пар соответствует химическому соединению ОТЕТ-электронной конфигурации атомов, гексагональная симметрия соответствует тородиальной, а квадруплеты линейны. В зависимости от количества атомов, прикрепленных вдоль этих линий симметрии, 1 или другая пространственная структура молекулы arises. In в последнем случае в рассматриваемом случае определяются оба координационных номера. Поэтому она определяется не ядром, а электронной симметрией центрального атома. Одним из примеров является ксеноидный фтор, который соответствует треугольной пирамиде с 3 свободными парами на основании и атомом фтора на вершине.
17) относительно редко, но согласно приведенным выше обобщениям, наблюдается большое отклонение структуры от прогноза. Возможные причины различны. Например, плоская треугольная структура ионов[O (HgCl) j)(XII§ 4 add.79),[Си(СN)К1 — (х§ 2 Добавить.44) или молекулы N (SiH3), (x§ 4 add. 。101), поскольку он не участвует в гибридизации свободных электронных пар центрального атома(то есть гибридизации орбиты в виде sp3, но не sp*).Аналогично, утечка S1-O-Si групп SijCbf-ионов (рисунок x-58) может быть обусловлена неучастием в обеих свободных парах гибридизации атомов кислорода(то есть гибридизации sp).Конечно, такая интерпретация является скорее объяснением. РНС. XIV Ю.
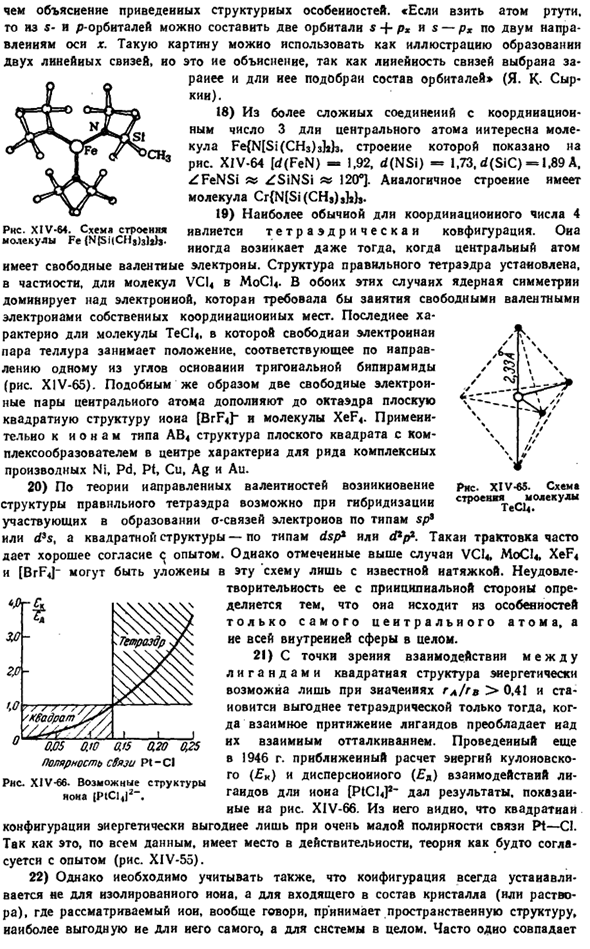
Схема строения молекул CjHe. Чем описание данных конструктивных особенностей. «Когда вы получаете атом ртути, вы можете построить 5 орбит и 2 орбиты в 2 направлениях по оси x, s + P *и$-px. Такое изображение может служить схемой образования 2-х линейных связей. Но это другое объяснение. Это происходит потому, что линейность развертки предварительно выбрана, а конфигурация траектории долго выбирается«(Y. K-Syr-kii). 18) из более сложных соединений координационного числа 3 длина центрального атома интересна для молекулы Fe {N [Si (CH3) 3bb. Его структура показана на рисунке XIV-64 (d (FeN) −1.92,d(NSi) — = 1.73.4(SiC) — * 1.89 A. ZFeNSi «ZSiNSi» 120°].Молекулы СГ {П(Си( ч), НВ.
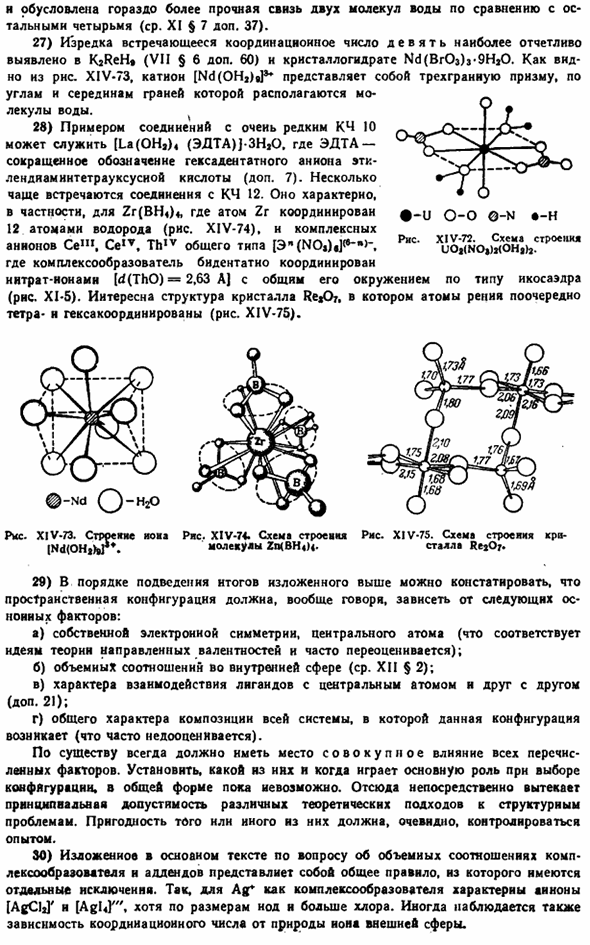
19) наиболее распространенной длиной регулировочного числа 4 является тетраэдрическое расположение. Центральный атом Он имеет свободные валентные электроны. Нормальная тетраэдрическая структура, в частности длина молекулы VCI4 MoCl, равна established. In в обоих случаях ядерная симметрия является более доминирующей, чем электроны, что потребовало бы занятия участка свободной координации электронами со свободной валентностью. Последнее характерно для длины молекулы TeC1a, а свободная электрическая энергия и пары теллура занимают положение, соответствующее 1 направлению угла относительно дна треугольной пирамиды (рис. XIV-65).Аналогично, 2 пары свободных электронов центрального атома дополняют плоскую квадратную структуру Иона [Brfa]и молекулы xef4 к октаэдру.
Структура плоского квадрата, содержащего комплексообразователь в центре, применительно к ионам типа AB4 характерна для чтения комплексных производных Ni, Pd. Пт, Си, AG и AU. 20) согласно теории направленной валентности, образование тетраэдрической структуры возможно, когда электроны, участвующие в образовании связей O, гибридизуются с sp3 или (тип Ps, а квадратная структура по типу dsp *или 4 * p*).Такая интерпретация вполне совпадет с опытом. Приведенные выше случаи, VCU MoCI * Xefa и[BrFJ -], могут быть помещены в эту схему только в определенном диапазоне.
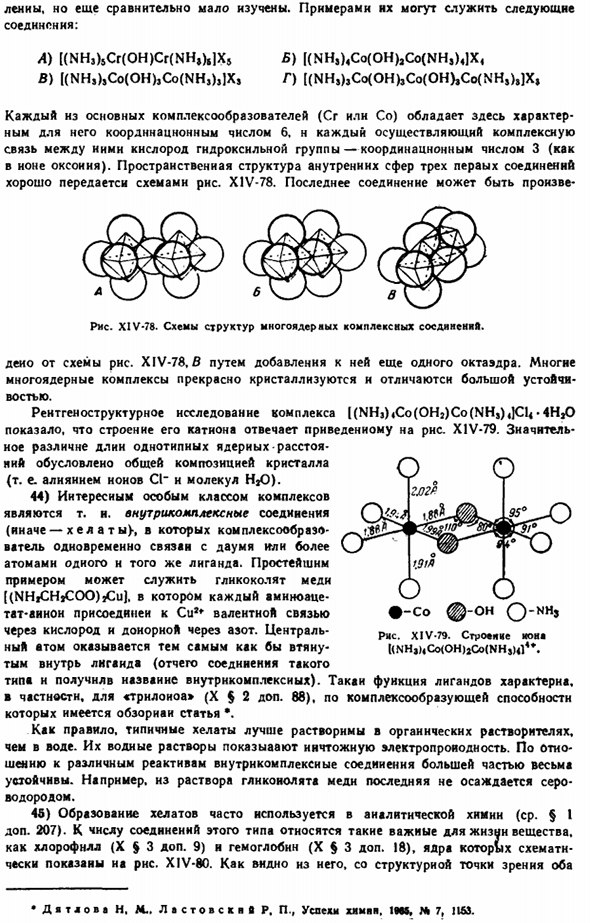
Неудовлетворительность в основном аспекте определяется тем, что она исходит не из всего внутреннего атома, а из особенностей только центрального атома. 21) с точки зрения взаимодействия между лигандами квадратная структура энергетически возможна только в случае hl / gv> −0,41, а 100 ионов предпочтительнее тетраэдра только тогда, когда предпочтительно взаимное затягивание ingod. РКС. XIV-64.Схема * молекулярная структура Fe (N (Si (CHsh) ih)- Ряса. XIV-65. Структурная схема молекулы TeC14. ’П’ М2 /) К Год.////// / hbadrath л 005 0w 0/5 020 425 полярность по упругой Pt-CI Рисунок XIV-66. Возможная структура Иона IPICI.) 2 ″. Их взаимное отвращение.
Приближенный расчет энергии взаимодействия Kuloi (£k) и дисперсии (я) ионного взаимодействия (PtCI p -), выполненный в 1946 году, дал результаты, показанные на рисунке X1V-66. это выгоднее только в том случае, если полярность связи pt — CI очень низкая, по всем данным, это делается на практике, поэтому теория, по-видимому, совпадает с экспериментом(рис. XIV-55). 22) однако необходимо также учитывать, что состав всегда устанавливается для кристаллов (или растворов), входящих в состав Кристалла, и не всегда выделяются ионы. Здесь рассматриваемые ионы предполагают, в общих чертах, наиболее выгодную пространственную структуру для всей системы, а не для itself. In много случаев, 1 вещь будет соответствовать Еще один, но не редкий.
Например, сам плоский Ион типа AB4 должен иметь квадратную структуру, но при исследовании кристаллов K [AuBr4] −2H3O [AuBr «f-ионы плоские, а 2 брома находятся на другом расстоянии от золота (2: 48 A), чем другие 2 (2: 65), то есть в общем составе кристаллов ионная структура существенно зависит от того, что у нас есть большой опыт в этой области. Кристалл K [1C1 J HjO(XIII§ 1 add.93) [1C1]] — ионные квадраты еще более искажены. Na (BF „]в Кристалле, параметр D (BF) “ = 1,40— 1.42 A и ZFBF — » = 106-I-lllo(то есть он больше не влияет на нормальный тетраэдр) в кристаллах NajfSnFe, на расстоянии 1.83 2 длины(SnF), на 1.92 A 2, на 1.96 A 2(то есть Anoy не является октаэдром).
Аналогичным образом, идеальное расстояние тетраэдра и угол связывания ядра молекулы SnBr » одинаковы в кристалле этого вещества, но варьируются в d (SnBr)» = 2.37 H-2.44 A и ZBrSnBr = 106.3 4-111, 2 e. простейшим дополнительным примером является разница в идеальном расстоянии молекулы. Кристаллы йода (2,715 А) и отдельные состояния (2,662 а).Из предыдущих результатов видно, что рентгеноструктурный анализ Кристалла дает точное представление о структуре соответствующих отдельных молекул или ионов. К сожалению, при этом очень часто не учитывается, что частицы (молекулы или ионы)»удаляются«из кристаллической решетки, а их структурные особенности учитываются только за счет внутренних relations.
In в частности, близость атомов обычно рассматривается как свидетельство валентной связи, но обычно является результатом вынужденной конвергенции под действием общей силы поликристалла. 23) наиболее характерной структурной формой отдельных молекул АБ является тригональный Близнец (согласно теории направленного RNS-XIV-67, структура(NbPjfc. Совместимый с валентностью штукатурки и гибридизацией ДС / П) Или (fisp).примером является анион комплекса[Cr(NHs) e] [CuCl&J. d (CuCl)= 2.35 (основание) I 2.32 A (вершина).
Наличие свободных электронов в Центральном атоме обычно указывает, например, на длину молекулы BrFs (VII§ 4 extra 24) или non (TeFsf «(С d (TeF)= 1,96 (в основании) и 1,84 a (в основании)) интересно, что анион комплексаN (CaH5) 4 [<*(1пС1)=-2 (.46) и анион комплекса (вверху), но интересно, что он наблюдался. Однако в 1 ионы свободных электронов exist. In в случае кристаллических гидратов, четырехугольные пирамиды часто дополняются молекулами воды на поверхности. octahedrons. As например, соль (NH») j (OV (NCS) 4)•5НаО V (NCS)»ohj»1 -, где анион имеет структуру, а RF (OV) = I, 62, D(VN) = 2,04 и D (V-OH2) = 2,22 A.
Кристаллом безводного соединения Ab$, хорошим примером является nbfj, кристалл которого состоит из тетрамера, показанного на рисунке XIV-67[D(NBF) = длина линкера 2,06, длина концевого фтора атом 1.77 а].Особый интерес представляет их структура: ZNbFNb = 180°.Используйте структуры TaF$, MoFs, WF и др. из NbFs искать наличие свободных электронов в атомах Mo и W. Следует отметить, что для элемента 10 многих аналогов характерные свойства координационного числа 5 определяются неравенством Ni> Pd> Pt.
Комплекс с корректировочным номером 5 имеет обзорную статью. 24) в Координационном числе 6 идей симметрия явно доминирует на Электроне: структура октаэдра(согласно теории валентности направленности) * С аххон н Л.. Успех hiiym, 1969, м 12. 2129. d ’ sp3 (характерный только для гибридизации) встречается в молекулах с различными электронными свойствами cs-стральных атомов. Наиболее полно он представлен фторидом 3fa, который представляет собой не только Se, Te, Mo, W, но и Tc, Re, Ru, Os, Ir, Pt (с большим количеством электронов в Центральном атоме).Очевидно, единственным исключением является молекула Xefa, для которой она, вероятно, имеет искаженную октаэдрическую структуру. Аналогично, октаэдр карбонола E (CO)$характеризуется не только Cr, Mo, W, но и ванадием(менее 1 электрона).
С другой стороны, они также имеют не (SeCI»p〜и[TeC1bp-соответственно, центральный атом имеет свободную электронную пару. Некоторые лиганды могут стабилизировать координационное число 6 таких центральных атомов, но эта координация обычно нехарактерна. Примерами являются комплексы этилендиамония[HgEnj (CLOA) s и{CuEn|] SOa. Интересно, что это показано на рисунке. X1V-68 структура продукта присоединения пиридина к пероксидам хрома (VIII§ 5 add.34). 25) в Центральном атоме соединения с координационным числом 7 встречаются редко.
Они делятся на две группы: лица(rns. It характеризуется структурой треугольной призмы с частицами 1Х-67) и 1-й пятиугольной пиламанды. Примером первого типа является ионный [ZrFi] *〜(x§ 7 add.55), Пример 2-го Иона[UF7J * — (XI§ 7 add.78).Тот, что показан на рисунке, находится немного в стороне. X1v-69 структура CrO <(MH3)$. Случай Cs3lU02 (NCS) s]интересен тем, что симметрия пентагонально-пирамидальных ионов очень резко искажается под влиянием электростатических взаимодействий между атомами Cr, O и N: in , d(UN) «= 2. 38 и 2.48 A, d(NC) 1.32 и<(C$) = 1.47 a среднее значение, хотя 1 из последней связи является аномально коротким (d » 1, 35 A), в то время как THECS не находится на 180°Zn. 169-177°*однако, возможно, что неверная модель была просто использована в качестве основы для декодирования (XII§2 add.30). Рисунок XIV-b. структура C $ HtN-СУ5.
Рисунок XIV-71.Название здания / Mo (CN)$/. Рисунок X1V-70.Камала Тая тайпрнзма. РНС. XIV-6 » Схема финансовый директор «инх», 3. 28) наиболее характерным представителем соединений с координационным числом 8 в Центральном атоме является Na $ [TaFe] n K » IMo (CN)j]•2HtO.In первый Анон, Id (TaF)= 1,98 а, ZFTaF = 75°), атом фтора расположен под углом антипризмы квадрата (рис.XIV-70).Например, Кареффт имеет аналогичную структуру.С другой стороны, Ион fPaFJ «- это почти квадратный куб[d (PaF) » *-2.21 A]. [Mo (CN)$ J4-структура аниона ( 1.16 A) показана на рисунке. X1V-71.
Такой же тип характерен для перхлоратов kzsg08.Но анионы асимметричны[4 расстояния< / (CrO) не равны другим 4:1,85 и 1,94 а].интересной структурой является кристаллический гидрат UO ^ NOih-eHjO. d(UO) 1,7 1,76 A, d (UO)= = 2,5 2,50 a группы NOS из 2 молекул hjo, около 2 d(UQ)= * 2,40 A (рисунок X1 V-72), остальное расположено в пустотах решетки. С этим А также потому, что связывание 4 2 молекул воды намного сильнее по сравнению с другими 4(XI§ 7 add.37). 27) редкий координационный номер 9, KaReHt (VII§ 6 add.60) и кристаллогидрат Nd(Br03) наиболее четко идентифицированы в j-9Hj0. как вы можете видеть из rns. XIV-73, катион (Nd (OHj)) » J **представляет собой трехгранную призму, молекула воды расположена в углах и средних точках ее поверхности.
28) примером соединения с очень редким CN 10 является [La (OH.) » (EDTAN-ZN, 0.ЭДТА обозначает 16 шестнадцатеричных анионов этилендиаминтетраацетата (add 7).Соединения с CN12 несколько common. In в частности, это характерно для «Zr (BH»)«.Здесь ЗР атома координируется 12 атомов водорода(рисунок XIV-74). — .Где комплексообразователь случайно корректируется Неазотистый (d (ThO)= 2,63 AJ, его общая икосаэдрическая среда (рисунок XI-5).Атомы рения принимают чередующиеся четыре и шесть координаторов Re ^ O? Структура кристалла(РНС. XIV-75). О-О-0-Н XIV-72. Uoifnotmohab-структурная схема P * s XIV-75. Вид кристаллической структуры Rexof. O-H2O XIV-73. структура iNdtOHabT. РНС. XIV-74.Схема « * * * молекула Zt * BH») 4. Фигура
29) подводя итог вышесказанному, можно сказать, что в общих чертах пространственный состав должен зависеть от следующих основных факторов: а) присущая электрону симметрия центрального атома (соответствующая идее теории направленной валентности, часто переоцениваемой); b) соотношение объемов внутренней области (см. XII§ 2); в) характер взаимодействия лиганда и центрального атома и взаимодействие (дополнительно 21); г) общий характер конфигурации всей системы, в которой эта конфигурация происходит(часто недооценивается). В принципе, совокупное воздействие всех этих факторов должно присутствовать всегда.
Если вы играете главную роль в выборе композиции, то все равно невозможно установить, какая из них в общем виде. Это прямо подразумевает принципиальную допустимость различных теоретических подходов к структурным проблемам. Соответствие любого из них должно четко контролироваться опытом. Основной текст по соотношению объемов комплексообразователей и надстроек (со) — это общее правило, из которого есть отдельные исключения. Поэтому анионы [AgClJ ’и (Agl «) » являются свойствами Ag *в качестве комплексообразователей, но йод может быть больше по размеру, чем хлор. 3!)
Ниже приведены хорошие примеры последовательного изменения структурных параметров при комплексообразовании. БФ, chjcnbf, chanhabpa БФ〜 д <БФ). ля。. 。 1.30 1.32 1.37 1.43 zfbf * …. 120114111 109.5 Взаимодействие между BF и aetonntrnl является относительно слабым и мало влияет на параметры исходной молекулы. Более сильное комплексообразование с метиламином(d (BN) » = 1.58 A) сильно влияет на эти параметры и близко к свойствам BFJ. 32) образование комплексных анионов из соответствующих элементарных ионов обычно сопровождается незначительным уменьшением ядерного расстояния между центральным атомом и lngandamn по сравнению с суммой действительных ионных радиусов.
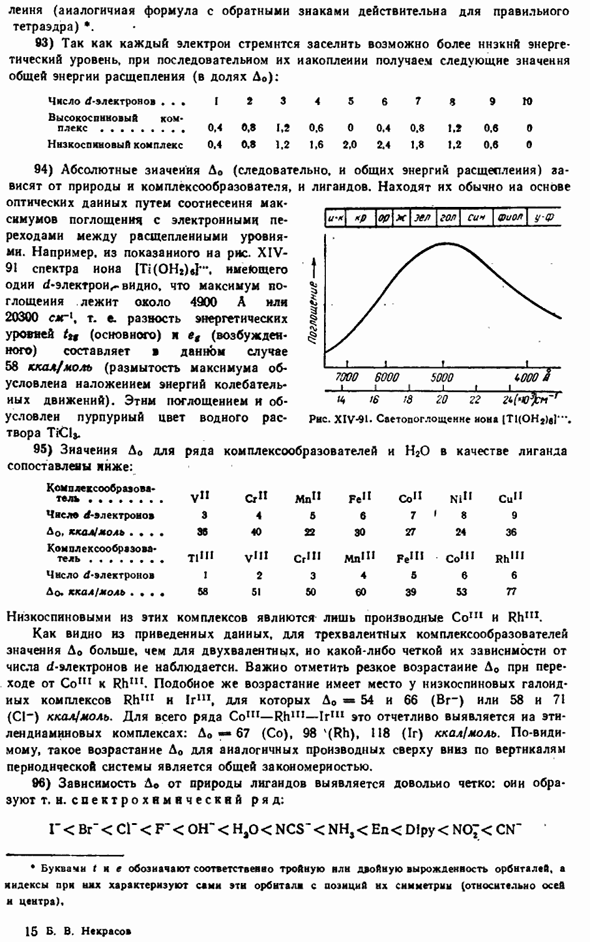
При такой допустимости сжатия наличие односторонней деформации лиганда комплексообразователями делает критическую объемную зависимость конкретной структуры более применимой к внутренней сфере комплекса, чем к нормальной кристаллической решетке с полиплоскостной деформацией (XII§ 2, 58).Поэтому модельные расчеты, выполненные на основе максимально возможной эффективной радиоактивности для добавления комплексов и координаторов этих компонентов, не обязательно подтверждаются experience.
In в частности, это можно увидеть с non [BF4].Это связано с тем, что отношение Rk / Ra равно 0,20 / 1,33 = 0,15, поэтому не-B **должен был присоединиться до 3 ионов F〜. 33) в цианиде цинка и его аналогах наблюдается довольно регулярное изменение взаимодействия комплексных анионов: Zn * * Cd » Он» Расстояние до центра e ^ ck, a 2.71 2.78 2.77 Радиус ком плехсообраео вате ля » 0.83 1.03 1.12 Эффективный радиус CN -, A. 1.88 1.75 1.65 Из решетки цианида щелочи радиус CN-вычисляется как 1,92 а, так что получается. На всех 3-х соединениях наблюдается некоторое сжатие, которое заметно усиливается при переходе от Zn к Hg. 34) из только что рассмотренного материала видно, что даже если комплексообразователь и добавка не находятся в самом тесном контакте, внутренняя сфера может поддерживать достаточную стабильность в своем существовании.
Это обстоятельство, по-видимому, играет важную роль в образовании различных стереополикислот и их солей. Этот тип соединения имеет монографию*. Как упоминалось ранее (IX§ 5 * add.50), гетерополикислота представляет собой комплексное производное O1 ″ кислородной кислоты, в котором некислородные соединения полностью или частично замещены другими кислотными кислотными остатками. Подобные соединения также известны во многих амфотерных и основных гидроксидах. Поэтому в комплексообразующем агенте может появиться много элементов.
Новое о’dends замен в основном ионные МО, ОЖ〜, W2Oj〜, MoOj», Уоч», ионов во〜, в, ОЖ〜, CrOj», найти -.Сеой » и Теой -.Если центральный атом комплексообразователя и аддукт идентичны, то получается бензополикислота (VIII§ 5 add.29). 35) в составе гетероевой кислоты на атом комплексообразователя приходится до 6 частиц лиганда Agent. So например, P, Si и B, они производятся из гидратов неизвестных форм в свободном состоянии (HrlPOiJ, H » [SiO)). Ч «(Спи |.
Например, если WSO ’ — наполовину ограниченное замещение всех 6 видов кислорода Е. А. гетеросексуальная связь. М. Госхамиздат, 1962.442 секунды Получается следующая формула: Hm {P (WjO?«] «, HJSifWjOy)»]. Hejb (WjO) tl для каждой из этих кислот, кислот и промежуточных солей являются known. An примером последнего является водорастворимый вольфрамат калия kjsi состава с отличной кристаллизацией(WjOyJeJ * 14H, 0.Свободные кислоты кристаллизуются в изоморфные друг другу, давая 28 и 22 2 кристаллогидрата, в том числе HsO.
In помимо сложных структур P, SI и B, гетероэпитализмы с Mo, 0 *〜или W7Oj〜известны как лигазы для Az, Ge, Sn, Tl, Zr, Ce, Th и других элементов. 38) образование гетерополикислот радикалами Mo04 и W04 во внутренних сферах характерно в основном для H5Yu и H «TeO», а также гидроксидов амфотерных и ферментированных гидроксидов (Cr, Al, Fe, Co, Cu и др.).
- Ограничения рассматриваемого типа гетеро полных узлов соответствуют формулам: Hj (l(W04) e], H Alpha (Te(Mo04)$ J, Hfl(Fe(W04) e), HioICu (Mo04) e] и др. Известна только кислотность nnh * Соль. Примеры промежуточных солей, Nas (] (WO») J-8HsO N Na $(!(Mo04) e) — * 13HjO. As как видно из рисунка XIV-76, кристаллическая (NH4) JTe (Mo04) i (рентгеновский анализ)-7h20 структура этого типа гетерополианионов очень компактна. 37) благодаря возможности неполного замещения кислорода и различных кислотных остатков, входящих в молекулу, число известных гетерополикислот и их производных очень велико.
Например, гидрат HHPOJ может соответствовать типу H, {P (M <* O)»], Hm [PO(Mo, 0.), 1. Hg [POa (Mo, 0, 4)и др.), Ч |(П (Уай хорошо [П(Моджо? То же самое касается гетерозигот, чем другие 30j〜цвет рассматриваемом соединении сильно зависит от природы последнего, так что не MoaOj〜придает им желтый или оранжевый цвет, а не СШ-W2O-часто вызывает появление желтого оттенка, во-Иона обычно окрашенная в желтый, и VJ-фиолетовый цвет окрашенный желтый. — красный, Кроф ион-это «оранжево-красный«.«Гетерополисель с оставшимися 30j ионами» практически бесцветен в качестве лиганда.
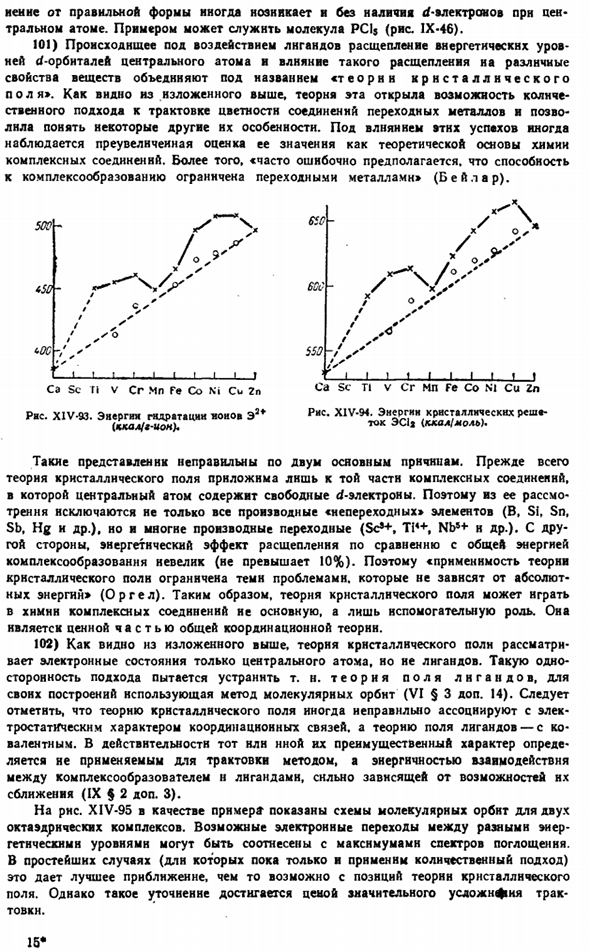
38) В дополнение к производным гидратного типа с координационным числом b, существует также чтение соединений рассматриваемого типа, которые также производятся из более бедных гидратов в воде. Людмила Фирмаль
К ним относятся, например, соли гетероциклов, такие как HJPOa (VOj) jl, HJP04 (V0a) J. HJAs0j(S04)]. HJA (Cr04) 4]и многие другие, известные только в виде солей в большинстве незаполненных партий, например, на основе хрома: HaCr04 H, [Cr0, (Cr04) J HjCr0 ^ Cr04) 2] Hf [Cr0(Cr04)、] Крокоя два цвета три цвета четыре цвета Кислота Кислота Кислота Когда конструкция неполных щелевых щелей усложняется, ее прочность обычно возрастает, в частности, дихромат оказывается намного прочнее хромовой кислоты (VIII§ 5 add.29).
39) несмотря на то, что состав гетерозиготных слотов весьма разнообразен, большинство из них характеризуется рядом общих признаков. Именно поэтому почти все является сильной кислотой, которая хорошо растворяется не только в воде, но и в эфире и других органических жидкостях.
Имеется обзорная статья*об извлечении такой жидкости из водной среды. 40) гетерополисная соль, как правило, очень растворима в воде и прекрасно кристаллизуется. Соли NH *,Ca, Ag, HgJ*, а также громоздкие комплексы и органические катионы обычно более растворимы, чем другие. Все гетерополисы характеризуются незначительной деструкцией из-за избытка щелочи, но в отношении кислот стабильность отдельных представителей весьма различна.
41) интерпретация структуры гетерополинга, рассмотренная выше, восходит к 1908 году и была основана на обобщении результатов исследований аналитическими и физико-химическими методами. На протяжении четверти века правильность этой интерпретации не подвергалась сомнению. Однако, как видно из следующего приблизительного сравнения, полученные позже данные прямого определения структуры могут в ряде случаев привести к существенно иным выводам. Старая формула новая формула H7fP (W * 0.)<). / пн, 0 Н3 [Р(Ш «Оле«]•(Т + 2) ч, 0 Ч $ [Си(WjOfb). mHjO Н4 [Си(камера W30 | о) «]•(м-ф 2) ТНТ H, IB (W, 07).]•mHtO HglBWOuM * (m-f 2) HtO 1ES> 0 » o1v Ион(где E-P. Si. B)на радаре появляется схема атомной координации. X1V-77.
As из него видно, что структура представляет собой кубический восьмиугольник (см. рисунок в середине рисунка XII-19).в углу находится атом вольфрама(круг с тенью). в центре кубического октаэдра находится главный комплексообразователь (большой черный круг), окруженный тетраэдром, окруженный 4 видами кислорода(маленький черный круг).Последние, соответственно, связаны совместно с 6 кислородсодержащими сообществами. Напиток расположен на внешней стороне кубоида (небольшой белый круг! это не. Стабильность структуры дополнительно обеспечивается кислородной связью между атомами вольфрама. Ион[3WuO » ol ««» является замкнутым целым и не связан непосредственно с другими подобными ионами.
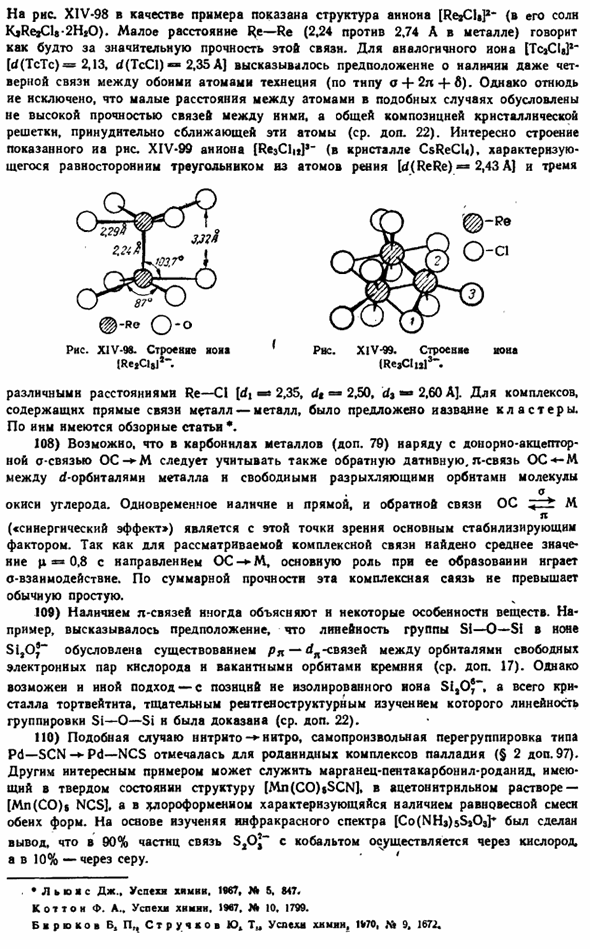
42) новая формула гетерополимера отличается от старой координационным числом комплексообразователя в Центре (6, а не 4) и основной точкой образующейся кислоты. Эти основы явно несовместимы с присутствием солей, таких как сульфат вольфрама, упомянутый выше. Однако важный анализ имеющегося экспериментального материала, по-видимому, приводит к возможности такого несоответствия: смешанный козел, например, Кильсловьерский комплекс) — 14Н| 0.It представляет собой двойное соединение гетерокомплекса с солью кислоты, входящей в состав гетерополианнона(то есть его можно записать как K «ISI (WjO;)»]] * 2KaWj07•14HjO или KJ $ 1 (WA) 4-4KHWO «» 12H, 0). До сих пор структурная детерминация отдельных гетерокомпозитов была относительно невелика.
Поэтому слишком рано перестраивать их систематику вообще на новую основу. Однако в других случаях эта новая структура представляется более разумной по своей сути, чем старая. Имеется обзорная статья о кристаллической структуре неоднородных соединений. 43) с точки зрения общей схемы комплексных соединений близким к полизолоту является многоядерный комплекс, особенностью которого является одновременное присутствие 2 или более основных комплексообразователей в одной и той же внутренней области.
С ним связано огромное количество веществ. И. П. Судаков Ф. П. К л■т и я и В. И. 1МБ, Б, 1368、 хрипеть А. К. Дж успеха * химия, 1МБ, М. И. 1374. Лень-это лаз, но он все еще редко изучается. Эти примеры включают следующие соединения: А) [(Нью-Хэмпшир)) скл (о) СГ(Нью-Хэмпшир|)/] хз Б) [(НГ.)4Co(ой) ВБО(НСЗ)4] Х4 Б) [(Нью-Хэмпшир), со (О), ко (Нью-Хэмпшир, б) х, г) [(НСЗ) АОС(о), Со (о), Колорадо (НСЗ).] х $ Каждый из основных комплексообразователей (Cr или Co) здесь имеет координационное число 6, что характерно, и каждый выполняет комплексную связь между собой кислорода гидроксильных групп-координационное число 3 (как и в неоксонах).
Пространственная структура внутренней сферы 3 соединений пера видна из рисунка 3. X1V-78.Последнее соединение может быть установлено Рисунок X1V-78.Схема строения многоядерных комплексных соединений. deio из схемы РНС. Добавьте еще один октаэдр к XIV-78, B. Многие многоядерные комплексы хорошо кристаллизованы и очень стабильны. Рентгеноструктурное исследование комплекса knhjhcofjojjjjilcu•4Н » показало, что структура его катиона соответствует структуре, заданной RNS. X1V-79.Большая разница в длине одного и того же ядерного расстояния обусловлена общим составом кристаллов(то есть влиянием ионов C1-n на молекулу HjO).
44) интересным специальным классом комплекса является T. In комплексное соединение (другими словами, chal>, комплексообразующий агент) присоединяется к множеству атомов Daum или одного и того же лиганда одновременно. Самый простой пример-глноколит меди [(LN> CH » COO) cCu]).Каждый амино ацетат-анинон связан с этим через валентную связь через кислород и азот до рождения. Это приводит к тому, что центральный атом втягивается в лиганд(по этой причине соединения этого типа называются внутренними комплексами).Функция такого лиганда особенно характерна для «trnloioa» (x§ 2 add.88).Обзорные статьи отличаются * способностью к комплексированию.
Как правило, типичный хелат лучше растворяется в органических растворителях, чем вода. Их водный раствор показывает очень маленькую проводимость. В отношении различных реагентов комплексные соединения в большинстве случаев очень стабильны. Например, из раствора гликоконъюгата меди последний не будет осаждаться сероводородом. 45) хелатирование часто используется в аналитической химии (§ 1 add.(См. 207).Этот тип соединения содержит хлорофилл (X§ 3additional.9) и гемоглобин (х $ 3 дополнение.
18) содержит вещества, важные для жизни, такие как: XIV-80.As вы можете видеть, с структурной точки зрения, как РНС. XIV-79.Структура ионов [(NH.) » Co <OH) aCo (NH.) 4l4 \ * Дитлова Н. М.. Lastovskvy р. п. и достижений в области химии. IMS, W 7, 2163. Эти катализаторы жизненных процессов похожи друг на друга. Имеется обзорная статья*по кристаллохимии внутрикватных соединений. 46) из текста, рассмотренного в основном тексте, мы можем видеть, что относительно небольшой объем заряженных ионов должен быть типичным Комплексообразователем. Роль их комплексообразования не характерна, так как анионы элементов характеризуются малым зарядом и значительным количеством.
Но помимо аммония, некоторые представители таких комплексов еще известны вввв \ Я / — <в>\ GF / Средний Я Ф — ПАРЕНЬ. Ч т и / ГР-Н Н = С V> VN’cfcf II I \ — ВВВ I»T 4 около 5 Рисунок XIV-80.Схема ядра хлорофилла (M) I гемоглобина (£). Соединений Оксон. Из последних наиболее интересным является основной ацетат бериллия (XII§ I постскриптум 60), а центральным комплексообразователем координационного числа 4 является Ион кислорода. Это гораздо более характерно для координационного числа 3, комплексов (0 (HgCl) 3) Cl (XII§ 4, дополнительный 79)и др., которые появляются в ионах OHJ. 47) в случае F роль центрального атома гораздо менее характерна, чем в случае кислорода.68), плюс можно привести пример.
Графически показан состав соли (K {F (SbF3)), ее анионная структура (по данным рентгеновской дифракции). XIV-8I. ИонH3BHBH3J-(добавлено XI§ I. 106) H интересен как центральный атом. То же самое очевидно верно и для F (0C) s3H3 (C0) e)-конусов. Е СГ, МО. W [A rf(CrCr)= » 3,41 AJ. 48) концентрированный раствор AgNOa (H. например, начиная с Agl, можно получить двойное соединение AgI-2AgN03, свойства которого указывают на структуру fIAgj] (Ной с использованием Иона I в качестве комплексообразователя.
Подобные комплексы известны для CN-ionSCN -.Число координаций уменьшается, и образующийся продукт соответствует типу[rAg2] N03.As упоминается (XIII§ 2 ВН.78), большинство из этих соединений характеризуются определенной температурой плавления. Возможно, то же самое относится и к веществам, получаемым при взаимодействии золы с концентрированным раствором AgN03>что: ее состав — GaAs SAgNOj — соответствует структуре(AsAg»», играющей главную роль в образовании таких соединений, возможно поляризация и комплексообразование лигандов..
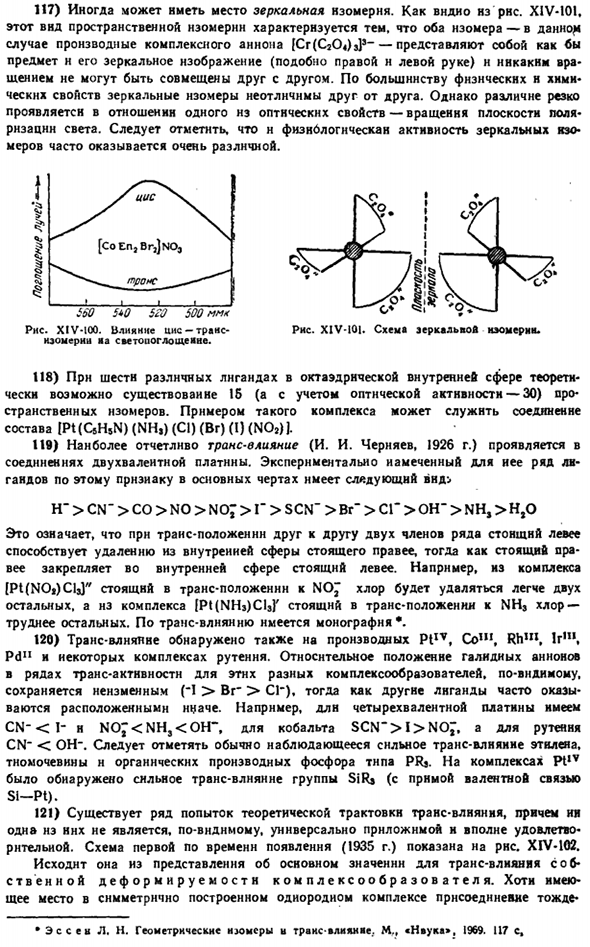
49) если увеличение числа координации сказывается как снижение температуры. Увеличение последнего должно привести к снижению на каком-то этапе Ряса. X1V-81.Структурная схема ионов (F (SbP * Ш у г и М А. Е. ..Успехи в химии. 1854, м. 5.622. Шугам Е, А. шк о б ■ Як Оа а Л. М.. Химический успех, I9S9, L » 7.899. Порядковый номер, связанный с частичным или полным распадом комплекса. Очевидно. Такое уменьшение числа координаций происходит легче (то есть при более низкой температуре), и поэтому становятся более благоприятными условия для самой исходной структуры.
50) так как наименьший поляризационный эффект получается при очень большом комплексном (или органическом) катионе, то с их помощью возможны случаи, когда удается стабилизировать нестабильные анионы, без которых обычные соли не могут быть получены. Например, оранжевый INfCjHsbKAsCU был синтезирован (разложен при mp 147°C) действием 0°C хлора на раствор AsClj n [N (C2Hs)] Cl на CHC1.
61) до сих пор оценка относительной прочности отдельных комплексных связей возможна только в самом общем виде terms. In с точки зрения значимости природы комплексообразователей, в отличие от внешней оболочки, которая характеризуется более сильным поляризационным действием 18 электронов и неполярностями, остальные равны (заряд, радиус), являются гораздо более типичными комплексообразователями. 8 электронный ИО больше. Например, T1,#(1.05 A) и Y * * (1.06 A) известны различные комплексы acndo, в которых nx не образуется. Аналогично, комплекс acndo CA Alpha*(1.06 A) и Sr1 *(1.27 A) очень характерен для Cd1 *(1.03 A) и Pb *(1.32 A), тогда как мало что известно. 。
52) внутренняя деформируемость комплексообразующих агентов оказывает различное влияние на сложные отношения в зависимости от природы лиганда. Если последнее трудно деформировать, то его роль. Как правило, небольшие. И наоборот, если лиганд легко деформируется, то наличие легкой деформируемости комплексообразующего агента приводит к сильной консолидации комплексной связи. Это приводит к разнице между равным зарядом и Комплексирующим Агентом с близким радиусом 8 электронов. С одной стороны, 18-электроины (а они имеют неполную внешнюю оболочку) — с другой стороны, они обычно проявляются более резко, чем больше деформируемость лиганда.
По той же причине прочность комбинированной связи с труднодеформируемым lngandamn аналогично построенного набора комплексообразующих агентов(т. е. каждой подгруппы периодической системы) обычно возрастает с уменьшением радиуса, но в присутствии легко деформируемых кольцевых групп из 18 электронных комплексообразующих агентов это часто происходит с противоположной зависимостью.
53) снижение устойчивости кислотного комплекса к ряду 1-валентных ионов F «- C1 »- Br—I » наблюдается в большинстве комплексообразователей и, по-видимому, связано с резким повышением деформируемости лигандов этого ряда. Появление односторонних деформаций и структурных изменений с уменьшением координации number. It характеризуется сильной поляризацией и как особенно острый комплексообразователь H против незначительной (и поэтому особенно склонной к односторонней деформации) ions. In фактически, только производное некоторых труднодеформируемых аддуктов устойчиво из кислотно-водородного комплекса, особенно F -.
54) для всех щелочных металлов был получен тип MF * HF полностью кристаллизованного бифторида. Также известен NH4F-HF (mp 125°C).Эти Солнца представляют собой гидрированные комплексы, структура которых соответствует формуле MfHFil (рисунок XIV-82).Образование ионов[HF*} — эффективный радиус F этого комплекса вычисляется (относительно нормального значения 1,33 а) 1,15 а, поэтому сжатие продолжается.
Однако такой вывод справедлив только в том случае, если он действует на условный радиус фтора, а не на фактический эффективный радиус фтора(см. XII§ 2, 56). 55) интересный материал получен путем сравнения свойств некоторых однородных комплексных производных трехвалентных элементов. Ряса. XIV » Кристель Ко-РХ-Ир. Непрерывное ослабление кислотной диссоциации ионов (d (NHj) fOH}]при переходе от Co к Ir означает, что поляризационный эффект комплексообразователей в этом ряду ослаблен.
С другой стороны, прочность комбинированного связывания хлора в не〜(3 (NHj) sCIJ-увеличивается с переходом от Co к 1g. 56) изменение стабильности некоторых катионов Е2*, типичных комплексных производных, ионного радиуса, поляризуемости (XIII§ 3 add. В) и относительный потенциал поляризации (XIII§ 3 add.15) сравнить с такими характеристиками: <Р% ** <Со * * < КР ’«»> ЗН ** г,… 0.83 0.82 0.78 030 0.83 Ом 0,58 0,24 0,48 0,3 В С. 。 。 。 0.89 0.92 0.96 1.03 1.01 Как видно из этих данных, ход изменения устойчивости лучше всего совпадает с ходом изменения относительного поляризационного потенциала (ПП).
Максимальное значение Cu1*, в частности, может быть связано с тем, что деформируемость этого Иона значительно больше по сравнению с соседними ионами. 57) зависимость прочности комплексной связи от свойств лиганда нельзя рассматривать без учета химических свойств комплексообразователя. Например, Ион NC серии F—C1 — Br — I «(деформируемость nx быстро возрастает) во всех случаях нельзя назвать более устойчивой связью F» nln I».Присущие деформируемости комплексообразователей, максимальная прочность композита облигаций, движется по этой серии от F до G.
На самом деле, сложный фторид комплексообразователь (Аль *-.Си4 *и другие), и длины легкодеформируемых комплексообразователь (НД *#.АГ * Н.- Nodends (ср. МФ. XIII§ 3 add.10). Существование указанных выше закономерностей, по-видимому, обусловлено тем, что относительные величины как простого электростатического притяжения между Комплексообразователями и лигандами, так и их взаимной целостности (включая дисперсионный эффект и образование ковалентных связей) differ. In труднодеформируемые комплексообразующие агенты, первый фактор играет главную роль, в результате чего наименьший размер (F〜) наиболее притягивается из равно заряженных ions.
In в случае легкодеформируемого комплексообразователя, напротив, основная роль принадлежит поляризационному взаимодействию, которое наиболее выражено в случае наиболее легкодеформируемых лигандов (I«).Имеется обзорная статьяо конкурентной корректировке лигандов. 58) несколько неожиданный результат достигается сравнением относительных интенсивностей координатных связей некоторых центральных атомов с O и S (с эквивалентной жесткостью).Сочетание сильных полей и низкой деформируемости, по-видимому, отдает предпочтение кислороду перед серой. С другой стороны, было показано, что координационная активность t1iv, Nbv и Tav с серой сильнее, чем с кислородом.
Ионы Ni1, Cu * \ Zn * \ Cd1 * близки по свойствам, первые 2 образуют более сильную связь с серой, а последние 2 (а также с Pd1*) образуют кислород. $ 8) если анденд представляет собой анионы кислородной кислоты, связывание с комплексообразователями обычно осуществляется через кислород. Комплексная связь в этом случае сильнее, взаимная поляризация между комплексообразователем и кислородом сильнее, то есть последний слабее за счет центрального атома самого аниона. Таким образом, проникновение комплекса на внутреннюю территорию гораздо более характерно для SOJ «I CoJ», чем для СУ7 и No, например. (Роль заряда центрального атома) или в случае CrOj «и найти. Д.. О * О. А., Б у LG и Р• * Я ч с. Б. ..
Успехи химии, 1972.М4. 6м. По сравнению с S04″ — COj » (роль объема центрального атома).Однако благоприятные условия для образования комплексов создаются только в хорошо известном (хотя и достаточно широком) диапазоне соотношений между прочностью Поли комплексообразователей и центральными атомами Анона. Нарушение этих соотношений в пользу последних приводит к легкому выводу аддуктов из Внутренней Сферы, в то время как их нарушение в пользу комплексообразователей приводит к разрушению аддуктов за счет расщепления кислорода, который остается только во Внутренней Сфере.
60) наличие постоянного диполя в ионном аддукте увеличивает прочность связи с комплексообразователем и увеличивает деформируемость комплексообразователя. Среди ионов, участвующих здесь, OH и CN-самые важные. Первый характеризуется большим, вероятно постоянным диполем и меньшим эффективным радиусом, а второй-более легкой деформируемостью. В обоих случаях может быть применена схема, описанная выше для Негалогенидных ионов:» используйте прямой CN, чем деформируемый», соединение с OH.
61) для фиксации легкодеформируемого придонного аддукта на внутренней сфере присущая комплексообразователю деформируемость может быть более важной, чем его поляризационное действие, например, резкое повышение устойчивости композита Nonon (3 (CN) «p -’ * К Hg.«При этом очень важна роль самодеформации центрального атома для фиксации CN», повышение стабильности низковалентного комплекса (более легко деформируемого), например, вообще говоря, Mo и W, которые характеризуются шестивалентностью, могут окисляться до максимального пятивалентного состояния с помощью композитного цианида. Что особенно интересно с этой точки зрения, так это то, что комплекс (например, K ^ fNifCNJJ) формально содержит центральный атом с нулевой валентностью.
62) притяжение нейтрального аддукта к комплексообразователю часто сопровождается резким уменьшением эффективного радиуса. Например, в кристаллической решетке аммиака эффективный радиус молекулы NH / it равен 1,80 а, а данные для non[NifNHj] * * * рассчитываются как всего 0,90 А. такое уплотнение должно соответствовать сильной адгезии аммиака к комплексообразователю, а следовательно, и высокой стабильности комплекса ions. In факт, некоторое солнце(NKNHsbJ * * около 200 63) с примерным расчетом эффективной поверхностной плотности положительного заряда(е / а), стоимость мг сейчас 0,27, в то время как ценность[MgfOHj], стоимостью**теперь 0.015.В результате было установлено, что гидратация катиона в 18 раз слабее, чем гидратация катиона.
64) из нейтральных дополнений, которые идут во внутреннюю область, мы чаще всего сталкиваемся с H20 и NHj. Обе молекулы Этна имеют примерно одинаковое отношение к OH и CN друг к другу. Вода характеризуется большими диполями и малыми объемами, амннак-большой деформируемостью. В комплексообразователях с относительно слабыми силовыми полями ориентация добавленной нейтральной надстройки играет доминирующую роль, а постоянные диполи являются наиболее важными для прочности сложных связей. Поэтому сложное соединение с водой в таких случаях будет сильнее, чем в случае с аммиаком.
Например, как видно из приведенных данных о солях лития: «I z p I дополнения о давлении пара (ke твердая соль и газ addandoa) (nr » 77°С) LiBr + 2HfO-LIBr•2Н20+ 30 put LJI-2H, 0 zt LibH, 0 + H, 0 4.6 g * Hg LiBr + 2NHj — = LiBr•2NH3 + 26 ккал Lil•2NH,^ t L1I-NHS + NHS 20 мл ртути. Искусство. Поскольку комплексообразователь, действующий на поляризатор, увеличивается (особенно мой собственный деформируемый), деформируемость дополнения начинает становиться более важной. Потому что аммиака гораздо больше、 С поляризацией индуцированный диполь становится для него больше, чем для water. As в результате добавления постоянного диполя и индуктивного диполя получается результирующий диполь.
Его величина в значительной степени определяет силу электростатической связи нейтрального аддукта относительно конкретного центрального атома. Из вышеизложенного следует, что в случае относительно слабого, едва поляризующего комплексообразователя(например, Ca9>) результирующее значение диполя должно быть больше для воды, а для сильной поляризации n оно легче деформируется по отношению к аммиаку(например, Cd’*).
Насколько велика внутренняя деформируемость комплексообразователя? (А) без учета s, это видно из результатов приближенных теоретических расчетов энергии комплексных добавлений HjO и NH»Ag * noi к Ag * noi. Рейкьявик АГ * 4-О » — » Ф АГ * о.]* +41.5 + 47 и поставить АГ * + НХ,-[АГ. NH * r,+ 40 +49 put Как вы можете видеть из этих daiyih. При отсутствии присущего варианта Ag* связь с водой будет более сильной, но на самом деле связь с аммиаком будет stronger. It следует отметить, что приведенные выше расчеты проводились без учета децентрализованного взаимодействия. Это также должно быть большим в случае аммиака.
65) по мере увеличения заряда и уменьшения радиуса комплексообразователя возрастает тенденция комбинированного добавления воды. Между тем, его новая электронная структура оболочки играет второстепенную роль. Последнее очевидно из того факта, что соли Ag *(1.13 A) и T1 *(1.49 A) кристаллизуются практически без воды. То есть он ведет себя как соли Na *(0.98 A), kr (1.33 A) и Rb *(1.49 A).Соль N»* (0,78 а) обычно кристаллизуется в том же количестве молекул воды, что и соль. Мг (0,78 а) и так on.
In сложное добавление воды подобным Ионом с относительно слабым полем соли, ориентация молекулы, а не деформация молекулы, будет самым важным. Когда в поле комплексообразующий агент дополнительно укреплены, связь молекул воды во Внутренней Сфере, как правило, застывает, и его ионизация является суб-химические, О-О«» О «+О * оо +2нф. Ионы соединений{Rh (NHjUOHJ и [Punhoeohjjj) сбалансированы в растворе(соответствующие значения констант диссоциации показаны справа); (Rh (NH) » OHar Z z±lRMNH.).Ор + ч- / с-ОО ^ ЛПТ(Нью-Хэмпшир)) эквивалентных часов эксплуатации, л — [Рt (НГ.) ой ой) * + ч * * −1 * IG4
Поэтому комплексное добавление воды характерно только для комплексообразователей, напряженность поля которых находится в пределах известного (очень широкого) диапазона. Например. K не образует стабильных кристаллогидратов из-за слишком малой напряженности поля, а P не образуется из-за слишком большой напряженности поля. cc) в отличие от воды для сложного добавления аммиака, структура внешней электронной оболочки комплексообразующих агентов очень important.
In в этом случае наиболее благоприятные условия создаются сочетанием сильного поляризационного действия и относительно легкой деформируемости комплексообразователя, что характерно для большинства ионов, с электролизом 18 и незавершенной оболочкой. Ионизация под действием аммиачной силы нулевого комплексообразователя (по схеме NH3 ^ NHJ + H и др.) гораздо менее характерна, чем вода, и не встречается много(особенно при взаимодействии NH3 и non-Hg). И Au * 4).Примерами, изученными с количественной стороны, являются следующие данные: [РЗ(NН3)эж〜 * ^ [й относительной влажности (НСЗ), р + у * ЯТ-1-10-1 *(Рt (NН3) е) — ^(PKNHJbNHtP +Н ’/С-1 −10— *
Значительное увеличение константы диссоциации при переходе от 1 катиона к 2 катионам обусловлено не только самим комплексообразующим агентом, но и положительным зарядом всего комплексного Иона, причем этот эффект сравнивается с ролью заряда самого комплексообразующего агента, но эффект прерывается не н, а в том же случае молекул воды).Напротив, при кислотной диссоциации Анона увеличение его суммарного отрицательного заряда сопровождается уменьшением величины соответствующего constant. It потому что облегчено обратное добавление отрезанных ионов H.
67) сравнение термической стабильности комплексных соединений, содержащих летучие аддукты, такие как NHj, HjO и др. могут быть оценены путем сравнения их давлений паров аддукта при одной и той же температуре или наоборот-путем сравнения температур, при которых достигаются различные давления паров. При использовании этого метода следует иметь в виду, что строго сопоставимый результат может быть получен только в том случае, если разложение рассматриваемого соединения протекает в соответствии с тем же самым scheme. So например, CaClt-8NH3 и CaBr?
Сравнение данных по-8NHj не дает достоверного результата, так как оба аммиака сначала разлагаются по разным схемам. Очевидно, что расщепление 4 молекул NH3 производит гораздо большее давление пара, чем расщепление 2 молекул NH3.Поэтому, если мы непосредственно сравниваем данные обоих аммиаков, то в случае CaCI-8NH3 сравнительная прочность связи между отдельными добавленными частицами и комплексообразователями недооценивается.
68) проблема термостабильности комплексов с нейтральными аддуктами очень сложна и может быть четко интерпретирована до сих пор даже в наиболее хорошо изученных случаях аммиака различных металлов, в том числе анионов C1 -, Br-и 1〜E. закономерности, очерченные практически на основе экспериментального материала этих соединений, сравниваются ниже. По числу конфигураций, допускаемых объемным соотношением, стабильность аммиака, как правило, возрастает с увеличением заряда и уменьшением объема комплексообразователя.
Например, аммиак Mg1 *(0,78 а) в целом стабилен. Меньший, чем Li *(0.78 A), Be ’*аммиак (0.34 A) более стабилен, чем Mg * 4.Аналогично, аммиак Co * 4 гораздо более стабилен, чем Co * 4.Однако, амиак Fe * 4 более стабилизирован чем Fe * 4.In во многих случаях с увеличением радиуса комплексообразователя происходит изменение относительной стабильности. Согласно номеру регулировки анализа.
Поэтому при большом количестве присоединенных молекул NH3 (10 nln 8) аммиак из более объемного Srt4 N Cd * 4 более стабилен, меньшее (менее 6 nl) — радиус Ca14 и Zn * \ В общем случае ионы аммиака с 18 электронами или несовершенной внешней оболочкой гораздо более стабильны, чем комплексообразователи аммиака со структурой инертного газа, когда заряд равен и радиус близок. Например, КР * аммиак(0,98 а) является несравненно более стабильным, чем на *аммиак (0,98 а) и Ni * 4 аммиак (0.78) является гораздо более стабильным, чем мг 1 *аммиака (0.78 а).
Закономерности о природе раздражающих внешних сфер более сложны. Здесь, для 8 электронных комплексообразователей, C! Наиболее часто наблюдается повышение стабильности вдоль ряда» — Br—I», а для 18 электронных комплексообразователей наблюдается снижение в том же ряду. Комплексообразователь с незаконченной внешней оболочкой ведет себя Различный. Например, стабильность аммиака (Ni (NH»)«] R «C1—Br—i Series) увеличивается, а аммиака[Pt (NHi) 4] r2 уменьшается. Зависимость от количества молекул NHj, присутствующих в комплексе, может проявляться очень резко. Кроме того, более мелкие из них обычно соответствуют указанным выше закономерностям. Чаще наоборот.
Среди аммиака Pb*+ бромид является наиболее стабильным в наиболее разнообразном количестве молекул NH * аммиака Be2*, а стабильность ряда C / — Br—I возрастает даже в количестве аналитических конфигураций, таких как 12 и 13.In в двух словах, все законы, описанные термической стабильностью аммиака, являются просто руководством на данный момент. 69) изложение общих законов термической стабильности кристаллогидратов еще более затруднительно, так как вода может связывать не только катионы, но и соли anions.
It можно лишь сказать, что увеличение заряда и уменьшение объема катионов обычно способствуют увеличению как количества воды в кристаллизующейся молекуле, так и прочности ее bonds. So например. К * соль. Rb и C » чаще всего выделяются в безводном состоянии, в то время как Ca является солью. С одной стороны Sr ’и Ba, φ (больший заряд), а с другой стороны соли U *(меньший объем) часто образуют стабильные кристаллогидраты. Приписывая кристаллическую воду любому из ионов, образующих определенные кристаллогидраты солей, они обычно руководствуются лишь общими соображениями об их химических свойствах и характерной для них частоте координации.
Поэтому в большинстве случаев комплексную формулу кристаллогидратов нельзя считать точно установленной, и правильнее сохранить обычное обозначение типа на бинарных соединениях с неизвестной структурой, например, Sn (NO|) t-20H20.In в целом, кристаллическая вода характеризуется поглощением при 3550-3200 см-1 (деформационная вибрация O-H) и 1630-1600 КТ *(деформационная вибрация H-O-H).Имеется обзорная статья о роли воды в составе кристаллических веществ.
70) только структурный анализ может точно показать распределение воды в кристаллогидратах. Однако также очень трудно определить местоположение молекулы воды из-за малого серийного номера элементов, образующих молекулу воды(XII§ 2, дополнительный 21).Имеющиеся до сих пор данные не всегда совпадают с предыдущими представлениями.
Например, для квасцов ранее было получено выражение типа(3(0Hf) u] (S04) fM или3(0 * H») e » M. Результаты рентгеноструктурного анализа являются структурными (3 (0H»)) e) (S04) j(M (0H)) i]. кроме того, в случае калиевых квасцов алюминиевые квасцы d (Al-OH)= 1,91, d (K-OHt) 2,98 а) аналогичное более равномерное распределение воды имеет тенденцию к выравниванию объема отдельных структурных элементов с ионными соединениями за счет комплексного присоединения нейтральных adducts.
In комплексы[Ni(NHJ) E] [CO(NHS)»(NO») 4] T он координационный номер 8 для ychnogo. 71) результаты структурных исследований некоторых аммизкатов выявляют их интересные особенности features. So для однородных октаэдрических комплексов (Ni (NH> MNOj) t) и (Ni (NH.) 4 (NCS).] расстояние N1-NH равно 2,07 n 2,15 A, а расстояние Ni-N (annon) равно 2, 15 и 2,07 A. So, в первом случае 6 атомов N октаэдра (с 4 молекулами NH на базовой плоскости) координируются с никелем и аммиаком, а комплексообразователь, близкий друг к другу, слегка растягивается в вертикальном направлении, а во втором случае октаэдр n слегка уплощается.
Обратите внимание, что результат не соответствует положению лиганда. нческий номер (приложение 96). Джей Ди.. Успешный химик. 1 * 56. 。\ Х. 5643. В. Н.. Ш » Г р О Л Н.. Достижения в области химии. 1173, 7 * 11.1937. * B Мл 72) [Co (NH»)$ Nj] в комплексе Nj вы можете легко увидеть структурные различия между 2 Азидами groups. In большая глобулярная область, оба расстояния d(NN) приблизительно одинаковы( 1.16 и 1.17 A), но существенно отличаются во Внутренней Сфере(1.15 n 1.21 A), в обоих случаях она отличается от параметров, характерных для молекулы HNj (IX§ 1 Добавление 94).
73) интересна структура йода йод, который устойчив только при низких температурах. В NH I-4NHj каждый водород иона аммония образует слабую релаксационную связь с аммиачным азотом[d (NN) −2.96 A], и соединение имеет структуру noi:[NH4(NHil4) l. HiftpOTHB, B нитрит NH I I I-3NH, 4-я водородная связь осуществляется в узле; структура имеет молекулярные свойства-INH4(NH.), I]. 74) некоторые комплексные соединения могут образовывать органические молекулы и KrStalLosolv&Ty. Со свойствами придатков (v§ 2 add.4).Хорошим примером является состав вещества Ni (CNh (NHs) (C» H$)), основная структура которого показана в RNS XIV-83.
При таком сочетании плоских слоев объемная структура[d(Nl — CN) L.?6, d (Nl-NC)-2.16,d(Nl — NH|) — = 2.06 A], его пустота расположена в молекуле CeHe, ее дисперсионное взаимодействие обеспечивает стабильность. Образование этого клатрата может быть использовано для извлечения Бейола из смеси очистки от углеводородов и примесей. Несмотря на то, что атом N1 и группа CN очень близки, молекула C«H не взаимодействует с ними. Таким образом, кажущееся расстояние между частицами в Кристалле само по себе не означает, что «валентность(или координация) связана». 75) интересным частным случаем является введение нейтрально-солевого ребенка во внутреннюю сферу.
Например. Co (NHj) sNCS при взаимодействии раствора J и AgNO образуется коричневое вещество состава ICo (NHj) iNCS(NO $ h-AgNOt. Эта формула должна соответствоватьCo (NHs) tNCSAg, есть нейтральная роданизированная молекула серебра во внутренней сфере, и многие другие подобные соединения также известны. 76) возможно, наиболее интересным из»двухслойных»комплексов тахкса (иногда называемых»Суперкомплексами») является продукт добавления BFj к цианиду.
В дополнение к 3atponyToro, ранее полученный молибден (добавление XI§ 1.68). Он также был приобретен для KHNlfChOJ n K4 [Fe (CN)e]. К этому необходимо добавить дополнение KfB (FSO») J (XI§ I.64), [Hg(SHgh) r, (XII§ 4 to*.114) и др. 77) иногда с этих позиций принимается во внимание более или менее сильная экстрасолярная Ассоциация. Например, схема [Pt (NH$) Jsd4 gg. ^ [Pt (NH.) 311 так что *равно 310, то есть этот парень очень стабилен.
Однако подобный случай характерен и для простых солей, содержащих поливалентные ионы. Пример: ThSO-s / C-5•10〜это так 78) в дополнение к воде и аммиаку, много других простых молекул, как HtS, PHj, SOa, могут появиться как нейтральные аддукты. Отдельно от рассматриваемого аддукта выделяется монооксид углерода, придающий ему некоторые характерные и достаточно устойчивые комплексы с некоторыми металлами. C N C C СС НХ, да? nHj \ / Я \ / — НЛ ^ Наике- / М и / » Т N с H3N Привет я Ц НЬЮ-ХЭМПШИР, С Я \ Я\’ — Ни-ни-Кан- 1 ′ С использованием H3N-N III III N C N N Я. Рисунок XIV-83.
Макет слоя NHCNfeNHj. 79) проблема внутренней структуры и причины устойчивости карбонила металла является одной из сложных проблем в теории сложных систем. compounds. Is это все еще невозможно? Он считается полностью утвержденным. Большинство исследователей, интерпретируя строение карбинов, исходят из концепции доиориоэ 2-го соединения (IX§ 2, 2). в этом случае молекула со считается донором, а атом металла-акцептором. Таким образом, каждая молекула со, связанная с атомом металла, увеличивает число своих внешних электронов на 2.
Образование соответствующих карбонильных соединений характерно только для некоторых элементов, расположенных в 5-10 рядах аналогов. Сравните наиболее распространенные выражения nx со следующими: В (Со) Е СГ (СО) в [МН(соевый * Fе (Со)), [Со (Со) 4] и Ni (СО) 4 МО (Колорадо) [ТС (со), л ру (Колорадо), [РЗ (Колорадо) 4Б ж (со) е [Ре(со) Эл ОА(со), [ИК (СО) 4]、 Для отвлечения внимания до сих пор из нестабильного в(СО) в простейших родственных соединений соответствуют типам СГ(со), Fе (СО)$и безлимит (со)<.
Атомы Cr имеют в общей сложности 16 электронов во внешнем слое атомов Fe −16 и Ni — 18 в 2. все рассматриваемые комплексные соединения становятся обладателями одинакового количества внешних электронов, поскольку каждая молекула cc добавляет еще 2 электрона. То есть, 26.Но это число равно общему числу электронов в обоих внешних слоях атомов инертного газа (26-18 + 8).Из этого делается вывод, что комплексообразующие атомы карбонила имеют тенденцию быть похожими на атомы следующего инертного газа (Kr-Cr, Fe, Ni) за счет своей электронной структуры. Эта ситуация также применима к соединениям, таким как Fe (CO) 4rt, Fe (CO) 4Hj, Co (CO) 4H и др. (поскольку он функционирует как донор, каждый атом G или H добавляет 1 электрон к внешней оболочке комплексообразователя). в результате следует невозможность присутствия такого производного никеля, а также моноядерных углеродов марганца и кобальта.
Поэтому состав простейших карбонильных производных трактуется очень четко(и только чисто формально Однако некоторые карбонильные производные[V (co) α, Fe (CO) jji и др.) не вписываются в эту формальность scheme. It также поднимает тревожные вопросы questions. In факт, например, в атоме хрома (Jft 24) недостаточно 12 электронов для реализации значительной конфигурации. Проблема заключается в том, что ядро с зарядом всего 24 единицы может притягивать 12 избыточных электронов, а ядро с зарядом 30 единиц, например цинк, притягивает только 6 электронов, которым не хватает атомов Zn, чтобы достичь того же криптографического состава.
Тем не менее, правило октета (VI§ 3 add.12) нарушения обнаруживаются в карбониле металла, особенно в impulse. It принципиально важно одновременно обнаружить принятие электронных пар в состояние, в котором лежат энергетические уровни центрального атома. 80) для соединений со стабильными внутренними сферами комбинированный заряд может быть определен экспериментально путем измерения электропроводности раствора солей, полученных из it. At при заданной молярной концентрации электропроводность раствора увеличивается, поэтому количество ионов, которые разлагает соль, увеличивается, принимая ее величину. Например, для NaCl на единицу приблизительно ty-это то же значение, что и любая другая соль типа MX с одновалентным нонамом.
Для типа соли MX «или * M» X вы можете видеть, что она примерно в 2 раза больше; для типа соли MXj или MjX-3-3. 5 раз и т. д. Решение, следующие значения относительной проводимости(для сравнения мы также покажем некоторые простые соли): 4.2 К «(Fе (СN) е] 4.7 LaCl、 3.2 3.2 KJFe (CN) e] 3.5 Нацмен л ЛПТ (Нецах), КЛ | JCL с 0.8 К (пт (Нью-Хэмпшир|) ХЛ » Джей 0.9 Спины、 2.2 [Ст (Нецах) eJCl4 (в PT (NHj)$ ХЛ)] clj по IP (в(НГ.) 4С! JCI1 1.9 К {Марка, Л2. » Найдя величину электропроводности раствора других устойчивых комплексов, они находят число отдельных ионов, с которыми он схлопывается, и отсюда находят валентность всего комплекса.
Если результаты химического анализа комплекса будут известны одновременно, то сразу станет ясно количество ионов аддуктов во внутренней сфере и количество ионов во внешней сфере. Поэтому измерение электропроводности раствора является одним из ключевых методов для выяснения структуры комплексных соединений. 1. 81) Как уже упоминалось выше (VII§ 5, дополнение 15), в результате неравномерного сочетания окисленной и восстановленной форм величина окислительно-восстановительного потенциала может сильно варьировать. Чаще всего такие сдвиги осуществляются из-за осложнений.
Например, в кислой среде потенциал системы[Fe (OHj) eJ *〜+ e * * fFe(OH») J»равен 0,77 дюйма. когда dipyrindnl будет добавлено, то система (FeDipyj) пойдет на » * ■е * * * * [Fetipyj]»потенциал 1.10 V, Если при добавлении спицы» — система (Fе (СN)J / л ’/ + + е * * {Fе(СN) е} » в потенциал 0.36 В. потенциальные сдвиги из-за того, что Цыганский Джилл прочно связывается Фе * \и-СН-решительно Фе*.Аналогичным образом, потенциал системы (со (НДИ) Эль+ е * * **(со (OHj)»] » равна 1.84 вольт, а система[ко (Нью-Хэмпшир.)|] — + е * * ко (Нью-Хэмпшир|) е]-всего 0,1 вольт.
Имеется обзорная статья о влиянии лигандов на окислительно-восстановительные свойства. 82) общие свойства кривых поглощения света ионами (Cr (NHj) el ’и (Cr (OHj) e] — показаны в XIV-84.Ион[Cr (NH|) (OH2) 5]-состав соединения сульфата квасцов глинозема(CsCr(SO») f * NHj llHjO).Однако эти кристаллы не были детально изучены. 83) особенности переходных элементов (дополнение 11) наиболее изучены с первыми крупнопериодными элементами (Sc — Ni, некоторые Cu).
Как и его аналоги в следующем периоде, атомы этих элементов характеризуются несовершенством (или низкой стабильностью) d-оболочки. Поэтому их тоже можно назвать d-elementam. By общие характеристики, они все металлические. 84) обычное состояние изолированного атома или иона переходного металла соответствует полному электронному занятию 5 квантовых ячеек d-слоя (VI§ 3 add. Я.)Если число свободных d-электронов меньше 10, то та или иная часть ячейки заполняется неспаренным электроном, что приводит к появлению парамагнетизма (§ 1, дополнительно 50).
Состояние, в котором число неспаренных электронов является наибольшим, называется состоянием с высоким спином, которое является наименьшим (равным нулю или 1) и является clocked. As как показано в примере, приведенном на Рис. 1, энергия перехода из высокоспинового (нормального) состояния в возбужденное (возбужденное) может быть очень разной. X1V — & 5.Вообще говоря. 600. Рисунок XIV-84.Поглощение кукурузы| Cr(.МНЭ » b1 ″ (L) и| Cr(OH.) D-(5). * Таубе г. и достижения в области химии. IBS9. ЛЛ 8.970. Состояние середины спины, которое может соответствовать. Например, переход rns. XIV-86.Однако для сложных соединений такое промежуточное состояние отсутствует.
Видимо малохарактерии. Для переходных металлов разных периодов разность энергий между высоким и низким спиновыми состояниями изменяется следующим образом: −4″5> 6. Cr24lthhhl \ U8W — (ППП1 (МП2 * / ♦ и H GPL + 77 ″ * Al — — — I / Tin I/…… + 59 pal-f 1m) nЧ1] Е♦Фе! * ч 1111♦| ♦ ♦1♦\ +90 ″ * Оль— | ч | ♦1♦1♦ Один * 1 «•• И< Один MP MCC | 1 2+ Ге * \ Т \ 7] 7 W ITNICHC * * JOk IL Рисунок XIV-8S. переход из состояния с высоким спином в состояние ieecospin. Рисунок XIV-86.Переход из состояния с высоким спином в состояние со средним спином. В комплексных производных элементов периода 5 и 6 парамагнетизм наблюдается редко. Имеется обзорная статьяо структуре комплексов электронных и переходных металлов. »»
86) переход из высоко-спинового состояния в низко-спиновое, связанный с потреблением энергии, сопровождается выделением части D-слоя cells. It будет полно Однако это происходит только тогда, когда взаимодействие их с центральным атомом достаточно сильно(rns. XIV-87). Оценивая это взаимодействие, мы обычно говорим о «силе лигандного поля», что не совсем верно. K»[CoFe]и [Co (NHj)из сравнения eJCIj уже знают. Напряженность поля не-F » поля определенно больше, чем молекула NH*.Однако, первый комплекс является парамагнитным (м Фи» В5.3.3), то есть Co5 * ионы, похоже, из-за большого взаимного отталкивания Ф «(видимо Ф » non-Иона.
Он сильнее взаимодействует с NH-ионов. Так ЛКО (NHj) е] CI3 диамагнитные и[co (NHj) Е] Ц!»Является парамагнитным (муфта 5.0).Это явно не разница между «напряженностью поля лиганда«.«**HX взаимодействие с Co и Co в nonah. In фактически, расстояние ядра d (CON) (CofNFIi)^ * N [CO (NHJ) I] OH n равно 1,94 A. 2.Равна второй 86) электронная структура центральных атомов комплексов [Co (NHs) e] Cls и K» [CoFe] «показана ниже (буква «l»обозначает клетку, занятую лигандом-Амином). 4Р как 4id 3 а [Со (NHj) е] Ди, jtiltllHl * ы м к [ЦОФ.) [нажмите 1 Дж | Т 1 ф / ГП Справа находится обычно используемое обозначение занятой рангонды на переполненном track.
It следует помнить, что свойства комплекса, описываемого такой траекторией, являются производными от его структуры, а не наоборот(X§ 2 add.7). interactbig- Ряса. XIV-87.Стабильные области комплексов с высоким спином (A) n и коспином (E). д * СПТ НПР * Нюхач Р. С.. Успехи в химии. 1ЭМ, НТ.3, 54. 87) одно время предполагалось, что свойства кагнита однозначно определяют тип связи между центральным атомом и лигандом. )- Ионный. Тем не менее, оказывается, что стандарты tyya magyy для сложной коммуникации не считаются спорными или универсальными applicable. It правильнее рассмотреть вопрос о характере связи в более общем виде, исходя из возможности согласования лиганда данной Внутренней Сферы с центральным атомом (IX§ 2-Добавление 3).
88) Co * 4, а также аммиак, диамагнитный Ион (Co (OHj) e)**. в то же время из смешанных комплексов[CoF8(NH8) j}является диамагнитным, а a(CoFj (OHt) j] — парамагнитным. −4.5).Систематическое изучение магнитных свойств многих аналогично настроенных никелевых комплексов выявило наличие как донных, так и парамагнитных compounds. In в целом, четырехкоординатный Ni2 * характеризуется следующими структурами 3д 4п mmitiitm Li_l | л | л | Н | Тл Л | * | Л 1 dsp3 магнитный Характер координации исследуемых комплексов приведен ниже, что указывает на количество случаев обнаружения парамагнитного дна.
Ов е н жо Н4 м С4.О X X X X X Дэвид Бегно из CBS News внес свой вклад в этот отчет. Под-8 7 3- Пара b в 5 I I В результате энергетические свойства высокосортных и низкопробных комплексов иногда могут быть очень близки друг к другу * сравните с рисунком XlV * 87.По-видимому, в некоторых случаях возможно их равновесное е-существование(или промежуточное состояние центрального атома). 89) комплексы, различающиеся по составу только в экзосфере-черные (Co (NHj) sNO) Clj N красные (Co (NH$) » NOJ(NOs)» — оказались сначала парамагнитными (M » ff 1.7), затем диамагнитными.
Исходя из спектральных данных, предполагалось, что в первом примере связи Co и N0 образовывались через азот, а во втором примере-через кислород. Возможно, это связано с влиянием природы высших сфер. Мы также обнаружили, что некоторые сложные производные диамагнетизма Niyel в твердом состоянии становятся парамагнитными при растворении в органическом растворителе (обычно связанном с переходом от dnmer к Мономеру).
Высокое состояние атомов железа гемоглобина (M, fph—4,9) обусловлено добавлением кислорода, окиси углерода、 90) s-если электронное облако (орбиталь) электрона представляет собой шар. Также р-электрон представляет собой гантель(рис. х-25), А Д-электрические орбиты имеют форму плоской 4-лепестковой розетки. По отношению к координатным осям ( * , y, g) такие гнезда могут быть расположены двумя различными способами-между ними или одним, и другим, причем возможен первый тип расположения 3( d, M) и 3 секунды (dy, xi, d? указывается в > lx).Но для частных лиц характеристики 5 клеток d-слоя требуют 6, но 5 разных мест.
Поэтому замените розетки и сформированные из них гибриды С. С. 3> <с структура, обозначенная D ^5 D траектории все общие виды отображаются в rns. X1V-88.Из них координатные оси (dX9.In в большинстве случаев то, что находится между ними (Dw DdtK), часто объединяется обозначением ttg. Или ДТ. А те, что расположены вдоль этих осей(по обозначению dxt_ ^ t, d2ij-ev или dY -. считается, что» D-орбита сильно не перекрывается » (Coulson). tfyz & ТХ Рисунок XIV-aa. Д-орбитальная схема принадлежит ей. 01) в то время как атомы или ионы переходных металлов находятся в изолированном состоянии, энергии 5 d-орбиталей являются всеми same.
As мы говорим, что в таких случаях орбита вырождается (точнее, она вырождается в 5 раз). Ситуация зависит от наличия лигандов. Например, предположим, что он расположен в квадрате октаэдра, ориентированного вдоль координатных осей (рис. X1V-89). Последняя ориентация между осями (ту. Illn dt) является более энергоэффективным, чем тот, который расположен вдоль оси (например, illn < / у).Аналогично для других видов регулирования устанавливается относительная энергетическая рентабельность различных направлений овала РФ.
Наиболее важный случай общая схема□предоставляется RNS. XIV-90 (пунктирные линии соответствуют 5 вырожденным d-орбиталям). как видно из рисунка, взаимодействие с лигандом в целом увеличивает энергетический уровень свободных d-орбиталей центрального атома. tfj-7-й / Джи При одних и тех же условиях они одинаковы в разных структурах. Отношение между октаэдром и тетраэдром является самым простым, 5-градусный вырожденный уровень делится на 3-градусный вырожденный (dxt, dgg, d») и 2-градусный вырожденный (ddi_yu dxt).Разница в энергии расщепления уровня октаэдра гораздо больше энергии тетраэдра(при равных условиях я = «а / «адо»).Если структура не является правильной, может произойти дальнейшее разделение уровня.
92) общая энергетическая рентабельность деления зависит от количества свободных d-электронов, доступных для комплексообразователей. Для октаэдра формула(+ 0.4n-O. bt где nn * m-число электронов, занимающих Нижний (fjf) и верхний (s) уровни деления. Джи. пользовательский интерфейс Р «и. XIV-VE. Координатные оси октаэдров. — АВД. — 4г. Огненный шар♦ — QIA Сухой. Икс Аху Кюн МГУ Nghymru ■ 0,6& АХ2.У2 аг2 тетраэдр площади dxz все dyz успешно(ту)
Бесплатно МФУ IV-90.Схема относительного энергетического уровня D орбитали. Фигура Laine (аналогичное выражение для обратного знака справедливо для регулярного тетраэдра) 83) каждый электрон стремится занять самый неэнергетический энергетический уровень, поэтому он накапливается последовательно, поэтому он получает следующее значение полной расщепленной энергии (доля D0). количество радиочастотных электронов. 。 。 I 2 3 4 5 6 7 8 9 S Комплекс высокого отжима•0.4 0.8 1.2 0.6 0 0.4 0.8 1.2 0.8 0 Комплекс низкого отжима 0.4 0.8 1.2 1.6 2.0 2.4 1.8 1.2 0.8 0 94) абсолютное значение C0 (и, следовательно, полная энергия деления) зависит от природы как комплексообразователя, так и лиганда.
Они обычно обнаруживаются на основе оптических данных путем корреляции электронного перехода между максимумом поглощения и уровнем разделения. Например, из того, что отображается в rns. XIV-91 спектр non (Ti (OHx) J J* -.Мы можем видеть, что максимум поглощения^с полем 1 D составляет около 4900 A или 20300 sr1.In в данном случае она составляет 58 ккал / моль(размазывание максимального значения происходит за счет суперпозиции энергии колебательного движения).Это поглощение отвечает за пурпурный цвет водного раствора ticl. 95) для многих комплексообразователей сравниваются также значения D0 и H20 в качестве лиганда: Комолексовообразов- В» ЗБ «мл» Ре «ко » Н1″ с » 3 4 5 6 7•8 9 36 40 22 30 27 24 36 Т ш VIII вида ХГ «’МП ’» Ре — » со ’» РЗ ’» I 2 3 4 5 6 6 58 51 50 60 39 53 77
Низкие спиновые NS этих комплексов являются только производными Co111 и RhI. Как видно из представленных данных, в случае трехвалентных комплексообразователей величина D0 больше, чем в случае двухвалентных, но четкой зависимости от числа РЧ-электронов не наблюдается. Важно отметить, что D0 резко возрастает при переходе от Co111 к Rh! I. аналогичное увеличение происходит с низким спиновым Галогенидом RhnI n 1rrrh. In в данном случае это Д0-54 и 66 (Br -) или 58 и 71 (CI -) ккал / моль. Для всей серии Co1P-Rh, n-Ir111 это хорошо видно в комплексе этилендиамина: D0-67 (Co), 98 4(Rh), 118(Ir) ккал / моль.
По-видимому, такое увеличение к аналогичной производной сверху вниз по вертикали периодической системы является общей закономерностью. 96) до тех пор, пока природа зависимости лиганда не была очень четко определена revealed. It образует так называемый лиганд. Спектральный диапазон: Я» в
\ Си » / FioA |э 7000 6000 Пять тысяч долларов (.000 л 22 млрд〜 ’ А потом!20 / в 20 рис. XIV-9I. поглощенный Ион[Т1 (ОН2)/ 1″. ^Число электронов К. ккал / моль…
Комолексообразова-тел••••••• Количество 4 электронов К. ккал / моль. •• Сделать 20(Бр}.21 (С1 -).24 (ю).В качестве примера численного значения может быть использована производная Ni11 от 31 (NH$), 33 (En) ккал / моль или 39 Cr1. (CI»), 50(Н, 0), 62(NH»).63 (En), 75 (CN -) ккал /моль. Для комплексных цианидных комплексов» Fe » и Co111 значения D0 составляют 94 и 97 ккал / моль соответственно.
То есть они несколько крупнее, чем в случае высокоспинового сложного голубого соединения Cr111.Особое внимание следует обратить на высокие значения D0-69 (Br〜) и 83 (C1〜) ккал / моль низкоразмерного комплекса Pt. Эффект лигандов заключается главным образом в том, что они могут идти далеко к центральному атому. 97) деление уровня D центрального атома влияет на многие свойства соединений переходных металлов. Прежде всего, главное-учесть влияние на эффективность ионного radius.
In в этом случае сравниваемые объекты должны иметь электронные симметрии асферики, такие как Ca2 + (/jej). Mn2 * N Zn2 + + (/2g J J J).Потому что в октаэдрической среде находится ioia / egorbital. Между лигандами и EV-orbntali-против ^Их, заполните в первую очередь, внести свой вклад ближе с * С4 Нью лиганда с центральным атомом, и наполнил В. N4 йена вторая-люфт для Лнгандов. След \ Четыреста восемнадцать И Сэн в ЧР млн ФО СП. использование znxlV ’92 VDU» от Ca до Mn » от im до Zn * Pc. X1Y-92.Эффект » КТМ » Ай «РМ»УСМ» у*™?0 ″ ожидаемое изменение Иои е * \ ПРВ ионный радиус сферической симметрии.
Как? Из рисунка видно, что экспериментальные данные другого E * 4 находятся ниже пунктирной линии. при основном заполнении орбиталей ФСФ деление приводит к уменьшению эффективного радиуса. Характер аномальных «2 горбов» экспериментальной кривой, где минимальное значение равно* Ni24″) отражает противоположный эффект заполненных орбиталей tu и et. Хотя ценность полученного соответствия несколько снижается тем, что радиус, о котором идет речь, условен(XII§ 2 add.56), но все же очень важно.
98) значения Ди-открытой энергии (D) ряда CA-Zn высокоспиновых шестикоординатных и двухвалентных ионов могут быть вычислены из приведенных выше данных. ля.«**……. Nm Sc Tl V Cg Mn Fe Co N1 Cu Zn Л, clalC-Иона. * 0?? 43 24 0 12 22 29 22 0 Строго говоря, эти величины действительны только для взаимодействия с HjO, но в качестве индикатора они могут быть использованы и в других случаях. 99) в качестве примера XIV-93 и XIV-94 приведены 2 Характеристики. Их экспериментальное значение (X) является «неправильным» (°) путем вычитания энергии расщепления из them. As как видно из рисунка, после такой»коррекции» зависимость обоих свойств от атомного номера элемента становится практически linear.
As в результате,»2-й» ход экспериментальных данных обусловлен именно суперпозицией энергий расщепления (но их доля в абсолютном значении рассматриваемых свойств (см. Вертикальные координаты) составляет лишь несколько процентов).в то же время ов является естественным результатом»2-го»хода изменений эффективного ионного радиуса (рис. XIV-92). 100) в теории следует ожидать, что присутствие свободных d-электронов в Центральном атоме повлияет на различную геометрическую структуру соединения и устранит вырождение обантала из правильной формы (т. е. эффект пряжи-Теллера).Обычно это влияние незначительно и часто перекрывается с другими, более важными факторами(дополнительные 29).
Однако、 в / — — — — мы » пропорционально \ / «Будут ли эти или другие орбитали уменьшаться、 Н^ / 、、、、、、、、、увеличение эффективного радиуса. Фигура Правильная форма круга иногда появляется и не налить! У D-электронов центрального атома. Пример ПЦ1 $молекуле(рис. 1Х-46).
101) влияние такого деления на различные свойства материи, происходящее под влиянием Lngands, с расщеплением энергетического уровня центрального атома d-орбиталей, объединяется под названием «Теория кристаллического поля». как видно из вышесказанного, эта теория открыла возможность количественного подхода к интерпретации цвета соединений переходных металлов, что позволило понять некоторые другие особенности.
Под влиянием этих успехов иногда возникает преувеличенная оценка его значимости как теоретической основы химии комплексных соединений observed. In кроме того,» часто ошибочно полагают, что способность к комплексообразованию ограничена переходными металлами » (Бейлар). 500. В * 50- Сок. J_I_I_I_1_I ГП КК Тл в СГ млн Фе так Ки Си 2П Рисунок XIV-93.Энергия гидратации ионов » EI (ккал / г-Ион). \ / ° / .U Да. Икс.«В» / Год ДЖ-1-Я-1-1_L J_1_J Ка-ка Тл в ЗБ млн Фе совместно Н1 Си 2л НОКАУТ 6СС- Пятьсот пятьдесят Рисунок X1V-94.
Энергия кристаллической решетки 3clj(ккал / моль). Такие выражения не верны в двух основных принципах. Прежде всего, теория кристаллического поля может быть применена только к частям комплексных соединений, в которых центральный атом содержит свободный d electrons. So, а не только все производные»нетранзитивных» элементов (B, Si, Sn, Sb, Hg и др.), но и многих стран с переходной экономикой деривативов (СК+, ТУ4+, nb5 и и т. д.) исключаются из рассмотрения.
С другой стороны, энергетический эффект деления невелик (более 10%) по сравнению с полной энергией образования комплекса. Таким образом,» применимость теории кристаллического Поли ограничена проблемой, не зависящей от абсолютной энергии » (O pre l).Таким образом, теория кристаллического поля играет не ведущую роль в химии комплексных соединений, а вспомогательную роль. Это ценная часть общей теории координации.
102) как видно из вышеизложенного, теория кристаллического полимера рассматривает только электронное состояние центрального атома и не рассматривает электронное состояние лиганда. Так называемый подход направлен на устранение этой односторонности. Теория поля лиганда, которая использует молекулярно-орбитальный метод для ее построения (VI§ 3 дополнение.
14). следует отметить, что теория поля кристалла иногда ошибочно связана с электростатической природой координатной связи, а теория поля лиганда связана с теорией ковалентной связи. bond. In фактически, любая из этих доминирующих личностей определяется тем, как они используются в интерпретации и энергии взаимодействия между комплексирующим агентом и lngandamn. на РНС.
XIV-95 в качестве примера показана схема молекулярных орбиталей 2 октаэдрических комплексов. Возможность электронных переходов между различными энергетическими уровнями может быть коррелирована с максимумом поглощения spectrum. In в простейшем случае (пока применим только количественный подход) это дает лучшее приближение, чем возможно с точки зрения теории кристаллического поля. Однако такие улучшения достигаются за счет значительного улучшения устного перевода.
103) иногда высказывается предположение, что теория лигандного поля (то есть интерпретация методом молекулярной орбитали) не только дополняет, но и заменяет общую теорию координационных (n-валентных) связей. Теоретическая основа осуществимости такой альтернативы могла бы служить убедительной демонстрацией преимуществ новой теории в интерпретации основной общей проблемы химических веществ.
С другой стороны, апологет метода молекулярной сферы объявляется его апологетами только в принципе, и обычно он рассматривается как самоцель (т. е. без широкой связи с химическими веществами*), и мало что существенно для неорганической химической идентификации. ЦДХ\ Г> ГП-Т 4 секунды \\ EftV-НШ] ч > 3д Икс Вы будете. И // // ВР в / 1с0гвг г-、\ — С / т \\ В * * В. В. y * * * — дешево В Нтип* [Со (NH3U3 И* (Pppshp СС / .3+ И 6F » Рисунок XIV-95.
Схема молекулярных орбиталей высокоспиновых и не спин комплексов. Достижения, которые могут быть представлены таким образом, относятся к отдельному человеку questions. In в общем, прежде чем люди, не заинтересованные в ней, примут новую теорию, в ее применении нужно сначала оценить возможность коэффициента эффективности этой теории по отношению к множеству задач (то есть, грубо говоря, отношение ожидаемого результата к ожидаемому результату).
Очевидно, что для химии комплексных соединений теория кристаллического поля в настоящее время характеризуется достаточно высокой эффективностью, а теория полных лигандов-низкой. Однако следует отметить, что обычно первый из них включается во второй. По теории лигандного поля (в этом обобщенном смысле) существует монография и обзорная статья. 104) подобно d-орбиталям, f-Орбитал-Тали характерен для лантаноидов и актинидов и может расщепляться в кристаллическом поле. Однако из-за глубокого расположения атомов их влияние на свойства материи значительно меньше. * ..Адресу: <адрес>.Пример: Грей г. химические связи electrons. In английский. М. Е. Дятел. М. Мир. 967. Страница 234 * *
Преа л. введение в химию переходных металлов (теория Полилигандов).С английского, Изд. М. Е. Дятькина. М..«Мир», 1964. 210 секунд Балчуик к. введение теории в область ligands. In английский. М. Е. Дяткилой. М..«Мир», 1964. 360 секунд Берсукер И. Б. структура и свойства координационных соединений. Введение в теорию. Л. ..«Химия.» 1971 год. 312 С. •• *% % Т T L. E. ..Достижения в области химии. 1959 год. NV 3. 265. Грей Г. Б. советы по химии. 1965,.V » 4, 755. основная форма / — орловталов-объемная розетка из 8 листьев. Например, он обозначается как/ xxx, а лепестки направлены к углам Куба (рисунок XVV-96).
При гибридизации такого овнала можно получить форму с небольшим количеством лепестков (до аналогичного dz). всего было намечено 14 возможных х вариантов, но для индивидуальных характеристик квантовой ячейки слоя/достаточно будет только 7. 105) » для объяснения многих проблем комплексообразования часто предполагается образование l связей между металлами и некоторыми лигандами. Однако, существует очень мало экспериментальных доказательств этой гипотезы«(Найхолм).
Такая связь между центральным атомом и лигандом p — или rf-orbnthalamn (X§ 2, add.18) схема показана в rns. XIV-97.Если одна из взаимодействующих орбиталей заполнена, а другая свободна, то полученная N-связь обладает донорно-акцепторным свойством, называемым нативным. существует обзорная статья о нескольких облигациях, связанных с d-орбиталями. 106) прочность таких L-связей невелика. комплексы, образованные nx («l-комплексы»), могут выступать в качестве промежуточных продуктов той или иной реакции, но сами они, в принципе, нестабильны. Нормальное, l соединение ФБ’ptt fтр-БЮТ ФГ-сайт djr
Правая сторона. XIV-97.Схема типов самосоединений. В сложной конфигурации они играют не самостоятельную, а вспомогательную роль. Например, Фе(для pf5)$(§ 1 добавить. В 99), дата с-> взаимодействие Фе между свободными Д-orbntals и П-бесплатная д-orbntamines атомов Fe, наряду с донорно-акцепторных o связи, может произойти. Предполагается, что это позволит не только усилить координационную связь, а также частично отменить формальные негативные комплекса основных(ІХ§ 2 дополнительных 4).
Свободные свободные орбитали иногда считаются акцептором связи даты(VI§ 3).14).Например, в ферроканде. в дополнение к о-регистрация ИП-> — СН, наличие обратного присоединиться Фе — * — CN-это также возможно. В этом случае акцептором является рыхление орбиту СN номера.»Однако недавние (1971) нестрогие теоретические результаты расчета [Ni (CN) <p-«критически рассматривают»родное«взаимодействие между электронами металла и полосами лангундарло, ранее принятое в качественной форме.«
Итак, я тыкаю) у меня есть обзорная статья и специальная монография о комплексе 107) n-связи могут играть более или менее важную роль во взаимодействии 2 или более центральных атомов. г Рисунок XIV-96.Орбитальные подъемники по схеме fxu2. 6 мат •F в f » G ..Сто ночей успеха. 1957, 0.4″ 9.1060. * * D ytk shia M. E. успехи в химии. 1058. НР Я, 57. B и E А. М. Эт.. Достижения в области химии. 1066. .В » 2. 303. Г р и К и А. А. Д.. Осипов О. О. Об И.. М и И И И С. И.. Достижения в области химии. 1066. Л » 10. 1782 год.* «Fisher E. Veriere G, I-комплексы металлов. Транс. из » Орла.»
Под редакцией И. Ф. Луценко, а, «мир».1968. 2 с. XIV-98 в качестве примера показывает структуру Анона [RejCl»] * » (и его солнце KjRejCle-2HtO).Небольшое расстояние Re-Re (2.24 a до 2.74 a металла), по-видимому, является ключевой прочностью этой связи. Аналогичный Ион Ittccij1 ’[d (TcTc)= 2,13, d(TcCl) » 2,35 A]предполагает, что существует даже четырехкратная связь между 2 атомами технеция(тип o + 2l + b).Малые расстояния между атомами в таких случаях обусловлены не высокой прочностью связей между атомами, а общим составом кристаллической решетки, из-за чего исключаются и атомы(см.
Дополнительно 22).[ResClit] 4 ’анион (CsReCI<) кристаллическая структура, равносторонний треугольник атомов рения[d (Re Re) 2.43 A, и три РО Кв Рисунок XIV-9B Неструктурный(RetClgj. XLV-99.Троя и ее(ReaClial5. О-ки РНС. Различные расстояния Re-CI [dx — «2.35, dt =» 2.50, d » −2.60 A].Для комплексов, содержащих прямые связи металл-металл, было предложено название кластера. Есть обзорные статьи о них. 108) в металлическом карбоноле (дополнительно 79) следует также учитывать донорно-акцепторную связь ОС-м, а также обратную связь между металлом RF-orbntalamn и свободно-разрыхляющими орбиталями молекулы,-связь ОС * * м. ^ Окись углерода. Одновременное наличие как прямой, так и обратной связи OS M Я («Синергетический эффект»), с этой точки зрения, является главным стабилизирующим фактором.
Основную роль в его формировании играет взаимодействие, поскольку для рассматриваемых сложных связей среднее значение направления OC-fM= = 0,8 составляет found. In с точки зрения общей прочности, эта сложная компоновка не превосходит обычную простую компоновку. 109) некоторые особенности вещества иногда объясняют наличие l-связей. Например, было высказано предположение, что линейность группы Si — O-Si non-SltOj-обусловлена существованием связи между орбиталями электронной пары свободного кислорода и кремниевыми орбиталями неба (см. Дополнительно 17).Но возможен и другой подход.
С точки зрения изолированных ионов Si, Oj и всего кристалла cake-wait тщательное Рентгеноструктурное исследование подтвердило линейность группы Si-O-Si(см. Дополнительные 22). 110) как и в случае nntrnto — + — nntro, в родий — палладиевых комплексах наблюдалась спонтанная перегруппировка типа Pd — SCN Pd-NCS(§ 2, доп. 97).Еще один интересный пример: manganese-Penta-carbonyl-thiocyanate. In твердое состояние, структура которого[Mn (CO)» SCN», в растворе ацетонитрила [Mn (CO)$ NCS], в хлороформе, характеризуется наличием равновесных смесей обеих форм.
На основании изучения инфракрасных спектров ICo (NH>) sSiOj был сделан вывод, что в 90% частиц StOj〜содержащий кобальт связывается через кислород, а в 10% — серу. «» * L’you with J. Success, chemistry. 1 ″ В7, М 5.347.К и Ф от него. А.. Успехи химии, 1967, м. 10. 1799 год. Бирюков Б, Г.,, Стручков Ю. Та химический успех* 1В70,.В * 9. 1672 год. 111) случай координационной изомерии комплексов, выделенных в основном тексте, был количественно описан studied. In решение получается, что существует равновесие по схеме ВТОРОЙ ИЖ ИЖ ИЖ ВТОРОЙ [Pt (NH.) » r. f [PtCl.] «[РТ(НСЗ)4Cur + [PtCl4 [*б * с д На него отвечает следующая константа: [s] [d \ J [a] [>] — 8500. 112) в качестве частного случая координирующей изомерии можно рассмотреть замену комплексообразующего агента экзосферными катионами.
Подобными изомерами могут быть, например, зеленый Ni [Zn (CN)»l и желтый Zn (Ni (CN))«).При хранении первые соединения этих соединений самопроизвольно реорганизуются во вторые. Еще более широкое толкование позволяет рассматривать в качестве координационного изомера, например[NHiOHJlHfPO) (гидроксифосфат гидроксамурана) и (NHiXlhPOj) (фосфит аммония).Можно выделить довольно большое количество изомеров этого типа.
113) в дополнение к случаю различных изомеров, комплексные соединения часто указывают на присутствие полимеров, то есть на присутствие 2 или более веществ с одинаковыми пропорциями состава и разной молекулярной массой. weights. An примером полимерного комплекса является производное платины, состав которого соответствует формуле (PtCb-2NH). / т т структура| Пт (НФЗ) jCla] ФПТ(НГ | ОУЗ | [ст (НГ.) с! J] [PUNHjbCIWPtCNl {Pt (NH$) «| [PtCl » / IPKNHibl IPUNHdCUlt соединения, соответствующие l-2 или N ММ 3, стоят между ними относительно координационной изомерии.
Полимер тесно связан с последним. Например, по схеме, как это вытекает из возможности перехода из N » = 2 до N-1, (РТ (nh1 мужской) 4) КБ]-*■2(Пт(NHj) JCL с *].Как показывает опыт, когда[Пт (Нью-Хэмпшир») 4lPtCl]нагревается до 290°С, это[ ПТ (Нью-Хэмпшир)) с КБ).Имеется обзорная статья по полимерному координационному соединению. 114) растворимость изомера (Pt (NH3) jCl2]составляет 2,5 (цис) или 0,4(транс) г!
При 25°C это L H30.Менее энергоемкая предпочтительная форма ЦНС преобразуется в трансформаторный тип с выделением тепла (3 ккал / моль) при температуре около 170°С. слабый нагрев ЦИС-типа под высоким давлением приводит к образованию зеленых соединений. Это димер — [Pt (NHj)] [PtCl4]. 115) состав внутренних сфер цис-транс изомеров одинаков, но различия в пространственном расположении лигандов влияют на многие свойства соответствующих complexes.
As приведен пример количественно изученной зависимости поглощения света от цис-транс изомерии рясы. XIV-I00 содержит данные по 1 из сложенных этиленом кобальтовых комплексов. 116) следующие результаты (ккал / моль) были получены при расчете теплоты (в растворе) для образования внутренних сфер некоторых цис-транс-изомерных комплексонов. ИМК — [со (НХЛ) 4сл, Р МКК-lCofNHjMNOab] ’ 30.2 53.9 TpaHc — {Co (NH|) 4Cl, R trans- [Co(1 ^ Ne) 4(MO ./ ) с в J2. 0 53.1
Как показывают данные, разница в теплоте образования очень мала. есть специальные монографии на термохимия complex1 соединений * Х а я Д у г И. Успей химии. 1961, м. 9, 1124. «Яиииирский А К, Б, термохимия комплексных соединений, м. Академия Наук СССР. J951, 251 с、 117) зеркало противоположного пола может occur. As как видно из рисунка X1V-101, этот вид пространственной изомерии характеризуется именно им. Оба изомера-в данном случае производные комплексных анионов [CrfCsO ^ sJ3], как они есть, представляют собой объекты в их зеркальном отражении(например, правая и левая рука) и не могут быть соединены вместе вращением.
По большинству физико-химических свойств, зеркальные сальто не могут отличить друг от друга. Однако это различие отчетливо проявляется в отношении оптического свойства 1 НС (вращения плоскости поляризации). следует отметить, что активность зеркальных изомеров также часто оказывается очень разной. Рисунок XIV-I00.Эффект цис-транс XIV-I0I. Иллюстрация противоположного пола в Эль-Калбе、
Изомеры света и поглощения света. 118) если во Внутренней Сфере октаэдра имеется 6 различных лигандов, то теоретически он может иметь пространственные изомеры 16 (и −30) С учетом оптической активности. Примерами таких комплексов являются соединения| Пт (CsH5N) (Нью-Гемпшира) (01) (Бр) (я) (ч0.)]. 119) наиболее ярко транс-эффект (И. И. Черняев, 1926) проявляется в соединениях двухвалентной платины. Ряд лигандов, выделенных экспериментально на основе этого в основной функции, имеют следующий вид: Ч «> ХГ»> со> п0> N07> я «> сюжетные программы〜> Бр〜> СГ> о»> НХ,> ч, 0
Это означает, что если 2 члена ряда расположены вместе, то 1 слева поможет удалить 1 справа от внутренней сферы, а 1 справа зафиксирует левую часть Внутренней Сферы. Например, из комплекса[Pt (NOj) Clj)»стоя в положении, расположенном на NO«хлор удаляется легче, чем из других 2. есть монография о трансе-вланяння. 120) дислокации также обнаружены в производных PtIV, Cosh, Rh «1, 1gr, Pd» и некоторых комплексах рутения.
Хотя относительное положение галогенид-анионов в ряду реакционной способности этих различных комплексообразователей, по-видимому, не изменяется («I> Br »> C1′), другие лиганды часто локализуются. Например, CN «<1 — и NOJ I > noj и рутений в CN» <он -.Мощная Транслигандная группа (примитивная связь Si-Pt) SiR была обнаружена в комплексе ptiv с сильно трансэффективным производным фосфора типа PRj из этилена, мочевины и органики, обычно наблюдаемым. 121) существует множество попыток теоретической интерпретации транс-влияния, 1 из которых явно не универсально применим и не очень удовлетворителен.
Схема впервые (1935) показана в rns. XIV-102. Она начинается с представления о главном значении влияния на врожденную деформируемость комплексообразующих агентов. Расположение симметрично построенного однородного комплекса одно и то же, но、 * Эссен Л. Н. геометрическая идемсула и Трис валиення.. М. «Наука», 1969. 117 секунд.、 Химические свойства лиганда (х в данном примере), которые могут сопровождаться локальной деформацией электронной оболочки центрального атома, но возникающие при этом отдельные диполи полностью компенсируются друг с другом, а силовое поле комплексообразователя в целом остается прежним(РНС.5£1 \ M02L) все направления регулировки (изотропные).В гетерогенных комплексах ситуация иная.
Из-за различных взаимодействий между различными лигандами (X и Y) и центральным атомом отдельные диполи, возникающие в последнем, не могут быть полностью компенсированы друг для друга, но полученные диполи усиливаются их присутствием, ослабляя в одном направлении и в противоположном направлении(рисунок X1V-102 / J).Таким образом, силовое поле комплексообразователей в гетерогенных комплексах обычно неодинаково в разных направлениях (анизотропия).
Очевидно, что для данной структуры внутренней сферы анизотропия таких полей должна быть выражена настолько сильно, насколько больше внутренняя деформируемость комплексообразующего агента. Рисунок X1V-I03.Сложная сборка в неоднородном комплексе > схема смещения атомного ядра масленки. Ряса. XIV-102.Первая схема транс-влияния. Прочность связи отдельных лигандов х и комплексообразователей по-разному влияет на анизотропию поля. X в цис положении Y. фактически не испытывает его действия, но связь с Комплексообразующим агентом в дислокации Y ланганда ослабляется(как на рисунке XIV-102, Б) или наоборот усиливается.
Поэтому влияние одного лиганда на прочность другой комплексной связи должно наиболее ярко проявляться в обеих дислокациях. Аналогичные соображения могут быть в полной мере применены к октаэдрическому расположению комплекса с координационным числом 6. 122) основным значением транс-влиннни является не односторонняя деформация комплексообразующего агента, а часть смещения из центрального положения в любое из них по отношению ко всем лигандам(rns. XIV-103).Потому что при таких перемещениях может возникать не только электростатический эффект.
И с появлением ковалентных связей эта интерпретация Транс-влияния сохраняет свое значение и преимущественно ковалентную природу внутренней области. Действительно, даже очень малый подход комплексообразователей для 1 лиганда и расстояние от противоположного могут значительно усилить начальную связь и ослабить 2-ю связь. 123) XIV-103 из рисунка следует, что степень выраженности эффектов транса должна в какой-то мере зависеть от характера цисингвида(а).Они более сильно связаны с комплексообразователями. Еще более сложным является смещение ядра n. result.
No менее выраженный трансформатор effect. It следует подчеркнуть, что изменение энергии сложной связи, вызванное ею, во много раз меньше ее общей прочности. Соотношение энергий здесь примерно такое же, как и при делении уровня центрального атома полиольного лиганда(дополнительный 101). 124) исходя из наличия транс-влияния, иногда можно понять явление, которое совершенно непонятно без учета it.
As в качестве примера рассмотрим химическое образование центральной нервной системы-транс-изомер комплекса [Pt (NHj) jCl2). Как показывает опыт, за счет действия аммиака на KJPtCl формируется центральная нервная система. Таким образом, реакция протекает по схеме. ГС1 ГС1 ЗС Нью-Хэмпшир, 1 — Пт + 2nh, — Пт ЛКИ ди джей ЛКИ nhJ + 2КС1 С другой стороны, когда [Pt (NHj) 4] Clj обрабатывают кислотой, в соответствии со схемой образуется транс-изомер. TNH, NH, 1 HS1 NH, 1 Pt CU + 2HCI-Pt + 2NH » Cl. Lnh, Нью-Хэмпшир, Lnh Джей, Ди Джей Таким образом, начиная с Иона[PtCIJ1 -, получают только цис -, и только транс-изомер получают из Иона lPt(NH>) J’.
С точки зрения приведенного выше объяснения Транс-распространенности эти экспериментальные результаты можно интерпретировать следующим образом: поскольку взаимодействие Pt *и хлора должно быть сильнее, чем NH, (замена 1 хлора PtCl P〜аммиаком закрепит комплексную связь хлора в торговом положении замененного).Напротив, хлор nz, находящийся в центральной нервной системе, ослабит связи, занимающие дислокацию NH при замене молекулы аммиака[Pt (NHj) J1 *1 nz по той же причине. Таким образом, 2-й хлор входит в трансовое положение в 1-й хлор.
125) реакции замещения во внутренней области комплексного соединения (с положительным центральным атомом), в общем случае S.?1 и S. Вы можете действовать в соответствии с обоими типами в v2(X§ 2 add.11).Например, как видно из следующей схемы, переходное состояние (IV§ 2 add.11) предполагается, что они различны в обоих случаях. [Со (№ 1, В М〜+ А’ + * [Ко (Нью-Хэмпшир.), АБ] * [Со (МН|) * АГ + Б ’ [Котнх. ББР-Ф ’ В первом случае сначала освобождается расположение Внутренней Сферы (электролитическим dssociaqiang), а затем происходит замещение, но во втором случае первый комплекс сначала добавляет дополнительные лиганды, а затем отсекает избыток только для характерного координационного числа этого комплекса.
Таким образом, по схеме диссоциации (S * l) возникает промежуточный комплекс с координационным числом 5, связыванием (S * 2), координационным числом 7, порядок, в котором экспериментально найденная реакция еще не определяет ее истинных молекулярных свойств(iv§ 2).3), очень трудно установить фактическую химию процесса по большей части. Для реакции замещения комплекса существуют обзорные статьии специальная монография. х 126) состав Внутренней Сферы часто сопровождается изомеризацией. Например, в случае аквакультуры по схеме (Co (NH.) 4C1*) * + H, 0-4Co (NH.),»CI (OH.) J- + -fСГ, исходный изомер лотка (ci, С1) преобразуется в центральную нервную систему. кеомер (о, о»).
Напротив, обработка wtc — (co (NH|) 4 (NOj) и сильной соляной кислотой приводит к образованию TpaHC- [Co (NHs) 4Cls}. изомеризация может происходить за счет испарения водного раствора ’ nHc-[Co (En) s (no) sCl) * выделяются транс-изомеры. * Blue to D. D-успех » химия. 1 МБ, ФК.10.303. ** LangfordK, Greve G, Kmslmk процесс Лиги. П»*.С Английского, Эд. К. В. Яой мир. М. » Мер.«1969.150 секунд Кеннеди и Дж.. Тейлор К.. Том о’Салливан, Д. Реакцяа координация соединений переходных металлов. Пер на английском языке.. А. Н. под Ермаковым. М.; «Мир», 1970.393 секунды
127) как указывалось ранее в работе (1937), изомеризация комплекса co111 хорошо понимается на основе следующих понятий схемы S * 1 и сравнительной скорости возможной трансформации промежуточных участков координационных комплексов: замещения>изомеризация>конститутивные изменения. Если мы знаем относительные транс-эффекты лиганда, и какой из них является наиболее нестабильным, мы можем теоретически наметить направление изомеризации.
128) степень сложности преобразования менее стабильных пространственных изомеров в более стабильные формы сильно зависит от природы комплексообразователей и является наибольшей в производных платины. Таким образом, в цис-растворах транс-наномер[Pt (NH«) jClj] сохраняет свое расположение в течение произвольного времени, тогда как не-lPd (NHj) 3Cljl имеет ярко выраженную тенденцию к спонтанному переходу в транс-тип.
129) зависимость гидротермальной скорости от природы ингаидеров, выходящих из внутреннего кольца, изучалась реакцией: [Co (NHj) tX] — 4-HjO [Co (NHa)eOHa] — X \эта скорость изменялась в соответствии со следующей серией лигандов: НСО; >нет. > Р > Ш «> Н АО> СГ> так п-> р > СН, соо〜> Н КС»> нет; 130) поскольку реакции комплексных соединений обычно протекают в растворах (большинство из них водные), то оценка устойчивости внутренней сферы, как правило, относится именно к растворенному состоянию. По этому вопросу есть обзоры и специальные монографии.
Для некоторых комплексообразующих агентов была достаточно подробно установлена серия аддуктов эффективной прочности композитной связи (в водном растворе).Таким образом, для Pta* мы получаем следующий набор анионов 1-валентности: N0 ″ < pH -; 4. 410. * * Решение Шлефер Г. Л. Komplekhooobraoveovie. So-Эд. А. А. Гринберг. М..«Химия.» 1961.379 п. Россоттш Ф.. Россотти Х. определение возрастающих констант устойчивости и равновесия в растворе, Пер, англ. Эд. Д. I.
In дополнение, Рибчякова, М. Мир, 1966, 564 С. Фактически, концентрация аммиака 0,01-1,0 м является основной формой Тетраамина. 133) очень подробно разработана теория равновесия аммиачного раствора, основанная на следующей общей формуле для последовательных неустойчивых констант: Ф3(Нецах)«.][НГН, л—[3 <НХ、) «] Некоторые числа K%показаны в сводке. Ад. Zn3 * Cd * Cu » Nl3 * Co2 * Coj4 n I 2 3 4 5 6 6-й «4 мес» * 4 6-U » 1 1.4 2L 5.0 9.9 20 4.10 ’4-10 «З-Ю’ 3 МО ’ 3 2.5-10 «3 8.10«®4.10 «* N0 » 1 2.1 46 7. Ю-5 3-У «4 МО» 3 7-у » 3 1,5-КГ * 6-У «3 2-10» * 6-У «1 2-У» * 1 9-10 «* 8.10 „2“ S〜* 9 * 10〜* 2-мне очень жаль. U » 1 7. Кг1 4.2 5-l0 — * 2-10 «’8-J0» 7 2-U «* 9.10 »* 4-U » 1
Как видно из этого резюме, значение K * позволяет сначала рассчитать стабильность комплексного аммиака по общему значению Km с различными максимальными координационными числами (Ag. Потенциал для этого, чтобы быть по сравнению с другими продуктами (такими, как синь Колорадо) расширяется. С увеличением последнего, то есть с увеличением количества молекул аммиака, уже присутствующих во Внутренней Сфере, вероятность их удаления, как правило, возрастает (увеличение величины/ с).
Но в цинке происходит реальное растворение в непрерывной константе, а в стабильности происходит даже реверсирование стабильности. Если во Внутренней Сфере есть 2 молекулы аммиака, расщепление NH более затруднено, чем если бы их было только 1.Если мы сравним ход изменений КП с различными комплексообразователями, то получим интересные результаты. Например, прочность связи первых 4 молекул аммиака в комплексах Cd и Ni примерно одинакова, но в следующих 2 очень different.
As известно, что координационный никель характеризуется координационным числом 6 в комплексном аммиаке и 4 в кадмии. Магний обычно дает только очень нестабильный аммиак, но координационное число 6 более характерно, чем кадмий. 134) ранее (IX§ 2 исх.11), уже указывалось, что количественные характеристики устойчивости той или иной внутренней сферы в водном растворе часто задаются величиной общей константы неустойчивости соответствующего комплекса.
Это значение верно оценивает общую устойчивость Внутренней Сферы, но не отражает действительного равновесия ее dissociation. In дело в том, что состав внутренней сферы не меняется полностью сразу. Напротив, она всегда протекает шаг за шагом и обратима, то есть аналогична электролитической диссоциации многоосновной кислоты. Число последовательных неустойчивых констант имеет справочную монографию•*.
135)в научной литературе следует отметить, что прочность внутренних областей комплексных соединений часто характеризуется константами нестационарности. * Bierrum Йа. Образование Аминов металлов в водных растворах. Теория обратимого шага reactions. In английский. И. В. Тианаева. М.. Публикация. Ц1. 308 С. * * Яцнмирский А. К. Б. Васильев В. П. Константа и стабильность комплексных соединений. М..
Издательство Академии Наук СССР. 1969.206 п. Константа (стабильность) образования, которая является обратной константой (диссоциация) образования. instability. In кроме того, нумерация последовательных констант очень часто осуществляется не в диссоциации, а в дополнительном порядке этого дополнения. Например, для комплекса{Cu (NHe) 4] «*、 [КР] [NHal4 ГРУ (NHag) * — Ешьте[CU (NH.) 4],^ » ICU-HNHJ *
Константа диссоциации по схеме* Это связано с разницей в исходном положении. Когда рассматривать основные комбинированные педагоги\ t. It естественно сказать, что это непрерывная константа (то есть Ki в приведенном выше примере), которая нумеруется в порядке сложения (то есть ионы, в которых, как правило, образуется комплекс), константа (стабильность) образования и сложения (то есть Ki в приведенном выше примере).
Напротив, если рассматривать его в целом как крупный комплекс (эквивалентный молекуле), то естественно говорить о константах диссоциации (неустойчивости), а их непрерывные значения, подобно многоосновным кислотам, должны быть пронумерованы в порядке расщепления лиганда(т. е. В приведенном выше примере-ACi).Первый подход чаще используется в специализированной литературе по комплексным соединениям, но второй подход более точен с общехимической точки зрения, поскольку основной единицей химии являются молекулы.
136) возможно, рекомендуется называть нестабильными константами только те значения, которые суммируют эту внутреннюю сферу(например、 K (Ci) INH3] \ ^ ^вызовите последовательное изменение шага koi — [C «(NHS) 4]) По состоянию диссоциации. Большинство значений, описанных в литературе для этих величин, основаны на концентрации (v§ 5 add.29) и был рассчитан для различных ионных сил раствора. Строго говоря, эти N значений должны использоваться для различных сравнений, но они являются equivalent.
In теория, экстраполирующая их на q 0 во всех случаях, была бы наиболее правильной(см. Рисунок V-17). 137)для сравнительной количественной характеристики средней прочности комплексных связей в однородном комплексе используется формула R = (Ки * КТ * К%…) *«K], l, где K-обычная полная константа неустойчивости (IX§ 2, дополнение 11), где n-координационное число Комплексообразующего агента.
Такая средняя константа неустойчивости (K) удобна тем, что даже если отдельные значения Kp неизвестны, данные внутренней сферы с различными номерами настройки могут быть непосредственно сопоставлены. 138) определение химии и первая часть науки о веществах и их превращениях (i§ 1) никоим образом не ограничивает совокупность свойств рассматриваемых соединений.
2-я часть определения непосредственно не ограничивает его, но ставит вопрос об относительной значимости различных свойств для кинетики химических превращений. В качестве предмета исследования свойства веществ можно разделить на 3 группы.1 из них включает свойства агрегата, то есть свойства, присущие частице агрегата (например, фазовый переход).Другая группа включает характеристику молекулярных свойств, то есть характеристику всей молекулы(например, потенциал ионизации).
Наконец, внутримолекулярные свойства относятся к 3-й группе. То есть она характеризует отдельные части молекулы (например, энергию связи).Относительную значимость этих 3 групп для динамики химических превращений можно приблизительно оценить в следующей серии.
Молекула > молекула > > флокуляция. Другая сторона вопроса касается индивидуального характера самой собственности. Некоторые из них (например, цвет) являются ндентальными- Когда вещество используется, другие вещества (например, кислотная ось) определяют реакционную способность соединения. Очевидно, что оба типа свойств не эквивалентны hnmnn.
Поскольку свойства веществ разнообразны, естественно, что различные теоретические подходы к их интерпретации сосуществуют и дополняют друг друга other. At в то же время вполне естественно, что главная роль должна принадлежать стране, которая может лучше интерпретировать наиболее важные характеристики в той или иной области. Излишне говорить, что способность предсказывать этот подход очень важна.«Окончательная проверка научной теории-это способность надежно предсказывать» (Рэй т.
Смотрите также:
| Семейство железа | Периодический закон как основа химической систематики |
| Платиновые металлы | Элементы в химии |

