Оглавление:


































Поляризация ионов
- Поляризация ионов. Рассматривая различные случаи взаимодействия ионов друг с другом в предыдущем разделе, нас интересовал только общий результат (образование определенных соединений, кристаллических решеток и т.), и не учитывали внутренних изменений самих частиц, взаимодействующих под действием электрического поля соседних ионов.
- Однако эти изменения не только происходят, но и существенно влияют на химическое поведение рассматриваемых частиц. Поэтому рассмотрение влияния электрического поля на ионы является дальнейшим шагом к более глубокому пониманию фактического материала неорганической химии. ’-3 In в этом случае Ион с постоянным диполем (OH -, CN-и др.) ведет себя как полярная молекула, а Ион без постоянного диполя (большинство, особенно все элементные ионы) ведет себя как неполярный.
Что касается общего закона поляризации, то все вышеперечисленное (III§ 7) в отношении молекулы может быть перенесено на ioi. Людмила Фирмаль
Поляризация ионов элемента выражается в относительном смещении его ядра и электронов. Потому что их внутренние слои связаны с ядрами, которые не менее прочны по сравнению с внешней оболочкой электрона.、 * McMidlam J. успехи в химии. 1964, к» 3. 334. Этот процесс можно несколько упростить и представить себе таким образом, что только последний смещается относительно ядра под действием электрического поля (рис. XII1-54).
Подобная интерпретация поляризации как варианта внешней электронной оболочки оказывается весьма удобной при рассмотрении многих свойств ионов. Деформируемость элементарных ионов позволяет выделить следующие общие закономерности: 1. Деформируемость ионов с 18 электронами и незаконченной внешней оболочкой значительно больше, чем у ионов типа инертного газа с таким же зарядом и близким радиусом. 2.
In такая же структура электронной оболочки (горизонтальный ряд периодической системы), недеформируемость быстро уменьшается с уменьшением отрицательного значения и увеличением положительного заряда. Например, он будет деформирован: О2 «> Е»> Небраска > На * > МД2 *> Ал3 *> Си * 3.As количество электронных слоев в ионах аналогичной структуры (вертикальные ряды периодической системы) увеличивается, быстро возрастает их деформируемость. Например, он будет деформирован: Ли * < Н * <К4 < РБ * <КС и F «<кф < Ш <я» 4.
Уменьшение положительного заряда ионов и увеличение отрицательного заряда (п. 2), в то время как увеличение числа электронных слоев (п. 3) сопровождается увеличением радиуса, поэтому деформируемость возрастает с увеличением радиуса, о котором можно сказать, что это одни и те же или сходно составленные ионы. Из вышесказанного видно, что, как правило, большое количество элементарных анионов (Br〜, I», S3 ″ и др.) легче всего деформируется, а наиболее трудно деформируются малые катионы (Li+, Be+, A15) с электронной структурой инертного газа. * И так далее).* —
12 в основном неповрежденные ионы (а также молекулы и атомы) являются «твердыми», легко деформируемыми ионами-иногда их называют»мягкими». С другой стороны, когда ионы становятся большими и малыми и деформируются во внешнем поле, каждый ион сам становится источником электрического поля, и поляризационный эффект оказывается на соседние частицы. Этот эффект очень важен, потому что напряженность поля вблизи IOIA очень высока.
Восемнадцать Зависимость поляризационного действия отдельных элементов от структуры может быть выражена в виде следующих общих положений: 1.Поляризационный эффект ионов быстро возрастает с увеличением заряда. 。 — 2.Большое значение имеет структура внешней электронной оболочки. По этому критерию ионы грубо делятся на 3 класса, и каждый последующий setellis Paribus(заряд/радиус) обладает более сильным поляризационным эффектом, чем предыдущий. a)IOI с 8 электронными наружными слоями; ©б Рисунок XSh-54.Схема деформации внешней электронной оболочки.
б) ионы с незаконченным внешним слоем, переходящим от 8 до 18 электронов (Mn2+, Fe2+, Fe^ и др.).Очевидно, что нони (Li+, Be2* и др.) и 18 + 2 и 8 + 2 внешних электронных структур (Tl+, Sn2, P3 и др.) типа гелия также принадлежат здесь. в) ионы с внешним слоем из 18 электронов (например, Zn2 \ Ag). 3.
Структура внешней электронной оболочки одинакова и равна Заряд, поляризационный эффект ионов, увеличивается с уменьшением радиуса. Однако это общее правило требует ограничений, которые непосредственно вытекают из несколько более низких, упомянутых ранее. Четыре-、 Из сложных ионов необходимо обрабатывать анионы почти исключительно.
Из-за большого эффективного радиуса(например, NC7-2.19 A), Число xSh-55.Схематическое действие комплексных анионов сравнимо с обратным дематомаро. С другой стороны, их деформируемость при образовании ионов в целом также является общей small. In при следующем сравнении некоторых одновалентных и двухвалентных анионов обнаруживается повышенная деформируемость. ..4«… Ф. «.. N07… Н20… О.» .. CN… СГ… Br… .. Г… … ТАК.Н2О•..Я люблю тебя… о.〜.. с...
Для сравнения, молекулы воды также включены в оба ряда. Когда 2 противоположно заряженных Иона взаимодействуют, они обычно трансформируются другими ионами (рис. XIII-55).Но поляризационный эффект анионов имеет мало значения(малый заряд, большой радиус, внешняя оболочка из 8 электронов).Деформируемость катиона, в общем случае, относительно невелика.
Таким образом, в большинстве случаев поляризационный эффект анионов на катионы незначителен, и можно рассматривать только влияние катионов на анионы. °Однако, если сильно поляризованный катион легко деформируется в то же время, положение значительно изменится. Относительно большой диполь (а, рис.8 КШ-56), индуцированный им с анионами, значительно усиливает поляризационный эффект анионов, поэтому анионы начинают значительно деформировать катионы(Б, рис. XIII-56).
Но нарождающаяся цифра XIII-56.Дипольная катионная схема усиливает поляризацию доммы, добавляя к анионам и так далее. Следовательно, для такого поля общий эффект обусловлен дополнительным эффектом поляризации. Поляризация анионов намного больше, чем если бы катион имел меньшую деформируемость, а суммарная поляризация катионов намного больше, чем если бы анион имел меньшую деформируемость(B, рисунок XSh-56).Оба Иона, так сказать, притягивают дополнительные поляризационные силы своей собственной слабостью.
Сочетание сильного поляризационного действия и относительно легкой собственной деформируемости особенно характерно для низкозарядных катионов с 18-электронным внешним слоем. Из-за значительного увеличения деформируемости при переходе сверху вниз (Zn2 + — Hg2h и др.) в той же подгруппе периодической системы、 В этом же направлении дополнительный эффект поляризации увеличивается еще больше rapidly.
So, когда радиус 18 электронных катионов одного типа увеличивается (при движении в подгруппе сверху вниз), суммарный поляризационный эффект не только ослабевает, но даже значительно возрастает. Из вышеизложенного следует, что подобные отклонения от нормы в ходе изменения поляризационного действия подгруппы должны проявляться тем резче, чем больше деформируемость анионов, взаимодействующих с этой серией из 18 электронных катионов.
Двадцать Взаимная поляризация приводит к образованию диполей, которые увеличивают растягивающее усилие между ионами, и поэтому ожидается, что это повлияет на свойства солей, которые зависят от этих растягивающих свойств. forces. In дело в том, что, например, максимум 10% от общей энергии, выделяемой при образовании солей из энергетических элементов, происходит за счет взаимной поляризации ионов.2122.
Поляризационная составляющая теплоты образования некоторых гидридов особенно велика, что обусловлено особыми свойствами ионов Н+.Ионы Н , представляющие собой»голые» протоны ничтожного размера, воздействуют на анионы свободными электронами, проникающими в их электронные оболочки, а не извне, в отличие от всех других катионов. Например, если радиус С1-1,81 а, то расстояние между ядром водорода и хлором в молекуле HCl составляет всего 1,28 А. Таким образом, ионы водорода проникают на глубину С1, примерно на 3 мин 1 ее эффективного радиуса. Притяжение H электронами C1 ″ компенсируется отталкиванием его ядра.
Естественно, включение таких спонтанных анионов H4 в электронную оболочку должно включать высвобождение дополнительной (по сравнению с другими катионами) энергии, которая будет влиять на теплоту соединения молибдена с водородом, значительно увеличивая его ценность для тех, кто, как ожидалось, не пострадает от рассматриваемой ситуации. В дополнение к простому включению в анионы, ионы H +имеют сильное влияние поляризации на раковине электрона и привлекают электрический центр gravity.
An важным следствием совместного действия обоих этих факторов является резкое снижение полярности соединения водорода по сравнению с аналогичными производными других катионов. Относительная важность обоих эффектов (вставки и поляризации) может быть прослежена в Примере HCI. Если и того, и другого не происходит, то длина диполя HC1 должна быть равна расстоянию между центрами положительных и отрицательных ионов, то есть сумме радиусов. Поскольку радиус H * пренебрежимо мал, длина диполя HC1 равна радиусу C1〜(1.81 A).С введением он уменьшается до 1.28 А. Но на самом деле диполь HCI намного короче по длине, а именно 0.22 А.
поэтому дальнейшее уменьшение этой полярности связано с эффектом поляризации. С другой стороны, когда H *входит в анион, общий положительный заряд внутри аниона увеличивается, поэтому внешняя электронная оболочка имеет фиксированный effect. An важным следствием этого является снижение деформируемости элементарных анионов при введении ионов Н *.Таким образом, например, деформируемость HC1 меньше, чем у SC, и показанная закономерность сохраняется, даже если некоторые ионы H *не опосредованы непрерывно Аноном.
Следовательно, деформируемость O2 ″ > OH-> H20> H3O * .Двадцать пять В отличие от одностороннего воздействия внешнего электрического поля на ионы, рассмотренные до сих пор, в кристаллической решетке соли происходит несколько одновременных поляризационных эффектов непосредственно рядом с it. As в результате этой многогранной деформации внешняя электронная оболочка рассматриваемого Иона испытывает несколько симметричных искажений в схематически очень преувеличенной форме Показано на фиг. ХІІІ-57.2 * — 2С ® О Если бы не было поляризационного взаимодействия между ионами、
Виды рекристаллизации Решетка ионных соединений должна определяться только числом структурных единиц и соотношением их размеров(XII§ 2). Один-РНС. XIII-57.Образец многостороннего совместного поляризации воспроизводится non-деформация. Она играет важную роль в образовании кристаллов, а иногда сильно влияет на выбор того или иного типа решетки кристаллизующимся веществом.
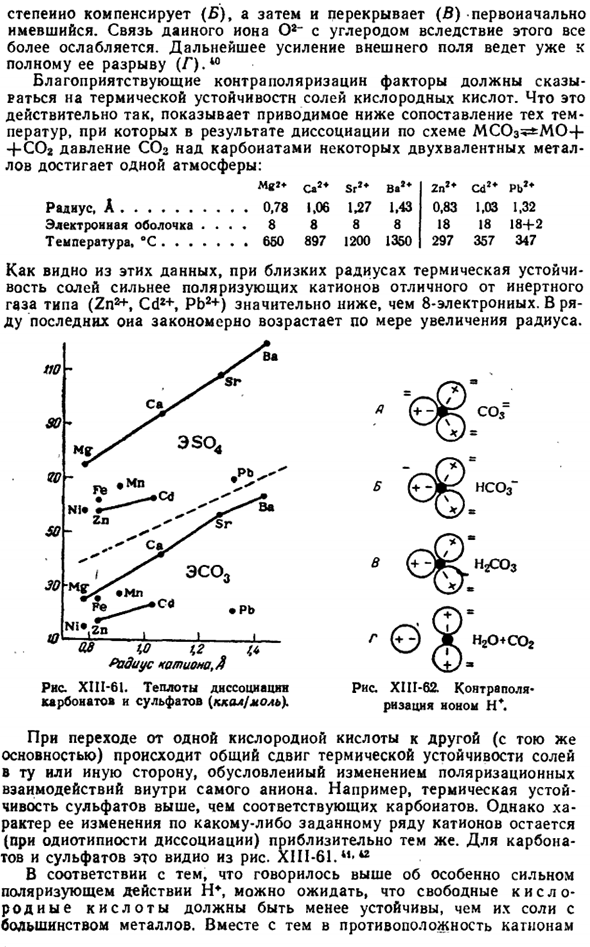
Чтобы прояснить общий характер этого эффекта, рассмотрим схемы, показанные на схемах. XII1-58.Если кристаллические ионы зафиксированы фиксированным образом, то в результате многогранного поляризационного действия соседних ионов любой из них должен всегда испытывать строго симметричную деформацию внешнего электрона shell. In этот случай характеризуется отсутствием диполей в целом из ионов (а, рисунок XII1-58), так как диполи, индуцированные соседними ионами, полностью компенсируют друг друга. Но на самом деле ион совершит 0. © Q©©Q©©0© А 6.* ©© Рисунок XIII-5 и схема влияния ионной поляризации на тип кристаллической структуры. В непрерывном вибрирующем движении Кристалла.
Очевидно, что такие колебания ионов связаны с временным изменением расстояния между Ионом и его отдельными соседними частицами, что должно немедленно повлиять на появление диполя, возникающего в результате Иона(B, рис. XI11-58).Даже если рассматриваемый Ион притянется к ближайшему соседу своего противоположного знака, его влияние не позволит ему нарушить нормальный характер колебательного движения иона, и Ион вернется в исходное положение (L).Исходная структура кристаллической решетки не изменяется. Если поляризационный эффект в окрестности данного Иона и его собственная деформируемость велики, то Iiache имеет место.
Диполи существенных следствий, возникающих в этом случае, увеличивают притяжение к ближайшему соседу рассматриваемых ионов, поэтому нарушается регулярный характер колебательного движения. © Далее происходит сближение обоих ионов, что неизбежно влечет за собой перестройку всей кристаллической структуры, которая считается первым Кристаллом structure. As в результате такой перегруппировки (Б, рис. XIII-58) рассматриваемые ионы оказываются симметрично окруженными ионами противоположного знака, но их число меньше и находится на более близком расстоянии.
Из вышесказанного следует, что по мере усиления поляризационного взаимодействия ионов расстояние между ними становится короче, а при достижении известного критического значения тип кристаллической структуры быстро изменяется, и характеристики координационного числа должны уменьшаться accordingly. In в частности, в бинарных соединениях увеличение взаимной поляризации ионов должно способствовать переходу множества структур. CsCl type-NAC NaCI type — ♦ZnS Type-молекулярная решетка.
На самом деле, например, в случае галогенированных солей серебра имеются следующие данные: Информацию Agci Агбр АГЛ Д сетки, Как сумма ионных радиусов….. 3.09 2.94 3.33 Согласно опыту…….. 2.77 2.88 2.99 Ионный подход в результате деформации, А…………… 0.17 0.21 0.34 Быстрое увеличение приближения ионов при переходе от AgBr к Agl обусловлено изменением структуры: в отличие от других галогенидов Ag+, кристаллизующихся в виде NaCl, иодид серебра имеет решетку типа ZnS (соотношение RK / Ra). Очень возможно кристаллизовать в зависимости от типа Agl. Соленая вода.)Конструктивные изменения ©^^^, Потому что тур проходит здесь®(?)) ^ 4J7 ^ C1 — — Br-I-деформируемость аниона. @ / Т \хороший обратный пример ^ зависимость структуры случая Рисунок XIII-59.
Приведена схема влияния температуры на поляризационное действие Ca-поляризации в кристаллической решетке. показано сравнение тионооксидов Mg * +и Zn^. В то время как оксид магния с соотношением Rk / Ra = 0,59 кристаллизуется по типу NaCI, оксид цинка с еще большим соотношением Rk / Ra = 0,63 кристаллизуется по типу ZnS. Исходя только из соотношения радиусов, можно ожидать обратного. Фактическое положение-Mg2 +(8-электронный слой).По сравнению с 2 * —
34, из-за большого поляризационного эффекта Zn2 +(18-электронный внешний слой). В дополнение к свойствам ионов, которые формируют сами кристаллы, температура имеет важное значение для выбора типа решетки. Роль этого фактора хорошо видна из рассмотрения рисунка. XII1-59.At при низких температурах (а) амплитуда колебаний отдельных частиц в кристалле относительно невелика, а колебательные ионы не удаляются далеко от симметричного среднего положения в решетке.
Диполи индукции, возникающие при колебаниях, малы и нарушают симметрию кристаллов, поэтому они не могут притягивать ионы к своим ближайшим neighbors. In напротив, при высоких температурах (в) диапазон колебаний частиц значительно увеличивается. Больше. Каждый из ионов в процессе колебаний становится очень близким к противоположно заряженным ионам, что делает его гораздо более поляризованным.
Значительный индуктивный диполь, обусловленный этой поляризацией, может быть достаточным для того, чтобы вызвать одностороннее втягивание рассматриваемых ионов и, следовательно, изменение кристаллической структуры. Таким образом, повышение температуры создает благоприятные условия для усиления односторонней деформации, и тем самым способствует переходу ряда кристаллических структур, связанных с уменьшением числа координаций.
Например, когда CsCI нагревается до 470 ° С, эта соль изменяет структуру типичного Центрального Куба (координационное число— CN — 8) в нормальных условиях на структуру, подобную хлориду натрия (CN 6).Поэтому нагревание действует аналогично охлаждению, заменяя более слабые поляризованные ионы более сильными поляризованными или деформируемыми ионами и более твердыми и более легко деформируемыми ионами, в то время как охлаждение-наоборот.
Когда кристалл нагревается дальше, ее плавления в конечном итоге произойти. То есть упорядоченная среда ионов изменяется более хаотично или более хаотично (хотя она до сих пор широко используется в обычных солях), по-видимому, легкость такого перехода, которая качественно характеризуется температурой плавления вещества, должна зависеть от всех факторов, определяющих напряжение между ионами в растворе. crystals.
As в результате в однотипной кристаллической структуре, в общем случае, температура плавления вещества тем выше, чем больше заряд ионов и тем меньше радиус. Это особенно заметно на примере LiF (mp 848°С) и MgO (mp 2850°C), которые кристаллизуются эквивалентно с натрием chloride. In дело в том, что при одинаковом радиусе аналогичного Иона заряд каждого из них увеличивается. Это приводит к повышению температуры плавления вещества на 2000°C.
Взаимная поляризация ионов также оказывает существенное влияние на плавкость substances. In тот же тип, кристаллизация почти равной D решетки (2.81 и 2.77 A) NaCl (mp.800°C) и AgCI (mp. Из сравнения 457°C) видно, что этот эффект направлен в следующем направлении: более низкая температура плавления. Последняя ситуация полностью согласуется с разработанными выше идеями, результатом которых является известная аналогия между усиленным поляризационным взаимодействием и heating. In связь с ним, его температура плавления ниже.
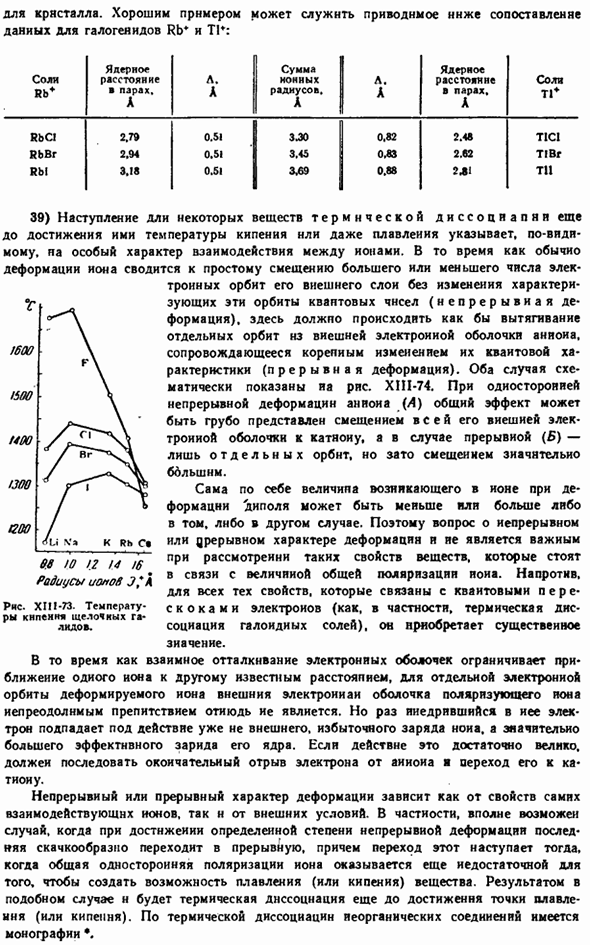
Из вышеизложенного следует следующее общее правило: температура плавления соединений катионов с 18 электронами и незавершенной внешней оболочкой ниже, чем у аналогичных соединений с 8 электронными катионами с близким радиусом. То, что это правда, видно из следующего сравнения температуры плавления (°C): 35-38 П-С Г Бр-Я » Ф » С Г Бр-Я » НС *(0,98 А)995800750662 РБ *(1,49 В)775717680680640 КР *(038A)4Е0 488588 тг(1.49 а) 327431461442 Ca » *(1.0 bA)1423 782 760 784 Sr2 *(I. 27A)1473 872 643 515 Cd » *(1.03 A)1078 564 568 388 RCH (1.32 A) 822 501 370 412 При нагревании вещества происходит очень сильная односторонняя деформация, и более 1 электрона может быть вытянуто из аниона в катион полностью.
Результатом такого вытягивания является, например, термическая диссоциация вещества в галогенной соли Au3, протекающая по схеме AuG3 AuG. Очевидно, что степень нагрева, соответствующая такой диссоциации, должна варьироваться в зависимости от compound. In дело в том, что в некоторых веществах (таких как CaF2) термическая диссоциация наблюдается даже при очень высоких температурах-даже при существовании (таких как Cul2), обусловленном очень низкой начальной температурой диссоциации, или очень нестабильном (таком как Aula) нормальном состоянии.
Чем больше деформируемость солевого аниона элемента, тем больше вероятность того, что он притянет электроны в катион. Таким образом, термическая стабильность, например, Галогенидных солей любого катиона, всегда снижается для многих F-анионов. С другой стороны, тепловая диссоциация должна происходить тем легче и сильнее поляризационный эффект катиона.
Таким образом, соли катиона, которые имеют одинаковый заряд и близкий радиус, но отличаются структурой внешней оболочки электрона, также отличаются термической стабильностью. Например, соли У3 *- (1.06 А) и Zr4 *(0.87 в) гораздо более стабильны, чем аналогичные соли Т13 *(1.05 A) и Pb4 *(0,84 а). В этом случае он играет очень важную роль. XIII-60.Недостатки внешней электроники Non-поляризовыванный ти-г ’Лоток кушон. Например, с той же скоростью *
Галоидная соль с близким радиусом катиона Cr * + (0.65 A) и Mn4 +(0.52 A), которые характеризуются структурой внешней оболочки 8 +3, представляют собой 18 электрон-катионные ионы Ga3 +(0.62 A) и Ge’4 +(0.44 A), однако термическая диссоциация большинства галогенидных солей происходит только при очень высоких температурах, поэтому еще глубже проследить намеченную закономерность не представляется возможным. В более сложной структуре солей кислород-кислот свойства термической диссоциации несколько отличаются. Здесь в большинстве случаев образование оксидов металлов происходит с резанием оставшихся анионов.
Очевидно, что такой процесс представляет собой, по существу, отвод кислорода от ионного металлического полуквета к металлу, входящему в состав образующейся соли. Таким образом, здесь поляризационный эффект катиона действует на тот же эффект полуметаллов, образующих Ион, и термическая диссоциация является результатом этой обратной поляризации Иона кислорода, увеличивающейся по мере нагревания соли. 。 /
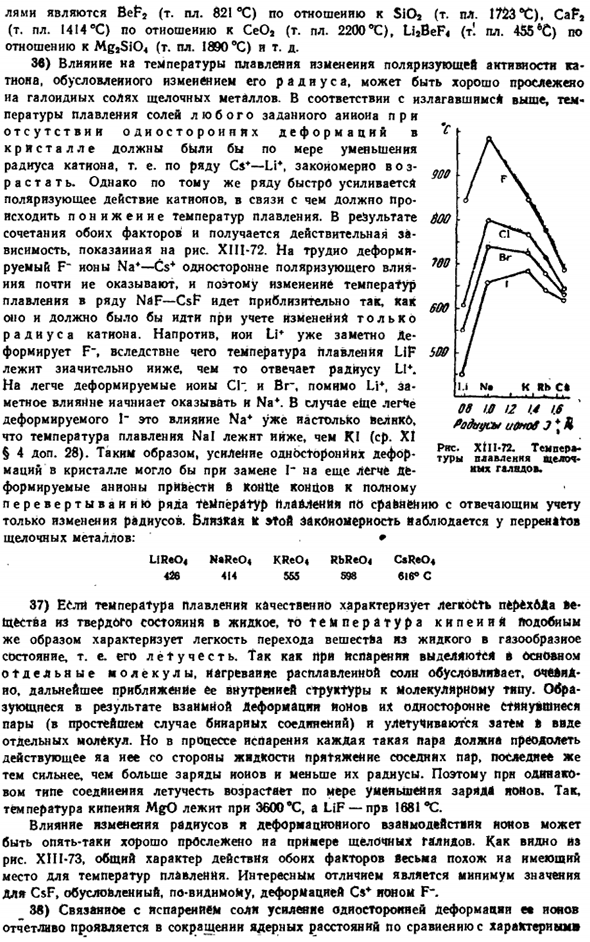
Характер процессов, происходящих при обратной поляризации, можно проследить по схеме (рис. XIII-60). В качестве примера, ионы COJ » к источнику электрического поля соответствуют усилению поляризационного действия cation. In отсутствие внешних воздействий, все 3 атома кислорода, которые входят в состав SOG, одинаково поляризованы углеродом (A)»когда внешнее поле усиливается, диполи O2, которые ближе всего к нему, индуцируются без включения.» Заказ был компенсирован (B), а затем дубликаты ©, которые были первоначально доступны. Поэтому связывание этого О2-Иона с углеродом становится все более слабым.
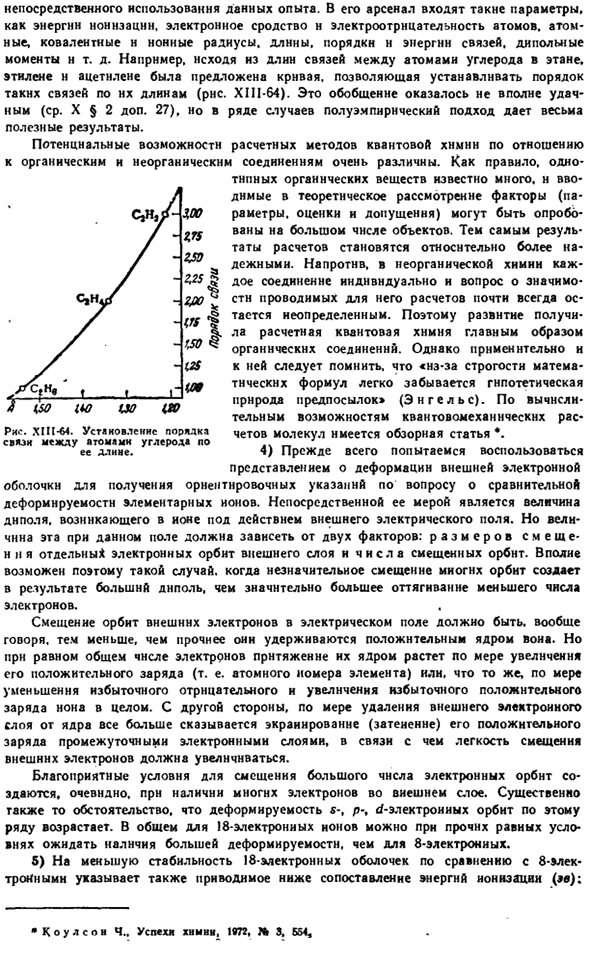
Дальнейшее усиление внешнего поля, его полный разрыв (Г). это приводит к 40. Предпочтительный фактор контраполяризацина должен влиять на термическую стабильность солей кислородных кислот. О том, что это действительно так, свидетельствует следующее сравнение температуры, при которой давление со03 на карбонаты некоторых двухвалентных металлов достигает 1 атмосферы, в результате диссоциации по схеме mc03 ^M0-f-f-СО2: sl7 * srv ’* 2p7 * Sy7 * pb’ * Радиус, А………. 0.78 1.06 1.27 1.43 0.83 1.03 1.32 Электронная оболочка…. 8 8 8 8 18 18 18 + 2 температура. ПРОТИВ……. 660 897 1200 1350 297 357 347
Как видно из этих данных, если радиус близок, то термическая стабильность соли сильнее, чем у катионов поляризационного типа, за исключением инертных газов (Zn2*, Cd2+, Pb2+), которые значительно ниже, чем 8-electron. In в последнем ряду Ия периодически увеличивается по мере увеличения радиуса. Диаграмма XIII-62.Контра Поларис Иона Н \ Рисунок XIII-61.Нагревание диссоциации карбоната и сульфата (ккал / моль).
При переходе от одной кислородной кислоты к другой (с одинаковой основностью) происходит общий сдвиг термической стабильности самой соли в ту или иную сторону за счет изменения поляризационного взаимодействия внутри самих анионов. Например, термическая стабильность сульфатов выше, чем у соответствующих карбонатов. Однако характер его изменения в определенной последовательности катионов остается примерно таким же(с одинаковым типом диссипации).Для карбонатов и сульфатов это видно из диаграммы. ЛШ-61.41.42
Как упоминалось выше об особенно сильном поляризационном эффекте Н4, ожидается, что свободная кислородная кислота будет менее стабильной, чем соли большинства металлов. Однако, в отличие от катиона Последний из H может быть введен в Ион 02.Поэтому природа обратной поляризации здесь несколько отличается от соответствующей соли. Например, предположим, что у вас есть ионы COJ (-4, рис. XIII-62).Когда H вводится в 1 из ионов O2(5), заряд уменьшается(и деформируемость уменьшается), что делает HCOJ намного менее стабильным, чем COJ.
Поскольку введение следующего H (B) действует в том же направлении, образующиеся нейтральные молекулы воды удерживаются в анионах только за счет их ориентации и деформации углеродом. Однако последний заряд относительно невелик, поэтому удаление молекулы воды (G) довольно просто. То есть свободная угольная кислота нестабильна. Это также определяет нестабильность кислот, таких как H2S03, HNO2 и др. Напротив, при высоком заряде анионообразующих элементов соответствующие свободные кислоты (H2S04, HNO3 и др.) обычно остаются в свободном состоянии, но они все равно exist.
It значительно более неустойчив, чем большинство солей. Из последней ситуации следуют существенные последствия, касающиеся окислительных свойств оксигенатов, таких как производные N07, C10£CI07.Окисление, вызванное изменением валентности центрального элемента должно быть настолько очевидным, что стабильность анионов нарушается. 。 Следует ожидать, что соответствующие свойства кислотного окисления будут более выраженными, чем у большинства солей, поскольку обратная поляризация Ионом H также снижает стабильность.
Но сам анион в кислом растворе такой же, как анион в растворе его солей. Следовательно, окислительное свойство должно быть свойством нерасщепленной молекулы кислоты. Этот вывод очень хорошо совпадает с опытом. Действительно, анионы кислородных кислот (MnOJ, OP) явно обладают окислительными свойствами, которые только у самых неустойчивых немногих анионов ярко выражены не только в кислой, но и в щелочной среде (т. е. свойства самих анионов).
Напротив, подавляющее большинство анионов кислот кислорода являются типичными окислителями только в кислой среде (то есть в растворе самой кислоты или в растворе ее солей). 。В таких случаях последний (а не сами анионы) является окислителем. С этим связано наличие окислительных свойств концентрированной H2S*, особенно в отсутствие ее водного раствора (в том числе Нео ^или со «Иона).43,44
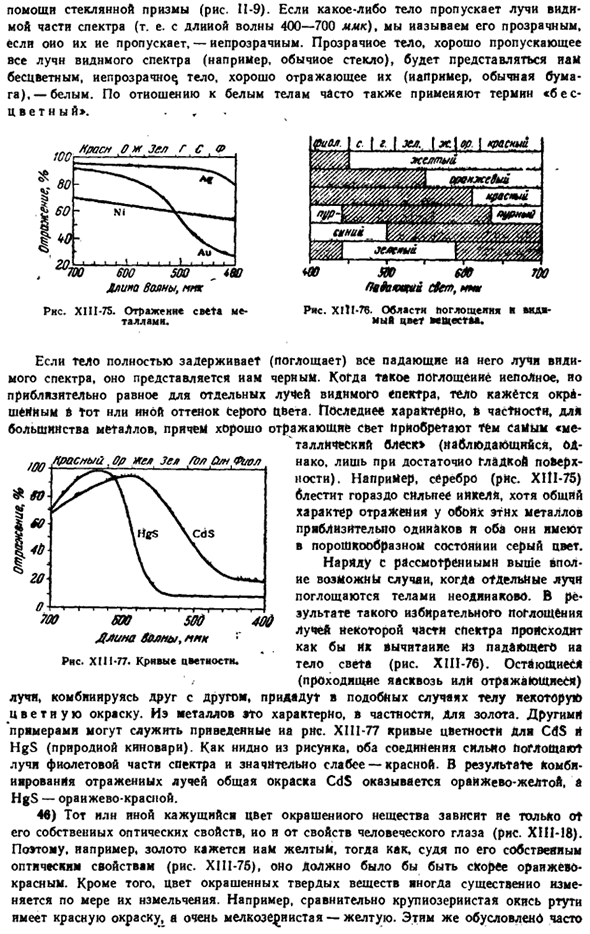
Он немного отличается от свойств, изученных выше, но это цвет неорганического вещества. compound. In в некоторых случаях это связано с присущим одному Иону цветом, который практически не зависит от другого (если он сам бесцветен).Например, все соли Pr3 *являются зелеными. В других случаях цвет соединения определяется не только окрашенными ионами, но и их партнерами (например, CrCrO *-желтый, Ag2Cr04-красновато-коричневый).Наконец, известно много цветных соединений, образованных бесцветными ионами(такими как желтый POP2).
Очевидно, что появление цвета в последнем случае может быть обусловлено только взаимодействием ионов. Общих теорий о зависимости цвета неорганических соединений от химического состава нет, но появление цветов может быть обусловлено наличием выраженной деформации электронных орбит. Несмотря на то, что такая деформация всегда является взаимодействием, основную роль чаще всего играет поляризация анионов катионами. Поэтому увеличение деформируемости аниона должно быть особенно благоприятным для появления цвета.
Рассматривая многие соединения данного катиона и имеющие различную деформируемость анионов, мы действительно видим this. So, с серией Галоидных солей, йодиды окрашиваются довольно часто, бромиды встречаются реже, а хлориды и фториды встречаются еще реже. Точно так же окраска гораздо более характерна для сульфидов, чем для аналогичных оксидов. Имея в виду, что деформируемость OH-намного меньше, чем деформируемость O2 -, можно ожидать, что некоторые окрашенные гидраты оксида станут colorless.
In дело в том, что это очень часто наблюдается(например, производные Cd2 \ Fe2+, Mn2+, Pb2, Sn2+, In3, Bi3).интересным исключением является Ce4, переходящий из CeO2 в Ce(OH), и вы видите, что цвет не выцветает. С другой стороны, появление красящих соединений должно быть облегчено увеличением поляризационного эффекта катионов. Поскольку он относительно мал в малозарядных катионах с внешней оболочкой из 8 электронов, их красящие соединения (в том числе бесцветные анионы) обнаруживаются только в виде исключений. Дальнейшее увеличение заряда часто связано с появлением color.
An примером может служить следующая серия оксидов: К20 САО в образцах sc2o3 TY2 V205 сигнал cr03 Mp207 Бесцветный-бесцветный-бесцветный-бесцветный-оранжевый-красный-зеленый В случае производных они гораздо прочнее поляризованных, легче деформируются катионами с внешней оболочкой из 18 электронов (и 18 F2 электронов), а наличие цвета более характерно. Например, соединение 8 электрон Ca2 +(1.06.Если А) и Sr2 +(1.27 а) бесцветны, если Cd2 +(18 электронов, 1.03 а) и Pb2 +(18 + 2), то сульфиды и оксиды окрашены.
Электронов, 1,32 а) — сульфиды, оксиды и йод. м Из вышесказанного по вопросу о цвете, во-первых, будет видно, что не всегда удастся определить цвет соединения по цвету индивидуума ions. In помимо образования окрашенных соединений из бесцветных ионов, неокрашенные цвета также могут быть изменены их партнерами. Например, желтые свойства не-CrHOG одинаковы для всех солей, включая относительно слабые катионы (такие как K*), в то время как сильные поляризованные катионы (такие как Ag+) уже существенно изменились.
С другой стороны, вышеизложенное позволяет в некоторой степени предсказать наличие или отсутствие цвета в некоторых соединениях. Например, если мы знаем, что йод для конкретного катиона бесцветен, мы можем предположить, что его бромиды и хлориды также бесцветны. Напротив, наличие окрашенных хлоридов говорит о том, что бромиды и нодиды также окрашены. Подобный вывод можно сделать с высокой степенью вероятности, имея в виду оксиды и сульфиды, соли различных катионов и др. 10 B, C, Некрасов
Исходя из приведенной выше аналогии между усилением односторонней деформации и нагревом, можно ожидать, что повышение температуры должно благоприятствовать появлению цвета соединения. Это, конечно, наблюдается очень часто. Например, при нагревании бесцветное ZnO превращается yellow. In напротив, в нормальных условиях желтая сера становится обесцвеченной, когда она охлаждается до температуры жидкого воздуха.
В частности, как видно из данных по Галогенидам In5 *, появление цвета соединения связано с плавлением. INCJ InBrj Inla Цвет ПРН нормальное состояние бесцветное желтое состояние плавления желтый бледный темный Коричневый, Коричневый. Следовательно, 1nC!3 нагрев приводит к тому же изменению цвета, что и замена в нормальных условиях, и является более трудным, чем деформируемый С1-иа и более легко деформируемый I. красноватый, типичный при нормальных условиях cof2. Появление цвета также может быть связано с веществами, созданными в p-C.
Например, безводные CuF2 и CuSOi бесцветны, а их растворы (и кристаллические гидраты) окрашены»синим».Это особенность гидратированных ионов Cu. Причиной появления цвета, по-видимому, является прямая поляризация Cu1 * » на более легко деформируемые молекулы воды.«Далее, в присутствии легкодеформируемых молекул аммиака (в растворе аммиака солей меди)происходит дальнейшее увеличение интенсивности окраски.
Во многих других случаях наблюдается обратное явление-при растворении цвет исчезает. Например, Рыг в твердом состоянии имеет золотистый цвет, а его раствор бесцветен. Здесь растворение связано с немедленным замещением Pb24 „легко деформируемыми ионами I“, а деформируемые молекулы H20 оказываются гораздо более сложными, вызывая исчезновение цвета. Из вышесказанного видно, что цвет твердого вещества не всегда может определить цвет его раствора, и наоборот.
Процесс электролитической диссоциации, сопровождающий растворение типичных солей, может быть схематично представлен следующими уравнениями: ЕА + ( * +£) Н20 [е(OH2).] ’ + [а(Н20) Здесь, [е(OH2)Х1 и[А(Н20)»] — указывает в соответствующих гидратированных ионов (Е и’).Поскольку этот процесс обратим, концентрация ионов в противоположном знаке к концентрации молекул воды сильно влияет на положение равновесия. Первое увеличение с одновременным уменьшением 2-го ПРН разбавления раствора приводит к сдвигу вправо при этих равновесных условиях, то есть к увеличению степени диссоциации соли.
В случае поляризации солей соли, наряду с их концентрацией, на равновесное положение диссоциации дополнительно влияет еще один фактор. Чем больше Ион, тем сильнее сжатие ионов, тем слабее поляризационный эффект каждого Иона на молекулу воды(из-за диполя, возникающего в результате поляризации) Молекулы воды возвращаются к своему собственному ионному заряду-ср. Рис. XIII-56, Б).
Поэтому наличие односторонней деформации в молекуле должно быть благоприятным для ее существования в недиссоциативном состоянии. Как отмечалось выше, возникновение сильной односторонней деформации наиболее характерно для соли малозарядных 18-электронных катионов с выпуклостью, содержащей анионы, которые легко деформируются. Поэтому особенно важно влияние взаимной поляризации ионов на электролитическую диссоциацию pronounced. In дело в том, что во всех этих случаях, когда рассматриваемая соль хорошо растворяется в воде, степень их диссоциации уменьшается по сравнению с обычной такого типа.
Таким образом, CdCb уже диссоциирован гораздо меньше, чем тот, который соответствует типу MX2, и степень диссоциации еще больше уменьшается, когда он переходит к CdBr2, а затем к Cdlj. Соответствующие соли Hg * +диссоциируют еще хуже. Например, НГС! Степень диссоциации 2 не превышает 0,5%даже в очень разбавленных растворах.
Напротив, соли тех же катионов и труднодеформируемых анионов (С107, F〜, NOJ) диссоциируют нормально. Очень характерным для большинства нормально Диссоциированных солей является широко распространенный гидролиз в водных растворах. Зависимость этого явления от поляризационного взаимодействия лучше всего прослеживается, если оно начинается с первых образовавшихся гидратированных ионов во время dissociation.
As в качестве примера возьмем соединения, которые диссоциируют по схеме(для простоты будем считать, что каждый ион гидратируется только с 2 молекулами воды) EA + 4H20 ^ [H20 * E * OH2] 2 ′ + [OH2•A * H20P- Если поляризационные эффекты обоих ионов-Е2 *и А1-невелики, то в молекулах воды, притягиваемых к ним, не происходит существенных изменений.
Его упрочнение должно сопровождаться постоянно возрастающей деформацией этих молекул и, на определенном этапе, они распадаются на составные части. Последний, заряженный противоположно данному Иону, останется притянутым вместе, а остальные будут»вытеснены» как есть. Результаты такого последовательного усиления поляризационного действия каждого Иона сравниваются ниже. 1 II 1) [H20 * E. OH2p 4-A » 1) [OH2.A. H2OH + e〜 2) [HgO-E ONG + H ’+ A ’+ A «| J 3) [HO * E * OH] + 2H * + A » 2) (OH2.А-НГ + О — + Е » 4) [НЕ-Е-ОГ + ЗН ’+ А » б)[о. или — + 4NCH-а » 3)[Н-Н] + 20Н〜+ е» Случай I соответствует гидролизу солей слабых оснований, случай II-слабых кислот.
Если не ограничиваться произвольно обозначенным ионным дипратором, то на каждой стадии обеих схем можно выбрать пример соединения, в котором гидролиз протекает до этой стадии. Поэтому в более сложных случаях, которые у меня есть, 1) гидролиз действительно не идет-BaCl2, KNOa и т. д. 2) гидролиз происходит до образования оси Соль-в подавляющем большинстве случаев; 3) гидролиз идет до центрального элемента гидроксида Тикла; 4-5) гидролиз протекает с образованием свободных кислот-различных галогенидов, например PC13 и PC \ b.
Таким образом, при усилении поляризационного эффекта ионов гидролиз Солнца, который хорошо растворяется и обычно диссоциирует, должен происходить increase. In в частности, для некоторых анионов, чем больше заряд катиона, и чем меньше радиус, тем полнее он будет течь. Если заряд равен и радиус близок, то гидролиз солей катионов с 18 электронами и неполной оболочкой должен быть больше, чем солей однотипных 8-электронных катионов. Эти выводы полностью подтверждаются опытом. Шестьдесят один
Из приведенной выше схемы II видно, что кислота слабее, а поляризационный эффект аниона а более выражен (или, в сложной структуре последнего, той части, которая может связывать H*). в случае элементарных анионов это отчетливо проявляется в изменении силы кислот в ряду J, Если < HCI << HBr < HI и Н20 < H2S < H2Se <Н2Те. «■」 В случае I, более детальное рассмотрение required. As уже упоминалось(V§ 5), что химические свойства гидроксидов EOH зависят от напряженности поля E. общий характер этой зависимости хорошо виден из следующего сравнения:
Схема Эон пример химических свойств оксида язвообразования (§§с2 soVX 3тX•вах>>ЭО+НОН-Э »-f20H«ЭО+НОН-(ЭОНГ+ОН «ЭО-fHOH—Э(ОН), ЭО+НОН -[OEONG + Н * ЭО +нон-I030J »+ 2Н легко для того чтобы растворить. Основное свойство нерастворимых А. Основные характеристики нерастворимых в, амфотерные свойства, нерастворим, нерастворимые кислотные свойства, Nаон, ва (о), мг (кислотные свойства, гидроксид не растворимы) «ИП <о), ЗН (о)» СБ(о), Си (Он) 4, со (О), Асо (О) Джей, Соф (О) Джей
Поскольку напряженность электрического поля Е зависит не только от его заряда, но и от радиуса и структуры электронной оболочки, то химические свойства гидроксида ЕО, образуемого по данным Е, зависят от всех этих факторов. Если структура внешней электронной оболочки одинакова и радиус близок, то с увеличением заряда е основные свойства ослабляются, а кислотность возрастает.
Например, при равном радиусе (1,06 а) Ca2 +и Y8 основные свойства гидроксида выражаются в тех, которые значительно слабее, чем first. At в то же время при переходе от Р5 *(0,34 а) к С6 *(0,29 а) кислотные свойства гидроксида значительно возрастают. При электронной структуре одного и того же электрона с равным зарядом уменьшение его радиуса приводит к ослаблению основных свойств электронов и усилению кислоты properties.
An примером является La3 * — Y3 * — Sc3 * — A1*\, который показывает переход свойств Эона от сильно выраженных основных свойств гидроксида La3 * (1.22 A) к типичным амфотерным свойствам гидроксида A1 * (0.57 A). Е. основному усилению и упрочнению кислотных свойств Эона способствует переход ряда 8-электрон, 18-электрон незавершенной оболочки. Поэтому основные свойства гидроксида более выражены в Mg2 (0,78 а, 16 электронов), чем в Mg24(0,78 а, 8 электронов).в то же время гидроксид Fe2 * (0,83 а, 14 электронов) имеет только основные характеристики, а гидроксид Zn2 +(0,83 а, 18 электронов) является амфотерным.
Различное строение внешней электронной оболочки ответственно за резкую разницу в свойствах гидроксидов обеих подгрупп каждой периодической группы system. As заряд увеличивается, эта разница постепенно уменьшается, но даже в группе VII он не исчезает полностью. В соответствии с вышеизложенным, образование гидроксидов металлов из их оксидов протекает по схеме ОР + Н20 ^ Е0-Н20 ^ е (он)2 ^ [Эон] * + о «^УЧ20Н〜 Это связано с поляризацией молекул воды ионами O2.Поскольку самоизменение катиона O2 ослабляет поляризационный эффект на воду, то по мере увеличения поляризационного эффекта катиона образование гидроксида металла из оксида становится более затрудненным, а удаление гидроксида, наоборот, accelerates.
In действительно, опыт показывает, что термическая стабильность гидроксида 8-электронных катионов всегда значительно выше поляризации 18-электронных катионов (таких как NaOH и K), которые близки по радиусу при одном и том же заряде, тогда как AgOH спонтанно распадается на H20 и Ag20 при комнатной температуре (соответственно, 1378 и 127070) при кипении H. В аналогично составленном наборе из 8 электронных катионов стабильность Эона изменяется очень естественно и уменьшается с увеличением заряда катиона и уменьшением его радиуса. Поэтому гидроксиды щелочноземельных металлов отделяются при нагревании уже легче, чем гидроксиды, такие как соответствующая щелочь metals.
In в подгруппе периодической системы термическая стабильность EOH быстро возрастает сверху вниз, например, как видно из следующего температурного сравнения: давление паров воды на гидроксид[образующийся в соответствии со схемой E (OH)2 = H20 + EO] равно 760 мм рт. ст.: мгал * США сру Ва1 * Радиус А……. 0.78 1.06 1.27 1.43 Температура°C… 160547 778 898 18 для электронных катионов ситуация усложняется по мере того, как врожденная деформация катионов начинает играть важную роль. Это связано с тем, что чем меньше заряд, тем больше радиус, тем он больше. Из-за дополнительного поляризационного эффекта, обусловленного им (рис. XI11-56), очень важна суммарная поляризация как Ионов O2, так и катионов, что, согласно предыдущему примеру, приводит к ослаблению внешнего field.
As в результате стабильность гидроксида резко снижается до 18-8 электронных катионов по сравнению с соответствующими 8-электронными ионами, например, приведены следующие данные по энергии гидратации оксида кальция (1,06 а, 8 электронов) и кадмия (1,03 а, 18 электронов).: CaO + H20 = Ca (OH)g + 16 ккал CdO + H20 = Cd (OH) 2 + 3 ккал Роль дополнительного поляризационного эффекта играет прежде всего взаимодействие 18 электронных катионов с легко деформируемыми ионами, такими как О2 -.Таким образом, наблюдаемые законы о 8 электронных катионах здесь обращены вспять. Когда катионный заряд увеличивается, а радиус уменьшается, стабильность гидроксида металла не уменьшается, а увеличивается.
Таким образом, гидроксид меди * Н его аналогом, менее стабильна, чем гидроксид соответствующего элемента, например, цинк подгруппы. В то же время, если вы идете сверху вниз в подгруппе периодической системы, стабильность гидроксида уменьшается. Так, в целом, CuOH, AgOH, AuOH, НД (он) 2, т!(OH) 3 и Pb (OH) 4, такие как 18-электронный катионный гидроксид, не являются наиболее стабильными.
Правда, из-за простого удаления воды многие из них вообще не доступны в свободном состоянии. В отличие от гидроксидов металлов, образование кислот связано с поляризацией молекул воды из е-оксидов, как графически показано ниже: Н20+ЭОН20-Э05 = 2Н2Э02Н* + [НОЭОГ2Н* -Ф [ОЭО! Два〜 Поэтому ход процесса должен определяться поляризационным эффектом ионов е, малых и высокозаряженных (как правило).
Например, вы можете видеть из следующего сравнения гидратации тепла, потому что его влияние на увеличение диакритических. Н20-f S02 ″ H2S03 + 1 kcalH20+ S03 = H2S04-f 15 ккал Аналогичный закон ожидается и для 8 и 18 электронов в этом случае, поскольку при увеличении заряда Иона его собственная деформируемость (и дополнительный эффект поляризации) быстро уменьшается. Поляризация молекул воды Ионом е выражается в их ориентации и деформации. Если первый фактор является наиболее важным, то число молекул воды, поляризованных ионом е, должно быть больше с более высоким charge.
By по аналогии с гидроксидами металлов, в данном случае можно предположить, что 5, 6 и-семивалентные E дают гидраты в составе E (OH) 5, E (OH) c и E (OH) 7 соответственно, а также обладают лишь слабокислыми свойствами. Напротив, при общем значении 2-го фактора количество притягиваемых молекул воды сводится к минимуму, но их деформация, а следовательно и кислотность ЭОХ, становится заметно заметной. Как уже упоминалось (III§ 7), по мере увеличения напряженности поляризационного поля основная роль в общей поляризации постепенно смещается от ориентации к деформирующему эффекту.
Однако поляризационный эффект E тем сильнее, чем больше заряд(и тем меньше радиус).Таким образом, с увеличением заряда электронов(и уменьшением их радиуса) наблюдается уменьшение количества молекул воды, присоединенных кислотными оксидами, и одновременное увеличение прочности кислоты.
Например, в случае P * S *и C17 +вместо P (OH) 5, s (OH) e и C1 (OH) 7 имеется кислотный состав, соответствующий формулам PO(OH) 3, SO2(0H) 2 и CIOj (OH).Увеличение прочности этой серии. Эффект уменьшения радиуса Е влияет на изменение свойств гидроксида при переходе от нижней к верхней подгрупп V, VI и VII группы периодических систем.
Например, Nb5 *(0.69 A) по-прежнему предпочтительнее Ориентированная часть поляризации и ее гидроксиды обладают свойствами большого количества молекул воды в сочетании с оксидами и гелем с очень слабыми кислотными свойствами. Напротив, в Р5 +(0,34 а) деформированная часть поляризации уже является наиболее важной, а ее гидроксид (Н3Р04) характеризуется малым числом химически связанных молекул воды и ярко выраженными кислотными свойствами. Аналогичная ситуация наблюдается в 18 подгруппах электронных ионов. Увеличение заряда и уменьшение радиуса е сопровождаются уменьшением количества молекул воды, присоединенных оксидом, и увеличением прочности соответствующей кислоты.
Особый интерес представляет резкий скачок между теллуром и селеном. Состав селеновой кислоты H2Se04, прочность подобен к серной кислоте, но теллуровая кислота соответствующа к формуле IvTeOb и очень слабая кислота. О его 6 основных свойствах свидетельствует наличие таких солей, как AgeTeOe и HgjTeOe. 「-*
В случае гидроксида Эона из 8 электронных ионов, состоящих из групп V, VI и VII периодической системы, изменения свойств вдоль рядов Tav-«Vv, WVI-» CrVI и ReVII — * MnVI1 протекают очень естественно. Во всех 3 линиях наблюдается увеличение прочности кислоты, снижение ее стабильности, увеличение окислительной активности, переход от бесцветных соединений к окрашенным.
При дальнейшем переходе от Vv, CrVI и Mnvn к их аналогам Pv, SVI и Clvu наблюдается резкий скачок в изменении некоторых характеристик соответствующего Эона. Увеличение прочности кислоты продолжается, но в то же время наблюдается также повышение стабильности, ослабление окислительной активности и исчезновение цвета. Нестабильным является мощным окислителем, который окрашен H3VO4,Н2СЮ4, и НМп04, в отличие от Н3Р04,H2S04, НС104 и бесцветный и стабильный, при решении характеристики окисления является последним в характеристике не. Этот всплеск свойствам, вероятно, обусловлено существенное изменение в характере химических связей.
В радикальной VOJ » если CGOG и многу, кажется, почти близкой к ионной, в радикальной Гог. SOJC и C так, наоборот, приближаются к неполярным. Последнее, в частности, подтверждается результатами оптических исследований (по рефракции).Таким образом, видно, что оптические свойства кислорода на баке очень близки к свойствам ОГ molecule. It показывает сразу униполярное скрепление кислорода и хлора. На графике показано изменение характера валентной связи, которое происходит под влиянием усиления взаимной деформации ионов. XII1-63.Схема
А соответствует крайнему случаю ионной связи(взаимная деформация ионов полностью отсутствует), схема Д-строго неполярная связь, схема в-приписывается множеству ионов, схема с-70,70-72 ионам На примере одной кислоты Vv, CrVI и MnVIIt, а также других аналогичных кислот Pv, SVI, Clv, r мы видим, что поляризационный дисплей используется непрерывно без учета возможности. Следом за ним шагнули мои реформы 66 ПЕРЕЙТИ КД ИДУТ A 6 8 f —- __ Повышенная лариальность общения Рисунок XSh-63.Деформация ионов и природа химических связей. Изменения в природе химических связей могут привести к полному противоречию с reality.
In дело в том, что, например, при таком механическом подходе, основанном на ходе изменения свойств кислот вдоль ряда WV1 — CrVI, предполагается, что серная кислота представляет собой высокоустойчивое соединение, интенсивно окрашенное и обладающее выраженным окислительным свойством в растворе. Все эти 3 функции, с другой стороны, не имеют ничего общего со свойством H2S04.
С другой стороны, анализируя свойства многих веществ с явно неионной природой химических связей, мы пришли к правильному выводу, основанному на идее поляризационного взаимодействия между ионами. Последнее, вообще говоря, показывает, что подход к интерпретации свойств неорганических соединений возможен с двух сторон. Мы можем рассмотреть изменения, которые происходят в результате взаимных связей, начиная с нейтральных атомов, как мы это делали раньше (III§ 5).Или, наоборот, вы можете добраться до реального положения вещей, исходя из отдельных ионов и учитывая взаимную поляризацию.
Используя 2-й метод рассуждений, не следует забывать, что разложение полярообразующих соединений на отдельные ионы-это временное искажение истины, которое мы сознательно допустили, чтобы облегчить модельный подход к конкретной проблеме. Добавь \ 1) еще М. В. Ломоносов писал: почему суд был так опасен только труду и жизни великого человека? Неужели вы собираете так много разных вещей и проблем в горах, что, не думая о месте и наведении порядка, вы просто смотрите и удивляете множество людей?」 Энгельс выразил ту же мысль 8 в более актуальной форме.
Опыт естественных наук накопил огромное количество положительного материала, и необходимость систематизировать этот материал систематически и по внутренним связям во всех областях исследований стала неизбежной」 Поляризационный подход, разработанный для интерпретации свойств неорганических соединений в этом разделе, исходит из фаянса (1923).Это не единственное, что разрешено.
- Однако ни один из других существующих теоретических подходов к этой же проблеме не допускает единой интерпретации широкого и разнообразного фактического материала неорганической химии настолько широко, насколько это позволяет данный подход. Создает представление поляризации. Важно отметить, что различия в отдельных теоретических подходах касаются не результата, а формы интерпретации материала. Например, сильная взаимная поляризация 2 ионов, с продуктивной точки зрения, соответствует низкой полярности или высокой ковалентной связи между соответствующими atoms.
As в результате вы можете подходить с разных точек зрения, и «выбор между теориями всегда должен оставаться в какой-то степени вопросом личных предпочтений» (O r gel). 2) конечно, возникает проблема поляризационной интерпретации свойств неорганических соединений и взаимосвязи между подходом к этой же проблеме с точки зрения квантовой физики. chemistry. As в результате » химическая литература завалена мусором
As вы знаете, в современном состоянии такой подход открывает различные возможности качественных объяснений (точнее, их интерпретации) различных экспериментальных данных, но они, как правило, не являются predictive. Людмила Фирмаль
Теория, которая дала удовлетворительное объяснение уже известным фактам, но не смогла точно предсказать факты, обнаруженные позже. «На современном этапе необходимо подчеркнуть, что главный герой принадлежит эксперименту» (J. K. Syrknn).И основная действующая теория экспериментальной химии, обладающая важной предсказательной силой с точки зрения качества, представляет собой систему представлений, основанную на квантованном рассмотрении и эффектах I-аукциона, и по-прежнему имеет место сегодня.
Именно поэтому он точно учитывает смещение электронной плотности в молекуле (см. III§ 5, 8).он играет важную роль в разработке методов синтеза органических соединений и в интерпретации важнейших свойств химии (например, кислотно-щелочной).То же самое относится к общим неорганическим соединениям, но для ионов поляризация ионов играет аналогичную роль. role. In общие, квантовые и» неквантовые » качественные подходы дополняют друг друга, а не исключают. 3)
Что касается количественных методов расчета квантовой химии, то она развивается в 3-х направлениях: теоретическом, полутеоретическом и простом, которое также называют полуэмпирическим. Излишне говорить, что между ними нет четких границ. Основным содержанием теоретического направления является точное решение волнового уравнения применительно к многоэлектронной системе (III§ 4 add. 13). до сих пор такое строгое решение было принято 1 электроном(N. известно только в системах, имеющих такую функцию, как He* и др.).С математическими трудностями быстро растущего с увеличением числа электронов, невозможно распространить электроны дальше, чем несколько простых молекул.
Это направление нисколько не заинтересовано в качественном изображении phenomenon. It функционирует полностью»для себя» и, можно сказать, не очень перспективна для обозримого будущего химии. «Когда химик узнает, что после 40 лет скитаний и поисков никто не знает дороги к Земле Обетованной точного решения уравнения шлендингера. Он не спешит к Единому Богу квантовой механики, но продолжает поклоняться Богу с менее великим, но более отзывчивым химическим опытом и здравым смыслом»(Е. М. Шусторович).
Полутеоретическое направление стремится расширить область применения волновых уравнений путем замены точных решений на неточные, и в связи с этим широко применяются различные приближенные методы used. It характеризуется дуктивной работой модели, созданной на основе общих соображений. Обычно они начинаются с идеи теории молекулярных орбиталей (VI§ 3, дополнение 14), и более или менее произвольные факторы(параметры, оценки и предположения) постоянно вводятся в расчет. «Учитывая, что невозможно получить точное решение волнового уравнения молекул, в этом нет ничего удивительного.
Поэтому приближение, применяемое к точному решению, должно отражать мысли, интуицию и выводы экспериментальных химиков«(Кольсон). в некоторых случаях правильный выбор этих факторов может привести к результатам, которые хорошо согласуются с экспериментальными данными. Однако вероятность подходящего набора входных элементов обычно не уникальна, поэтому достоверность принятого вычислительного пути еще не установлена (если число неизвестных больше числа уравнений, то положение можно грубо сравнить с тем, которое создано в алгебре).
Универсальной и надежной системы для построения таких приближенных расчетов пока не создано, но, в принципе, это возможно. Отсюда и полутеоретическое направление. В принципе, это просто «научиться считать» (то есть он в основном работает с»самой ИА»), но это перспективно для химии. К сожалению, многие из выполняемых расчетов похожи на игры не в поисках истины, а по определенным правилам или упражнениям на определенную тему.
Полуэмпирическое направление руководствуется общей идеей квантовой химии (обычно духом выражения теории валентных связей), но оно по своей сути индуктивно. Это работает с набором некоторых реальных веществ、 Прямое использование данных опыта. Его оружие включает такие параметры, как энергетическая ионизация, атомное сродство к электронам и электрическое целеуказание, атомный радиус, общий радиус связи, ионный радиус, длина связи, порядок и энергия, а также дипольный момент.
Например, была предложена кривая этилен-ацетилен, основанная на длине связи между атомами углерода этана. Это позволяет установить порядок соединений по длине (рисунок X111-64).Это обобщение не было полностью успешным(X§ 2 ext.27), но в некоторых случаях полуэмпирический подход может дать очень полезные результаты. Возможности методов расчета квантовой химии по органическим и неорганическим соединениям весьма широки different. As как правило, известны многие органические вещества одного вида, а факторы (параметры) вводятся в теоретическое рассмотрение. Оценки и допущения) могут быть проверены на ряде объектов.
Поэтому достоверность результатов расчета относительно высока. Напротив, в неорганической химии каждое соединение независимо, и вопрос о важности выполняемых для него расчетов почти всегда остается неопределенным. Таким образом, ведется разработка расчетных квантовых нанополимеров преимущественно органических соединений.
Однако применительно к ней следует помнить, что»из-за строгости формулы гипотетический характер посылки легко забывается» (Энгельс).Имеется обзорная статья*о вычислительной мощности квантово-механических расчетов молекул. 4) прежде всего, используя понятие деформации внешней электронной оболочки, мы пытаемся получить меру сопоставимости ионов элемента с деформируемостью. Его прямой мерой является величина диполя, возникающего в ионах под воздействием внешнего электрического поля. Однако это значение для конкретного поля должно зависеть от двух факторов: смешанного размера отдельных электронных орбиталей во внешнем слое и числа смещенных орбиталей.
Поэтому такой случай вполне возможен в том случае, когда малейшее смещение многих орбит приводит к большему диполю, чем гораздо большее притяжение нескольких электронов. Смещение орбит внешних электронов в электрическом поле, вообще говоря, тем меньше сила, которая сохраняется положительным атомным ядром фон. Но если общее число электронов равно, то по мере увеличения их положительного заряда (то есть атомного номера элемента) возрастает их притяжение ядром. Это обычно эквивалентно уменьшению избыточного отрицательного заряда и увеличению избыточного положительного заряда.
С другой стороны, по мере удаления внешнего электронного слоя от ядра все большее влияние оказывает экранирование (затенение) его положительного заряда промежуточным электронным слоем, что должно повысить легкость перемещения внешнего электрона. Наличие большого количества электронов во внешнем слое явно создает благоприятные условия для смещения большого количества электронных орбиталей. Тот факт, что деформируемость S -,/>, d-электрических траекторий вдоль этого ряда увеличивается, также является important. In вообще, для 18 ионов электронов при прочих равных условиях можно ожидать большей деформируемости, чем для 8 ионов электронов.
5) низкая стабильность 8-электронной оболочки по сравнению с 18-электронной оболочкой также показана в сравнении энергии ионизации, показанном ниже (m). Рисунок X1P-64.По своей длине он устанавливает связи между атомами углерода. * Koulsoi Ч. Успех * hnmni, 1 ″ 72, L 3. 554.、 К + С * * * Ск * ТУ4 + против * КРР + МНР + 8 е 31.8 51.2 73.9 99.8 128.9 18! Сто девяносто шесть Cu * Zn «* G. 3 * A » 54 ″ S » * + Br7 * 18 е 20.3 39.7 64.2 93.4 127.5 155193 Как видно из этих данных, разница в стабильности рассматриваемой электронной оболочки сохраняется в течение длительного периода времени.
в) количественные характеристики деформируемости отдельных частиц могут быть заданы в виде коэффициента их поляризации (а).Физическим значением этого коэффициента является величина диполя, который индуцируется в конкретной частице под действием внешнего электрического поля формулы, где q-сила£.Следовательно, чем больше Оса, тем больше деформируемость соответствующих частиц. Если частица представляет собой один атом, то величина а зависит только от легкости перемешивания центра тяжести электронной плотности по отношению к ядру (поляризуемость электронов-а.). в многоатомных частицах под действием внешней
Поли может происходить перемешивание взаимосвязанных атомных ядер(атомная поляризуемость-а«).Почти всегда a. > a «(например, для молекул HjO ae-1.45 p. a. — 0.04). таким образом, общую поляризуемость частиц(a = a » 4-A.) В первом приближении можно считать равной ее электронной поляризуемости. Электронная поляризация частиц, происходит в течение времени около 10 * —10 секунд. 7) значение поляризуемости обычно определяется по оптическим данным(но также используется теоретический расчет).
при измерении показателя преломления (l) вещества преломление молекул (cP / mol) вычисляется по следующей формуле: «»Около-1 М 2 «т (Где m-молекулярная масса, А D-плотность).Принцип фазовой аддитивности (III§ 6 add.13) по величине Ky можно разделить на преломления отдельных атомов (или связей), образующих молекулы. Простая сумма известных значений I позволяет найти преломление других молекул, в том числе и этих атомов(или связей).При применении к органическим соединениям со слабополярными связями этот подход дает хорошие результаты и широко используется для установления структурных формул(?
Аналогично, атомы (или связи) неорганических соединений могут быть преломлены и экспериментально определены значения RM. Однако простая аддитивность здесь уже не рассматривается, так как полярность связи этого элемента с другими сильно отличается. Именно поэтому они пытаются определить значение отдельных атомов и ионов в условиях, максимально приближенных к»свободному»состоянию R. Эти условия могут быть оценены по-разному, поэтому результаты разных авторов обычно несколько отличаются.
Изменение R конкретного атома или иона, в зависимости от природы его партнера, является ценным показателем природы химической связи. Например, атомное преломление кислорода составляет 4,1 в PO, 3,6 в SOJ или 3,3 в CU7.Из уменьшения этих величин можно сделать вывод, что поляризация кислорода в этом ряду возрастает, а связи с центральным атомом ослабевают в полярности. Применение рефрактометров в химии имеет специальную монографию. 8) зависимость между преломлением и поляризуемостью определяется формулой R » 4 ″ /ЗЛУУ * а (η = 3.14.NA дается в числе Авогадро). в вычисленном виде это уравнение * Б » Ц1ко> СДС, Сфухтриая рефрактометр. М.. Эд.
Московский государственный университет. 1959.223 СГ Он принимает вид » RH » = 2.52 a. выбранные значения коэффициентов поляризации некоторых атомов, ионов и молекул (a-10 см) сравниваются ниже. Ч он ЛТ быть ч «и * Бей + о» с ДНС * СN-н о Нјѕбыл 0.41 0.20 5.00 1.91 14.7 0.03 0.005 1.83 4.91 0.56 3.31 1.45 3.78 О Ж Е Н И Е на мг о5-Ф «на * мг’ * КР + ЗН * * гороховый + НХ * СН4 ЧД 0.79 0.64 0.3 сек 9.05 ^ 5.48 2.63 0.95 0.19 0.10 0.43 0.28 0.46 1.61 2.61 3.94 Ов ки Ар к КНП „с г к *, Са2 * АГ * СД2 * СО2 * вси NHj CfHi 3.02 2.26 1.59 17.2 10.2 8.26 3.48 0.Н9 0.55 1.63 1.05 0.28 2.65 2.18 4.53 ГУ Бр кг Ср море-Бр-РБ РБ * соединение srj * Ау * Привет * Н1 * * * Евр. не с “ ч» 4.29 3.21 2.41 21.1 13.2 10.4 4.83 1.49 1.02 2.07 1.38 0.24 3.65 1.76 4.27 Т Е 1 ХЕ в CS Ба чай〜я «по CS * Б» Д + Тл * РЬ * * ТС *
привет со CjHj 5.72 5.59 3.93 26.1 14.8 14.4 7.23 2.55 1.85 4.21 3.69 0.48 5.45 1.84 3.33 9) поляризуемость-это сложная x-частица, которая отличается, когда направление отличается. И да Величина а в них является средним значением поляризуемости в 3-х направлениях: перпендикулярно координатам. Например, для молекулы НАО она находится вдоль линии связывания<Xj = «5.20, 2 линии перпендикулярны ей aza» = 1.90.И полная скорость поляризации a■ ««(oci + a2-f a5): 3 = » 3.00.
Наиболее высокая поляризуемость вдоль линии связывания характерна для других линейных молекул. 10) термины «жесткий» и «мягкий» обычно относятся к ренеским кислотам и основаниям (IX§ 2 дополнительные 5), кроме того, в определение жесткости вводятся малые размеры, высокая электроотрицательность, окислительная стабильность, определение мягкости-большой размер, низкая * электроотрицательность, легко oxidize. It следует отметить, что отдельные части таких комбинированных характеристик часто противоречивы. Именно поэтому невозможно создать единую четкую классификацию, основанную на этих терминах.
Этот последний термин считает, что его главным достижением является обобщение полученных экспериментальных данных. И мягкий-мягкий.«По существу, это означает малую роль в» жесткой «комбинации и большую роль в роли «мягкой» поляризации (главным образом дополнительных поляризационных эффектов). другими словами, проблема сводится к новому термину смутно осознанного поляризованного выражения(см. XIV§ 3 57)) для твердых и мягких кислот и оснований, есть обзорная статья*. 11) многие ситуации мешают нам успешно использовать концепцию поляризации с точки зрения количественной оценки.
Прежде всего, заряд Иона не является точечным, величина а определяется однородным полем световых волн, но при нормальном межионном расстоянии около 2-4 а поле очень неравномерно. Расчет показал, что величина а должна увеличиваться при сильном электрическом поле (напряженность около 10 * В / см), но проверить это невозможно experimentally. At в то же время, по мере увеличения поляризации ионов, их поляризация должна уменьшаться, но это не ясно по какому-либо закону. 12) попытки поляризовать расчет ионных взаимодействий без учета всех этих ситуаций обычно не приводили к хорошим результатам.
Например, для вычисления дипольного момента молекулы Иона типа AB было выведено уравнение. И _ Эд {1-[Д»(А,+ а.)+ 4а, о]} /(</•- 4А, а、) (Где e-заряд электрона, d-ядерное расстояние, A \и a-поляризуемость ионов). как показывает следующее сравнение, оно в целом применимо к щелочным молекулам галоида: КР ККИ КВГ ки 6.1 10.1 10.5 11.3 8.6 10.3 10.4 11.1 РБФ RbBr 8.3 10.6 8.6 10 CSL 11.2 10.2 СКП CsCl 8.1 10.4 7.9 10.4 Нацмен 8.7 9.0 Губы LlBr 6Х)6.1 6.3 6.2 Нал 9.3 9.2 L1I 5.2 6.9 ДВП и » КС » Т * Pearson P. J. and advances in chemistry. 1971, м. 7. I2S9.
Однако для молекул TIC1 T1 a1 2.9 (а не 4.2 по оптическим данным) и очень легко деформируемые анионы H «(а-14, 7) дают отрицательное значение дипольного момента. Это, конечно, не означает, что это направление бесперспективно. 13) электрическое поле, находящееся на расстоянии r от точечного заряда e, определяется уравнением£= e / g. So для одиночного заряженного Иона с радиусом 2 А, Е = 4,80-10_, в:(2-10-)*-1.2-10 *в абсолютных электростатических единицах или E = = 1.2-K ^ — ZOO = 3.6-10 *
В /см. точный расчет электрического поля вблизи IOIA, невозможно сделать последний точечным зарядом, но все же представленные результаты дают положительный порядок учитываемых величин, при обычных условиях взаимодействия новой напряженности поля они определяются по формуле 14) количественная оценка поляризационного эффекта ионов обычно использует функции вида g / g*, g / g («ионный потенциал») или g * / g. as примером использования этих функций является сравнение на основе ионного потенциала химических свойств лучших гидроксидов различных элементов possible. As это видно из рисунка XI11-65.
Приближенная гермафродитная граница 18 электрон-ионов (внизу рисунка) резко смещается в сторону более низкого ионного потенциала по отношению к 8 электрон-ионам (вверху).Это ясно показывает очень сильное влияние поляризации 8 ионов электрона сравненных до 18 ионов электрона. 15) общим недостатком вышеуказанных особенностей является то, что. Принимая во внимание структуру внешней электронной оболочки Иона. Например, ионы Na *(8 электронов) и Cu *(18 электронов) с равными радиусами (0,98 а) должны иметь одинаковый поляризационный эффект по смыслу этих функций.
Это соответствует reality. In кроме того, положительно заряженные атомные ядра типа C4%P** и др., не существуют в отдельных состояниях, но оказывают сильное поляризационное воздействие на непосредственно связанные с ними частицы, что почти нехарактерно. Поэтому рекомендуется использовать функции, учитывающие индивидуальные особенности каждого человека. Для положительно заряженных частиц элемента можно предложить»потенциал поляризации»(7).Это определяется соотношением 7 2 / / g(2 / — сумма потенциалов ионизации, соответствующих образованию конкретного Иона с зарядом z из соответствующего нейтрального атома).
Если вы получите значение водорода на единицу (13.595 e), вы получите удобную шкалу относительной поляризации Потенциал(ПП): Ли * Ди * быть » Гэ «МН+ б» п » КЛ » с » С » Н » с 0.40 0.96 1.01 0.88 0.85 1.75 1.48 1.88 2.13 2.72 3.93 3.39 НС * Бр * м * » ЗП » ЧП » Ал » как » CR » Си » Р » КР » Оля 0.87 0.830.10.89 13! 1.39 1.33 1.95 1.88 2.60 3.28 К4 Я * Ца » РВ » Ко » СК » СБ » МН «Специальное Положение Те4 * ТУ4 * А» 5 * МО» 0.32 0.77 0.66 0.83 0.92 1.08 1.23 1.39 1.78 1.68 2.49 2.77 РБ * КР * Ср » ЗН » НЛ » Г » Би » Фэ ’* Се4 * Zr4 * СБ » СЭ » 0.31 0.57 0.61 1.01 0.95 0.96 1.21 1.34 1.91 1.42 2.21 3.20 КС * АВ + ва » КР » КР » Ла » га » со «СН4 * у4 * бл» те» 0.29 0.56 0.56 0.95 1.03 0.89 1.40 1.43 1.71 2.4! 2.22 2.8 е Ти * Аи * ст » НД » ПД » Тл » в » РЗ «Pb4 * НБ» CI5 * Cl7 * 0.45 0.68 1.01 1.07 1.02 1.38 1.3! 1.39 1.78 1.96 2.91 4.
30 (Оба радиуса близки) по сравнению с 8 электронными катионами, очень большой эффект поляризации 18 электронных катионов хорошо виден на этом масштабе. Выражение. Появляются также тонкие индивидуальные черты. Например, сингулярное поведение максимума (Cu maximum) значения PP Иона ЕС в элементах середины 4-го периода. МН «Фе * 4 Перекидных» * Н1 * * КР * 4 Зо 0.85 0.89 0.92 0.95 1.03 1.0)
18) на основе подобия K4 и F («с одинаковым типом структуры и одинаковым радиусом внешней электронной оболочки»), исходя из функции G / g *анионов элемента, получены следующие значения относительного поляризационного действия. Ф-СГ Бр-Г О * «С * — енто *〜 Ом 0.17 0.15 0.12 0.65 0.36 0.31 0.26 Таким образом, элементарные анионы также могут быть включены в общую таблицу. •Се ОК ва СЗ Ла-мг ScCfr Вт-Аль-Тл НБ в Мб Си СГ Osmono’e Lmfots / gmys * Nislotpys t g z 4 5 6 7 8 9 W P Основание / s: Lmfotrrmys 1 <NiSlot / S CD и Zn в ГА ЗП бл ВВ Гэ АА Рисунок XIII-65.Ионный потенциал и химические свойства гидроксидов.
17) на примере молекул NaCl и AgCb с приблизительно равными ядерными расстояниями (2,36 и 2,28 а) выявлены различные интенсивности поляризационных взаимодействий с анионами 8-18-го электрона на близком расстоянии; их дипольные моменты равны 5 в NaCl и 9,0, а случаи AgCI —7-очень разные. Полярность связи, рассчитанная по ним, составляет: OD для NaCl) и 0,52 для AgCl. То есть, 2-я молекула этих молекул намного меньше、
18) интересны различия в диэлектрической проницаемости кристаллов, образованных 8 и 18 электронными катионами. Таким образом, значения T NaCl (5.6) и NaBr (6.0 Гораздо меньше, чем CuCI(10.0). Информацию agci (12.3) и^ ХГ » сі » Бр » я » Агбр(13.1).Отметим, что поляризация таких солей обусловлена не только деформацией Ионов, но и 5—. — Дж.- Но и упругим смещением под внешним воздействием Р__, поле. ^ ^ 19) из серии, приведенной в тексте、 OH-и CN-из 1 1 1 валентного аниона、
Диаграмма XIi-66.Схема выравнивания силы задается постоянным диполем. Это обстоятельство делает поле общей поляризацией. Яей. Он ожидает присутствия между ними и некоторыми химическими веществами Сходные элементы. Действительно. HCN диссоциирует очень слабо, как вода, и большинство цианидов металлов сходны по растворимости с соответствующим гидроксидом и т. д. Однако ионы CN отличаются от гидроксибиря очень большой деформируемостью (С1〜близкой к деформируемости).
Ранее(111§ 7) уже указывалось, что по мере усиления внешнего поля величина постоянного диполя молекулы все больше отступает на задний план по сравнению с ее деформируемостью. То же самое относится и к ионам. Что касается CN-и даже более легко деформируемых тяжелых ионов галогена, то вышеизложенное может быть ясно показано на рисунке. XII1-66.In в случае относительно слабого внешнего электрического поля (L) суммарная поляризация CN » значительно превышает поляризацию галогенид-Иона из-за наличия постоянного диполя.«
Когда пол становится большим (B. G), тяжелые Галоидные ионы догоняют и даже перегоняют CN». Следовательно, под действием достаточно сильного внешнего поля CN-должен был уже приобрести сходство с тяжелыми ионами галогена, заметно отклоняясь от OH, что затруднительно deform. It влияет на соединения соответствующей сильной поляризацией катионов. Свойства AgCN уже гораздо ближе к соответствующему Галогениду, чем к гидроксиду.
20) образование производных оксида ртути может сопровождаться дополнительными поляризационными эффектами. Результаты рентгеновского анализа галогенидов NdaHa (рисунок X11 — 62) показывают линейную структуру их молекул G — Hg — Hg-G. Но сами эти результаты отражают лишь реальность, связанную с кристаллами, которые под влиянием взаимодействия молекул могут существенно искажать структуру, характерную для отдельных состояний.
С другой стороны, характер взаимодействия Галогенида hgr2 с металлической ртутью(XII§ 4 add.122) и зависимость от природы аниона устойчивости производных Hgj (no ^ —CG — Br «—I» —CN «- SOJ» —O3 ″ 〜 Sa -) более согласуется с молекулярной структурой типа HG•Hg1, основанной на поляризационных взаимодействиях, чем общепринятая. 21) эффект поляризации должен проявляться не только в энергии образования. Например, расчеты показывают, что в молекулах галогенированных щелочей ядерное расстояние значительно меньше расстояния, соответствующего образованию этих молекул из недеформированных газообразных ионов.
Уменьшение поляризации ядерного расстояния (а) показано в таблице ниже. У * Н * * К * РБ * Си п- 0.28 0.18 0.19 0.21 0.23 г. Около 0.30 0.26 0.26 0.26 ВГ » 0.45 0.34 0.29 0.28 0.27 Д 0.49-033 0.32 0.30 0.28 Согласно серии F «-C1—Br», эффект поляризации увеличивается во всех случаях, но мы можем видеть, что он является самым сильным В Li *Галогениде и самым слабым в Cs * Галогениде. С фторидом наблюдается некоторая деформация K . Rb и Cz * Ион F«. Б * И Д * С9 в * 29kkqp / мм * Ряса. XI11-67. схема молекулы «смдрупблох».
22) возможно, что именно поляризационное взаимодействие определяет стабильность» квадрупольной » молекулы, простейшим представителем которой является Галогенированный щелочной димер. Например, LijCIj (§addition. 80). Как видно из рисунка XI 11 * 67. Участие в программе в2н $(СИ§Я добавить.83) и AI2CU (XI§ 2 add.54) может быть присвоен тому же типу. С этой точки зрения центральный ромб (Li*, H * B .
Связь между положительными компонентами (CUA1), больше (Н〜, а= «14.7) или меньше (CI», «3.5) сильно поляризованной отрицательной составляющей kx. 23) для молекул простейшего типа АВ сильное поляризационное действие Н проявляется только в уменьшении полярности, а для более сложных типов соединений оно может также влиять на форму частиц (точнее, на относительное положение атомного ядра).Рассмотрим молекулы воды в качестве примера.
Наиболее естественно выглядящее расположение ионов H может быть далеко друг от друга. То есть при диаметре ионов Оа〜(а, рис. XIII-68) индуцированные там диполи полностью смещены друг от друга. Однако такое линейное расположение всех 3 ядер соответствует неустойчивому равновесию. Фактически, даже при незначительном смещении от диаметра ионов Н *индуцированные ими диполи добавляются друг к другу и полученному диполю{B. рисунок XIII-68).Обратное действие последних на оба Иона Н *(притяжение отрицательными концами и положительное отталкивание) приводит к возникновению сил, направленных на их сближение (Б, рис. XIII-68).
Этот подход продолжается до тех пор, пока равновесие не будет поддерживаться взаимным отталкиванием обоих H ions. As в результате устанавливается треугольное расположение всех 3 ядер ионов, что соответствует устойчивому равновесию. 24) пространственная структура большинства молекул в основном определяется неполяризованным эффектом, но в некоторых случаях последний играет роль важного поправочного фактора.
Иногда они явно даже самые important. So, CaCIj, CaBr?, Calt, SrBrj, Sri * магнитные данные с линейной структурой (XII§ 3 add.56) в результате треугольной структуры молекул CaF*, SrF, SrCI *и BaG мы находим естественное объяснение изменений в ряду Поли-фаз CA1 * 〜 > Br> I — (добавление 16). В молекулах 3F <фторида, разделенных нейтральной матрицей, нейтральной матрицей были определены следующие углы F3F: 158°(Mg),140°(Ca), 108°(Sr). 100°(Ba). как видно из концепции поляризации, угол значительно отличается от 180°, и поляризуемость центрального атома более важна.
По-видимому, нелинейность является особенностью многих молекул типа ЭО.«Итак, SiOj в паре линейный, но это TiO 2, ZrOj, CeOi, ThO. Дао. U02 обнаруживает наличие дипольного момента, указывающего на угловую структуру. 25) фиксацию внешней электронной оболочки аниона под влиянием введения ионов Н * можно рассматривать непосредственно путем измерения работы отделения электронов от it.
As из приведенных ниже данных видно, что энергия ионизации (эВ) молекулы Галогенида водорода значительно превышает энергию ионизации Иона G «и приближается к значению соответствующей длины нейтрального атома галогена. Ф „ВЧ СК г уб ки и Бр“ Евр. БР и Г Привет я 3.5 15.8 17.4 меня 3.8 12.8 13.0 я 3.5 А. 6 11.8 | 3.3 10.4 10.5 В результате одновременное введение электронов и протонов в электронную оболочку вне атома электрона имеет мало общего с его стабильностью. Ситуация почти такая же, даже с H, 0 (12,6 ЭВ) и O (13,6). H » S(10.5) и S (10.4). РН (10,0) и Р (10,5), а также энергия ионизации молекулы NH (10,2) меньше энергии ионизации атома N (14,5).
26) дополнительное напряжение, возникающее при взаимной поляризации ионов, которое должно влиять на энергию кристаллической решетки, возрастает по сравнению с величиной при отсутствии деформации(XII§ 2 доп. 79).Косвенно это можно подтвердить, сравнив аналогичные соли 2 катионов с равными зарядами и катионами, близкими к радиусу. Один из них имеет больший эффект поляризации, чем другой. Рисунок XIII-68.Схема поляризационного взаимодействия молекул воды.
Численное значение энергии кристаллической решетки таких 2 пар (ккал / г-экв) показано ниже Си * Д Ка * Н * Т | * Г РБ * (О. еда) 10.98 А) (И. 49А) стр. «А») С г 232 46186325(5.0)178 14164 Wh-226 49177315 (5.5)174 16158 D 219 54165307 (6.2)168 19149 Как видно из приведенного выше сравнения, энергия солевой решетки более мощная, чем у поляризационных катионов с 18 и (18 + 2) электронными оболочками. Из-за включения H *в Анон, разложение Галогенида водорода на свободные газообразные ионы требует гораздо больше работы, чем с EG-типом salts. In кроме того, в серии Cl-Br-I это становится несколько проще. Данные в скобках соответствуют распаду твердотельного галлонного водорода на молекулы свободного газа.
27) возникающие между ними дисперсионные силы всегда накладываются на кулоновские и обычные поляризационные взаимодействия ионов (III§ 7).Показателен тот факт, что вызванное ими взаимное притяжение действует между выигравшими за одну и ту же плату. С его помощью сила отталкивания их Кулойово несколько ослабевает. Дисперсионный эффект при прочих равных условиях возрастает пропорционально произведению коэффициента поляризации (а) обеих взаимодействующих частиц, поэтому его относительная роль особенно велика для производных 18 электронных катионов. 28) еще одним фактором, который так или иначе влияет на полную энергию кристаллической решетки, является нулевая энергия Вонга(II§ 2).10).
Его вклад незначителен(например, 1,8 ккал / моль для NaCI,1,3 ккал / моль для AgCI).Тем не менее, она несколько ослабляет решетку. При нагревании колебательная энергия ионов непрерывно возрастает, и в конечном итоге решетка разрушается. То есть растворить вещество. При теоретическом рассмотрении многих проблем, связанных со свойствами кристаллов, часто используются квантовые понятия тепловых колебаний-О и о и Х.
29) аналогично описанному в тексте, поляризационное взаимодействие ионов влияет на решетку тройных соединений. Здесь его усиление способствует переходу ряда структур: типа CaFj — > Ty2, слоистой решетки — * ■ молекулярной решетки. Конечной структурой, характерной для сильнейшего поляризационного взаимодействия ионов, является опять-таки молекулярная решетка. 30) однако в качестве промежуточного типа здесь часто встречается слоистая решетка. Хорошим примером этого является кристаллическая структура Cdl2.As это видно из рисунка XI11-69.
Поскольку катионы слоев отделены от анионов другого слоя, межслойная связь может быть обусловлена только дисперсионным взаимодействием анионов (оценивается в 7 ккал / моль).Тот факт, что кристаллы не распадаются самопроизвольно вдоль отверстия расщепления, указывает на очень сильную поляризацию анионов, а взаимное электростатическое отталкивание анионов фактически сводится к culling. In примерно таким же образом ромбический Анон»квадрупольной» молекулы должен быть поляризован(добавить
22). Особый интерес представляет структура йодида кадмия. Это связано с тем, что гидроксиды многих двухвалентных металлов, мг, кристаллизуются по типу. Около Цинк. Например, Cd. Потому что существует постоянный диполь в OH*. Усиливает поляризационное взаимодействие с катионами. Слоистые решетки часто встречаются с более сложными составами соединений (рис. XI1-70).
31) по мнению Голиашмидта, помимо размеров взаимодействующих между собой ионов и общей интенсивности поляризации,» степень симметрии » этого взаимодействия имеет большое значение для выбора типа кристаллической структуры. Чем ближе оба Иона друг к другу по своим поляризационным характеристикам, тем больше Может возникнуть структура с большим координационным числом.
Напротив, резкая разница в поляризационных свойствах 2 ионов способствует появлению структур с низким координационным числом. Эта закономерность объясняет, например, кристаллизацию TICI, T1Br, Tl! Как СЭС! (CN 8), подобные соли рубидия кристаллизуются как NaCl (CN 6).на самом деле ионы Tl *(1.49 A, 18 + 2 электрона) по деформируемости гораздо ближе к галогенидному аниону, чем ионы Rb * (1.49 A, 8 электронов).С другой стороны, кристаллизация, например, LiBr (Rk / Ra = «0.4 О») и Lil (RK / Ra = 0.35) не относятся к типу 2nS (CN 4), и NaCI не согласуется с рассматриваемой закономерностью.
32) ограничивают возможность одностороннего смещения за счет увеличения внешнего давления Кристалла, уменьшения его объема, то есть за счет сближения ионов друг с другом (рис. XII1-58).Таким образом, ОИО может быть как ожидается, будет поддерживать переход из множества структур, связанных с увеличением количества координации и формирования более/ д герметичной упаковке (ХІІ§ 2, дополнительные
39).В самом деле,^ oKyt показывает, что при давлении 5,000,4,600,и 4,050, соответственно, давление кристаллизоваться в виде хлорида натрия rbci в данный момент, RbBr, РБТ и, как правило, превышает CKCL 33)» CSCL » самопроизвольное возникновение структуры центрального Куба в CsBr и Csl обусловлено дисперсионным взаимодействием легкополяризованных ионов. Незначительное увеличение количества ядерных пролиферативных / NaCI (CN 6) S состояний при переходе от структуры к структуре CsCl (CN 8) (около 3%) компенсируется большим числом контактов между противоположно заряженными состояниями, что приводит к увеличению дисперсионного взаимодействия.
Для Csl oio оценивается в 13 ккал / моль. 34) Как видно из рисунка XSh-71, степень сжатия Галогенида рубидия значительно выше степени сжатия аналогичных солей Таллия (см. XII§ 2, 77), хотя эффективные радиусы катиона равны. Это связано с гораздо большей поляризацией взаимодействия ионов в солях TI. Поэтому сама кристаллическая решетка становится более сжатой и менее восприимчивой к внешнему давлению. Аналогично, относительная степень сжатия галогенида серебра намного ниже, чем относительная степень сжатия аналогичного галогенида натрия.
Наци 2.8! AgCI NaBr Agbr Nat 2.77 2.Эд 2.88 3.23 2. » 0,57 л 0,66 1,68 0,90 35) из вышесказанного LiF может выступать в качестве»ослабленной модели» MgO(энергия кристаллической решетки этих первых соединений равна 247, 2-го-942 КЛ / моль).Аналогично ослабленный режим # ШБ о-о Рисунок XIII-70. Расположение атомов в Кристалле SbjOj (ромб). 20 90 Юлий п & п Рисунок HGG1-7G. степень сжатия галогенидов Rb и T |. Если. Один•»•»»•••» Относительная степень сжатия…… BEF (mp 821°С), относительно SiO (mp 1723°С).CaFj (Мп 1414 ° С), в отношении генерального директора (МП 2200° с), LiaBeF <(Мп 4556°) (Мп 1890®С) в отношении MgaSi04 и т. д.
36) влияние на температуру плавления изменения поляризационной активности катиона. Из-за своего изменения радиуса, его можно хорошо отслеживать с галоидом щелочного металла salts. In в соответствии с вышеизложенным температура плавления соли любого аниона при отсутствии односторонней деформации в кристалле должна естественным образом повышаться по мере уменьшения радиуса катионов, то есть вдоль ряда Cz4-Li4.
Однако в той же серии должно происходить снижение температуры плавления, так как поляризационный эффект катиона быстро возрастает. Фактические зависимости показаны на рисунке в результате сочетания обоих факторов. XI11-72. Поскольку ионы F » Na4-Cs4 обладают односторонним поляризационным эффектом, необходимо учитывать только катионные радиусы. — Изменение температуры плавления серии CsF происходит приблизительно. Значительно деформируется «F», в результате чего температура плавления LiF оказывается значительно ниже, чем соответствует радиусу L14.
Помимо Li, Na4 начинает оказывать заметное влияние на более легкие деформированные io1 и C1 -.Для элюида, который легче деформируемого I, температура плавления Nal ниже, чем KI (XI§ 4 дополнительные 28), потому что влияние Na4 уже очень велико. Таким образом, увеличение односторонней деформации кристалла » может привести к полному обращению ряда плавления TeWnepBtyp, когда он заменяется более простым деформируемым анионом, по сравнению с рассмотрением только изменения радиуса.
Аналогичная картина наблюдается для пренаттов щелочных металлов:♦ LlReOj N » ReO «KReO» RbReO <CsReO* 428 414 563 598 6I6 ° С 37) температура плавления э & м качественно характеризует легкость перехода сухого вещества из твердого состояния в жидкое, а температура кипения аналогично характеризует легкость перехода вещества из жидкого состояния в газообразное, то есть его летучесть. По-видимому, нагрев расплавленного солнца обусловлен тем, что в большинстве случаев при испарении выделяются отдельные молекулы. Дальнейшее приближение к молекулярному типу внутренней структуры.
Пара односторонней усадки (простейший случай бинарного соединения), образовавшаяся в результате взаимной ионной деформации, испаряется при введении отдельных молекул. Но в процессе испарения каждая такая пара должна бить по цепочкам соседних пар, действующих со стороны жидкости. Последнее, чем больше заряд ионов, и чем меньше радиус, тем он сильнее.
Поэтому при использовании однотипного соединения летучесть возрастает с уменьшением заряда! Ионный. Таким образом, температура кипения MgO составляет 3600 * С, а LiF-prv 1681 * С. Эффекты изменения ионных радиусов и деформационных взаимодействий также могут быть хорошо отслежены галогенидом щелочи example. As как видно из рисунка XII1-73, общий характер действия обоих факторов очень схож с тем, который имеет место при плавлении point. An интересным отличием является явно минимальное значение CsF, обусловленное деформацией Cs4 по f’ионам.
38) усиление односторонней деформации при испарении солей е » характеристика Иона отчетливо проявляется в уменьшении ядерного расстояния по сравнению с характеристикой」 Радиус и он * ь Ряса. Xt 11 * 72.Закал * * растворенный щелочью тур. для кристаллов. Хорошим примером является следующее сравнение данных по галогенидам Rb *и TI *. Нуклеотиды, нуклеотиды, нуклеотиды. Расстояние L. Non-non-A. расстояние * Пара РБ. И радиус. И в парах. тг А. А. RbCl 2.7 ″ 0.51 3.30 0.82 2.48 TICI RbBr 3.45 2.94 0.51 0.83 2.62 Тlbr 3.18 0.51 3.69 0.88 Вт Тил 39) некоторые вещества термической диссоциации отчетливо проявляются до достижения температуры кипения или даже до плавления. особые свойства взаимодействия ионов па.
Обычно деформация ионов просто заменяется увеличением или уменьшением числа электронных орбит во внешнем слое, без изменения квантового числа, характеризующего эти орбиты (непрерывная деформация), но здесь отдельные орбиты из электронной оболочки вне ионов сопровождаются изменением их основных свойств расширения и сжатия (разрывная деформация).
Оба случая схематично показаны на рисунке. XIII-74.In в случае односторонней непрерывной деформации анионов (а) общий эффект может быть грубо представлен смещением всей электронной оболочки к катиону, а в случае разрывов (5) — только отдельными траекториями, но смещение достаточно велико. В обоих случаях величина диполя, возникающего в ионах при деформации, больше или меньше этой величины. Поэтому при рассмотрении свойств веществ, связанных с полной поляризацией ионов, важен вопрос о непрерывных или прерывистых свойствах деформации.
Напротив, все свойства, связанные с квантовым скачкообразным движением электронов (в частности, например, термическая диссоциация галоидных солей), имеют существенное значение. Взаимное отталкивание электронной оболочки ограничивает приближение одного иона к другому на известное расстояние, но на отдельных электронных орбитах деформируемых ионов внешняя электрическая энергия и поляризованная ионная оболочка являются непреодолимыми препятствиями.
Но как только электроны введены, они помещаются под влияние внешнего избыточного заряда, а не большего эффективного заряда своего ядра. Если это действие достаточно велико, то следует окончательное отделение электронов от анионов и их переход в катионы. Непрерывный или прерывистый характер деформации зависит как от характеристик самих взаимодействующих ионов, так и от внешних conditions.
It это очень возможно, особенно если последняя резко переходит в непрерывную, если она достигает определенной степени непрерывной деформации. Этот переход происходит тогда, когда общая односторонняя поляризация Ионов еще недостаточна для создания возможности плавления (или кипения) вещества. Результатом таких случаев является термическая диссоциация до достижения температуры плавления (или кипения).Имеется монография по термической диссоциации неорганических соединений В цифрах 1У В» Рисунок XIII-73.Температура кипения щелочной пыльцы.
40) истинной причиной увеличения обратной поляризации вследствие нагрева является не изменение силового поля металлов и образующихся полуметаллов, а затенение разности поляризационного эффекта кислорода вследствие усиления колебательного движения металла. ions. As в результате распределение о * неионов между металлом и металлоанами, образующими анионы, становится более равномерным с повышением температуры, что в конечном итоге приводит к разложению солей на оксиды металлов и полуметаллы oxides.
At более низкие температуры. Чем меньше разница между поляризационными свойствами металла и образующими его анионами, то есть тем больше поляризация этого металла. 41) содержание вышеизложенного непосредственно относится только к простейшему типу солей ав (то есть нитратов одновалентных металлов, двухвалентных сульфатов и др.).Однако общая природа паттерна одинакова для перехода к типу соли AB2.
Эйб и другие. Хорошим примером сложного случая является изменение термической стабильности карбонатов щелочных металлов(rns.(См. XIII-27.)Кроме того, отклонения от обычных рядов солей Rb *и Cs *, вероятно, связаны с присущим им вариантом этих cations. As в результате усиливается эффект поляризации. Для сравнения интересно отметить, что в Ag2C03 давление COj уже достигает около 218°C при 1 атм. Для молибдатов и вольфраматов щелочных металлов обнаружены необычные изменения термической стабильности (Li K> Rb> Cs), что близко к случаю carbonates.
As редким исключением, полной инверсией ряда является уранат M3UO«(XI§ 7 add.29). 42) даже если антиполяризация полностью отсутствует, вследствие нагрева солей некоторых кислородных узлов, усиление односторонней деформации анионов должно в конечном итоге привести к пиролизу анионов. Поэтому основной причиной такого затухания является присущая тепловая нестабильность anion. In в дополнение к этому, по-видимому, существуют относительно слабо поляризованные случаи щелочных (и щелочноземельных) металлов и солей, таких как N0 ^и ClOJ в солях. Здесь пиролиз протекает с расщеплением аниона кислорода.
43) в тесной связи с вышеизложенным возникает проблема в химии действия таких катализаторов, как соли Ag, которые часто используются при фактическом осуществлении окислительно-восстановительных процессов. С точки зрения, развитой в тексте, это может быть связано с резкой обратной поляризацией окислительных анионов. Такая обратная поляризация может быть очень значительной из следующих данных о постоянной диссоциации кислоты (больше значения H): AgSH-5-I0 -. «Очень возможно, что обратная поляризация подобных молекул поверхностью катализатора играет важную роль во многих случаях гетерогенных катализаторов.
44) снижение стабильности анионов, которое необходимо для четкого выражения окислительных свойств, также может быть достигнуто нагреванием. Отсюда нейтральные соли многих кислот кислорода (KNOj. Например, KCIOj).Являясь типичным окислителем в растворе, он может быть таковым при высоких температурах (в расплавленном состоянии).
45) как известно,» белый » свет (например, солнце) бывает смешанным. — Я не знаю, если я собираюсь быть в состоянии сделать это. S. термическая диссоциация соединения. М. » Металлургия.»I960. 574р. Ряса. XI11-74.Схема непрерывной (L) и непрерывной (b) деформации. Помогите стеклянной призме (рисунок II-9).Если какой-либо объект пропускает лучи видимой части спектра (то есть длины волн 400-700 ММК), то его называют пропускающим. —
Непрозрачный. Прозрачные объекты (например, обычное стекло), которые полностью пропускают все лучи видимого спектра, кажутся бесцветными, непрозрачными. Тело, которое отражает их хорошо (например, обычная бумага). что касается белого тела, термин»бесцветный»также часто используется. ТОО $ 00 500 ″ 490 лли * о вольны, НЖ Рисунок XII1-75.Отражение света металлом. Когда тело полностью подавляет (поглощает) все входящие лучи видимого спектра, оно выглядит черным.
Если такое поглощение неполное и примерно равно отдельным лучам видимого спектра, то тело будет выглядеть окрашенным в разные оттенки серого. Последнее, в частности, характерно для большинства металлов, и благодаря высокой отражательной способности света получается»металлический блеск» (но только на достаточно гладкой поверхности).
Например, серебро (рисунок XSh-75) светит гораздо сильнее никеля, но общий отражательный рисунок этих металлических обоев почти одинаков, а в порошковом состнине они оба серые. В дополнение к тому, что было рассмотрено выше, существует хорошая вероятность того, что отдельные лучи света могут быть поглощены организмом по-разному ways. As в результате такого избирательного поглощения лучей в определенных частях спектра происходит как бы вычитание ИК-излучения из падающего света и тела (рис. XIII-
76). в таких случаях оставшиеся лучи(переданные, переданные или отраженные) объединяются друг с другом, придавая телу некоторую окраску. Особенно характерен металл. На золото. Другие примеры включают радар. XII1-77 кривая цветности длины CdS и HgS (естественная длина песка). как видно, оба соединения сильно поглощают лучи фиолетовой части спектра, поглощая очень слабо red.
By объединяя отраженные лучи света, общий цвет CD становится оранжево-желтым, а HgS становится оранжево-красным. 46) фантастическая другая видимая окраска окрашенного зверя зависит не только от его собственных оптических свойств, но и от характеристик человеческого глаза(рис. XIIM8). так, например, золото выглядит желтым цветом, но судя по его собственным оптическим свойствам (рис. XIII-75), золото должно быть слегка reddish.
In кроме того, цвет окрашенного твердого вещества сильно меняется время от времени, когда его измельчают. Например, относительно грубый оксид ртути красного цвета, в то время как очень мелкий оксид ртути является yellow. In во многих случаях это так Рисунок xlll-tb. Область поглощения■видимый цвет вещества. Наблюдаемый цвет несоответствие одного и того же вещества в кристаллическом состоянии и в порошкообразном состоянии. 47) Как видно из вышеизложенного, окрашенное вещество характеризуется сильным поглощением лучей 1 или другой части видимого спектра.
Соответствующую цветовую гамму можно увидеть из определенного сравнения, дополняющего друг друга Фиолетовый Сая синий Сая-Амаи Желтый желтый желтый красный тянуть прим Однако следует отметить, что часто встречается один и тот же цвет вещества, поскольку лучи разных частей видимого спектра объединяются и поглощаются (рис. XIII-76). Черный (и серый) цвет также является результатом поглощения лучей видимого спектра, поэтому черные объекты следует отнести к окрашенным objects. So, все вещества можно условно разделить на 2 категории (грубые и окршмзнмш*).
Первый характеризуется отсутствием значительного поглощения лучей видимого спектра и наличием последнего. 48) согласно теории строения атома (III§ 4), поглощение света вызывает скачок в определенной части электрона облучаемого вещества, что делает его более вероятным orbit. It важно, что последующий возврат электронов на начальную орбиту обычно сопровождается выделением уже излученной тепловой энергии. Таким образом, мы получаем эффект «вычитания» поглощенных лучей из общего падающего светового потока.
Очевидно, что скачкообразное перемещение электронов должно выполняться так же легко, как и разница между заданным энергетическим уровнем и ближайшей свободной орбитой невелика. если oio большое, заполненные орбиты стабильны, и скачкообразное движение происходит только лучами со значительной энергией, такими как ультрафиолетовые лучи, и только в этих случаях оно поглощается. Обычно область поглощения подавляющего большинства веществ находится в ультрафиолетовой части спектра (например, в диапазоне 170-250 МЛК), так как даже самые внешние орбиты электронов оказываются стабильными.
Таким образом, сдвиг поглощения в видимую часть спектра, отвечающую за появление цвета, должен происходить тогда, когда устойчивость отдельных электронных орбиталей соединения по какой-либо причине достаточно ослаблена (атом). 49) среди факторов, поддерживающих появление цветности, по-видимому, большое значение имеет несовершенство электронного слона в атоме.
Таким образом, зеленый цвет производных пр * (характерный цвет соединений некоторых других Лайтаидов), скорее всего, напрямую связан с несовершенством внешнего 2-го электронного слоя (20 электронов).Существенную роль в таких несовершенствах (в данном случае уже наружного слоя) играет цвет таких соединений, как производные Cr*, Mn * * То есть, скорее всего, чаще наблюдается более сильная окраска бесцветного теленка более высокого производного, причем более низкая валентность элемента. Следующая серия является примером. 2rCI4 2gCl,2frClj Бесцветный коричневый черный InBr, InBr * InBr Бесцветный желтовато-красный
Поглощение световых лучей в видимом спектре в таких случаях, по-видимому, обусловлено относительно неустойчивыми орбитами соответствующих катионов неиспользуемых валентных электронов. Противоположное положение занимает окраска соединений с более высокой валентностью(в катионе имеется полный электронный слой, он бесцветен с аналогичным производным TiCl4 ТИЦ!, Тlcl、 Бесцветный фиолетовый Чери VF, VF4 VF、 Бесцветный желтый цвет Низкий-обычно наблюдается только тогда, когда высокая валентность нестабильна.
Например, Pbc12 является бесцветным, а pbc1-бесцветным. yellow. As возможной причиной образования окраски является удаление отдельных электронных орбиталей C1-pbc14, PbC14 легко разлагается путем расщепления-открытия C1.It находится уже в нормальном состоянии. 50) особое значение имеет нечетное число от общего числа внешних электронов системы. molecule.
In на самом деле, оказывается, что этот тип соединения (например, N0-11 электронов), который почти не имеет исключений, является colored. So СУ2 (19 е)-зеленовато-желтый. N0″(17 электронов) — коричневый и так далее. Когда эта странность устраняется, цвет обычно исчезает. Например, димеризация NOj приводит к получению бесцветного NtO. 51) очень часто, когда рассматриваемая система содержит элементы различных валентных состояний, возникновение (или выделение) цвета является observed.
So, бесцветная смесь sbcls и SbClj темно-коричневая, бесцветная смесь Ce (OH)$4 и Ce (OH) 4 сине-фиолетовая, а при смешивании с раствором соляной кислоты CuCl (бесцветный) и CuCl2 (зеленый) жидкость получается интенсивно окрашенной в темно-коричневый и темно-черный цвета. Особенно показательным примером является вольфрамовая бронза (VIII§ 5 add.44). Электронный обмен Ep * + ef * «*между атомами одного и того же элемента в системе не имеет ничего общего с энергетическим эффектом. Однако несколько различное окружение обоих атомов создает энергетический барьер, уровень которого находится в пределах энергетического диапазона видимого спектра.
Заметим, что изменение положения атома происходит гораздо медленнее, чем то, которое отвечает за появление цвета электронного перехода. 52) важным фактором, который может определять цвет твердых неорганических соединений, является наличие вакансий в решетке (XII§ 2, доп. 13).Если энергия перехода электронов от анионов к вакансиям находится в оптическом диапазоне, то результатом является появление цвета. Например, вполне вероятно, что именно таково точное происхождение окраски оксидов тяжелых щелочных металлов (§ I добавление.56).
53) следовательно, орбитальный хак с высокой энергией скорее деформируется, чем траектория с низкой энергией, и поляризация делает их обоих близкими, тем самым способствуя появлению цвета compounds. To выяснив характер влияния деформации электронной оболочки на нее, рассмотрим возможные причины появления цвета меди с безводным галлием. CuF, CuCl2 CuBr, культ Бесцветный, желтый, черный.
Здесь ионы Cu * * притягивают к себе отдельные электронные орбиты анионов, и чем их больше, тем выше их deformability. So, если CuF бесцветен, то оба следующих галогенида уже окрашены. В случае Cul$, при снижении стабильности 1 орбиты электроны полностью вернутся в Cu*\, следовательно, в нормальных условиях может существовать йод меди и других металлов. 54) изменения радиуса некоторых аналогичных катионов оказывают различное влияние в зависимости от их structure. It было замечено, что появление окрашенных соединений из 8-ионных ионов обычно облегчается переходом снизу вверх в подгруппе, а переход сверху вниз из 18-ионного ions.
An примером может служить следующее сравнение элементов подгруппы титана (8-электронная оболочка) и галлия (18-электронная оболочка). TiCW TiBr4 Til4 Бесцветный, желтый, красный ZrCl » ZrBr4 Zrl4 Бесцветный, бесцветный коричневый Inlj 1pvg3 Inlj Бесцветный, бесцветный, желтый TIC1, T1Vg, наклон Бесцветный желтый черный Существование таких закономерностей очень согласуется с разработанными в тексте представлениями о различном характере вариации поляризационного взаимодействия, которое зависит от радиуса 8 и 18 электронов-ионов.
55) химия технеция дает интересные примеры эффектов поляризации протонов. Анион TcO^бесцветен, а молекула NTcO ^темно-красная. В аналоговых ТК марганца, Энн Mn07-это «само по себе уже цветные, но в рения в hreo молекула также бесцветный». 56) деформация анионов катионами гораздо важнее для цвета, чем обратный процесс, но достаточно сильная поляризация катионов с незаконченной внешней оболочкой может быть»окрашена» 1 собственным электроном. Это, по-видимому, и есть происхождение цвета фтора в следующей серии. Ирк, Клиренс Креатинина * CrBr2 ЧРИ, Мне НПФ, NpCIj NpBr, НПЛ、 Зеленый бесцветный дьявол.«
Красный / шумный.„Бесцветный зеленый коричневый 57) поскольку смещение полосы поглощения в видимый диапазон обычно происходит за счет ультрафиолетового излучения, то изменения цвета, возникающие при нагревании бесцветных соединений, чаще всего следующие: желтый-оранжевый-красный-черный (см. рис. XI11-76).То же самое относится, в общем, и к изменению цвета окрашенных веществ.
Например, в случае Smlj, между нормальной температурой и 700 ° С, происходит следующий переход: желтый-оранжевый-красный-коричневый-черный. 58) Если изменения цвета связаны с появлением новых полиморфных изменений, то они происходят при определенной температуре(точке перехода).В качестве примеров можно использовать следующие соединения. Sbl3 ′ in InCI Hgf, Tl! НКО Цвет прямой нормальное состояние красный желтый красный желтый белый Цвет ПРН отопление….Желтый, красный, желтый, красный. Точка миграции. С….. Сто четырнадцать триллионов сто двадцать миллиардов сто тридцать один миллион сто шестьдесят восемь тысяч сто восемьдесят три
59) изменение цвета некоторых веществ при различных температурах может быть использовано для изготовления термочувствительных красок. Наиболее известные из них основаны на соединении соли Ag2 [HgI“). Агно $и к? Раствор осаждается во время взаимодействия (HgI<}.Ярко-желтый цвет Agt {Hgl<) становится оранжево-красным при температуре около 50°С, а при охлаждении он возвращается к своему первоначальному цвету. Аналогичные цветовые переходы (красный**черный) происходят примерно при 70°C Cuj {HgI»]. в обоих случаях это связано с изменением поляризационного взаимодействия ионов вследствие перестройки кристаллической решетки.
60) влияние структуры внешней оболочки катиона на гидролиз солей будет выявлено путем сравнения констант диссоциации по схеме{E (OH)#} — * * * * 1Э (ОН2) $ он) + н: AI-I10*, CR-L0 ″ 4, GA-4•10-4.As вы можете видеть из этих данных близкое значение всех 3 радиусов OE(0.57-0.64-0.62 а) гидролиз усиливается от 8 электронных (AI) до 18 электронных оболочек (Ga) от неполных (Cr).он растет параллельно с увеличением поляризационного действия рассматриваемых катионов(дополнительно 15). с!)
В ряде случаев изучение гидролитических продуктов позволяет экспериментально установить свойства поляризации отдельных атомов в молекуле. Например, взаимодействие NF и NCI3 с водой протекает по схемам 2NF3 + 3HjO = N1O3-f 6HF и NCb +ЗНаО = NH3-F 3HOC1.As в результате азот положительно поляризован в молекулах NF3, в то время как галогены отрицательно поляризованы и наоборот в молекулах NCU. Аналогично азотированная сера гидролизует NH3 и серную кислоту, сульфуриды фосфора наоборот, H * S и кислородные кислоты фосфора. Таким образом, сера поляризуется положительно по отношению к азоту и отрицательно по отношению к азоту. phosphorus.
It следует также иметь в виду, что производные галогенов при гидролизе всегда выделяют соляную кислоту и кислород-сернистые соединения. Здесь мы помещаем все затронутые элементы в следующие строки: P, S, Br, CI, N, F. При соединении элементов этой серии вместе элементы справа отрицательно поляризованы(III§ 5 add.13). Примером использования такого подхода является выяснение взаимного расположения ряда электрических элементов, аналогичных металлоидной активности P, Se, Te и др.
Из опыта известно, что во влажном воздухе селенид фосфора выделяет H * Se и tellurium-pH. So теллур находится слева от фосфора, а селен-справа от него. 62) H *может проникать в электронную оболочку аниона, поэтому сила k в щели зависит, строго говоря, от поверхностной плотности отрицательного варианта аниона, а не от поляризационного действия аниона в обычном смысле(добавлено к V $ 5).Однако оба свойства тесно связаны друг с другом и изменяются одинаково. Поэтому из-за единообразия толкования это уточнение в тексте не подчеркивается.
63) на заре развития электронной концепции химии коссель прочитал HF <НС! Изменение силы кислоты было объяснено. <HBr < HI H * из-за чистого электростатического (кулоновского) взаимодействия анионов с HBR < HI H, которое ослабевает по мере их увеличения в size. In в свою очередь, это послужило одним из наиболее очевидных и убедительных доказательств применимости модели без жестких тел. Этот исторический самозванец полезен в том смысле, что кажущееся простым объяснение естественных законов не гарантирует правильности применяемой интерпретации. 64) при передаче по цепи поляризационное взаимодействие быстро ослабевает.
Хорошим примером может служить сравнение 2-й константы диссоциации серной кислоты и мононуклеиновой кислоты: / C, −5 «10 -» 0 Таким образом, замена H очень сильной поляризацией S * e (/Ci = «2-I0», e) в HOH очень драматична, но относительно мала в UNO(K \ = 2 «10〜»). 65) непосредственной причиной снижения кислотности гидроксида с увеличением гидратации центрального атома гидроксида является ослабление поляризационного эффекта на каждую из присоединенных молекул воды за счет увеличения их числа. Это очевидно, например, в производных рения. HReO, с другой стороны, сильно диссоциирован.
HjReOj является более слабой кислотой, чем угольная кислота. 66) в разбавленном растворе соли и катион, и Анон гидратируются большим количеством молекул воды. Это, согласно предыдущим молекулам, приводит к ослаблению каждого варианта. Таким образом, индивидуальные различия в поляризационном действии нонов более или менее сглаживаются. Например, разбавить раствор N Lil. Поляризационный эффект Li * сильнее, чем I -, в то время как поляризационный эффект Cs слабее, чем F -, но CsF показывает нейтральную реакцию на лакмус.
По мере увеличения концентрации раствора количество молекул воды, гидратирующих Неон, уменьшается, и деформация каждой НС intensifies. In в этом случае индивидуальные особенности нонесов начинают проявляться более четко. Хорошо концентрированный раствор Lil показывает четкую кислотную реакцию, а раствор CsF показывает щелочную реакцию.
Среди других галогенидов щелочных металлов кислотные реакции в концентрированных растворах также обозначены LiBr, LiCl NAL, а щелочные реакции-RbF n KF. So, рН 25% раствора кф составляет 8,6. 67) для константы кислотной диссоциации гидратированного лития по схеме[Li (OHj)» J’FLI (OHa) sOH] + H, значение приведено 7-10 -*.Очевидно, что случай с натрием будет меньше, а случай с пробуксовкой-еще меньше. Именно уменьшение концентрации ионов водорода в ряду Li *(0.78 А)-Na (0.98 А) — K (1.33 а) отвечает за повышение стабильности тех же рядов водных растворов ЭВН-боратов»(XI§ I). )
68) в случае амфотерных гидроксидов Эон примерно одинаков, оба из которых схематически показаны под реакцией, поскольку возможна диссоциация основной кислоты. Е0 + Н, 0 — ► ЭО-ю —►(Эон)* + о «Х, 0 + Е0 —► ч, 0-Е0 — ► Н * +(NOEE Вероятность их хода должна быть близка к ним. Однако 1 из них основан на поляризации молекул воды O2-конусами, а 2-й-на поляризации ионами E2*.Поэтому, если поляризационный эффект лошади близок к O1-N, то, по-видимому, ожидается, что амфотеризм произойдет. В этом отношении это O2 ′ (8 шт. e. наиболее похож на 1.32 A) non-Sr2 *(8 электронов, 1.27 A).Однако СРО дает гидродокс, который является типичным основанием.
Результат. не О2 поляризует молекулы воды гораздо сильнее, чем Ср*.С другой стороны, в этом случае такие сильные поляризационные ионы приблизительно равны ε из-за результата поляризации. Например, Zn2 *(18 электронов, 0,83 а).Амфотерная природа гидроксида указывает на то, что он наблюдается только тогда, когда nonel1 в окне находится в состоянии поляризации, гораздо более сильной, чем non-O2 -.
Это кажущееся протворечное снимается с учетом положения диполя в молекуле воды (рисунок V-40).Благодаря равному поляризационному действию Анона и катионов (например, O2-Sr2) суммарная поляризация молекул воды во 2-м случае значительно больше, чем в первом, так как они смещены относительно центра вблизи края положительной end. To чтобы уравнять оба эффекта, нужен катион с гораздо более сильной поляризацией, чем конкретный Анкон.
Например, в ZnJ*. 69) взаимодействие водонерастворимых оксидов с кислотами и щелочами соответственно можно выразить следующим образом: ОР + ч *-(Эон)*и[Эон) * + Ч * —► [Е•0Hf) J в + ое + о — ►(OEON] „и(OEON)“ + о » — ►(ОЭО) 5- + на «из схемы ТНХ видно, что характер процесса разный. Первый из них состоит в непрерывном включении Н в не-о, в результате чего молекулы оксида превращаются в гидратированные не-е, за счет чего он растворяется. Но такое введение должно быть еще сложнее. conO2-сильно поляризован в оксиде (см. Рисунок XIII-56, Б).
Поэтому, как эффект поляризации катионов, возрастает, предполагается, что производные от их основных оксидов будет все труднее раствориться в кислоте. На самом деле, оксидов, таких как А1 0, СГ * 0 * SnOj почти нерастворим в кислотах. Напротив, растворение в щелочи вызвано расщеплением OH*, связанного с nonE2 *и последующим H.
Чем сильнее поляризационный эффект E2 и чем выше концентрация OH, тем яснее должно быть это растворение. Особенно благоприятные условия создаются для щелочных расплавов, которые обычно не используются для переноса оксидов, таких как SnOi, SiO2 и др. до растворимого состояния. 70) разрыв подобия некоторых свойств между Vv, CrVI, Mnv»и Pv, SVI, Clv», возможно, непосредственно связан с неравной способностью обоих при соединении electrons.
As это видно из рисунка XIII-78, V1, Cr*, Mpt *. Уровень 4s (Ps.Существуют более глубокие 3d уровни (аналогичные уровню 3S Se \ C1t). фактически, этот глубокий уровень доступен электронам, но не отрицательным ионам(см. добавление 39). Так, для свойств, обусловленных взаимодействием ионов (например, кислотность гидроксида), в рассматриваемом переходе наблюдается разрыв последовательности. Напротив, характеристики, с которыми он наблюдается, прямо или косвенно связаны с присоединением электронов к Ep*.
71) схематически показано на РНС. XIII-63, переход к нерегулярности ионной структуры соответствует наиболее обычному («нормальному») изменению природы химических связей, когда взаимная деформация частиц, образующих соединение, возрастает. Однако это еще не все, что возможно. Поэтому, если вы уже рассмотрели тепло».Галоидная соль dnssotsatsnn * Я о5 * сл * им ^ Т,. __ Если один ион не деформируется другим, это может привести к полному одностороннему вытягиванию электрона и коллапсу связанных с этим соединений.
С другой стороны, в результате наличия сильно выраженной деформации орбиты отдельных электронов, по-видимому, принадлежат примерно одинаково обоим ядрам, но они очень вероятно (и действительно наблюдаются) очень слабо связаны. Поэтому, когда напряжение здесь усиливается, ионная связь переходит в металлическую bond. An примером может служить серия CuSO * — CuO-CuS-CuSe-CuTe. CuSO-типичное несоединение, CuTe-типичный металл, а остальные члены ряда образуют переходы между нормальными состояниями.
72) ИОННОСТЬ CI6’m ’ p6 *еще один хороший пример перехода к связыванию металлов приведен некоторыми solids. In в частности, он имеет кристаллическую структуру, характерную для комбинации Ni и Az. Как? Как видно на рисунке XIII-79, эта структура, аналогичная типу NaCI, характеризуется координационным числом 6, но расстояние от этой частицы до частиц другого окружающего элемента не полностью идентично(4 из них немного ближе, чем другие 2). Формирование кристаллической структуры типа Nias связано с заметным уменьшением расстояния внутри решетки по сравнению с суммой эффективных радиусов non.
Например. Для FeS, 0.83 + 1.74 вместо 2.57 A, есть d 2.45 A. Необходимым условием появления структуры типа NIAs является одновременное присутствие в бинарном соединении относительно большого N легко деформируемого Анона, наряду с катионом, который характеризуется несовершенством внешнего электронного слоя.
Однако при поляризационном эффекте катиона важную роль играет(он увеличивается с уменьшением) Радиус), например, как видно из структурных переходов, показанных ниже: Ион СД-СЭ * — те’- Mn ’*(0.91 A) NaCl NaCl NaCl NlAa Фут * * т0.83 а) нацмен / НИА НИА NIAa Аналогично Fe2 * ведет себя как Co2 *(0.82 A) и Ni2 *(0.78 A), но соединения, близкие к соответствующим катионам радиуса, являются законченными внешними оболочками (такими как Mg2 *-0.78 A и 2p2 *-0.83 a), кристаллизуются в решетке типа NaCl или ZnS. ВОПРОС ПИ Двадцать Ага. 60 80 / 00- / 20- Мы Дж 3С 3Д Как 4 секунды 35 3д с * ’ cr5 не * 3 секунды 3 ф / Рисунок XIII-79.Кристаллической структуры Н:».
Переход от структуры NaCI к структуре NiAs сопровождается резким изменением свойств Кристалла. Вместо прозрачных или полупрозрачных веществ, практически не проводящих электрический ток, получается непрозрачное вещество, внешне напоминающее металл и характеризующееся относительно хорошей электропроводностью.
Самое интересное, например, в Кристалле. FeS может заменить некоторые атомы железа на такое же количество атомов серы, не изменяя структуру кристалла и его стабильность. Природа структурных элементов решетки типа NNAS точно установлена, но сами эти решетки представляют собой типичные примеры переходов ионных связей в металлические (или одновременных связей обоих типов).
Смотрите также:
| Щелочные металлы | Семейство железа |
| Подгруппа меди | Платиновые металлы |

