Оглавление:















Бериллий и магний
- Бериллий и магний. Первый из этих элементов очень распространен. Бериллий составляет около 0,001%от общего числа атомов в земной коре. Содержание магния в последнем составляет 1,4%, поэтому этот элемент является одним из самых распространенных. Соединения магния, в дополнение к различным минералам и породам, также всегда находятся в морской воде и растительных и животных организмах 1 ″ 3 Помимо многих силикатов, магний присутствует на поверхности Земли в основном в виде карбонатных минералов доломита (CaC03-MgC03) и магнезита (MgC03).
- Первый чужеродный вид образует весь горный хребет, а второй чужеродный вид также встречается в очень больших скоплениях. Легкорастворимые минералы Mg можно найти вместе с залежами каменной соли под различными слоями аллювиальной породы. Наиболее важным является карнарит (KC1 * MgCl2 * 6HsO), который служит обычным сырьем для производства металлического магния в it. Бериллиевые минералы являются самыми редкими в природе и самый важный минерал берилл[Be3Al2 (SiOj) E или ЗВеО * А120з * 6si02]. В элементарном состоянии Be и Mg получают электролизом расплавленных солей.
In в Соликамске находится огромное количество карналита, этот минерал встречается в пластах толщиной до 100 м. Людмила Фирмаль
Когда они получают бериллий, они обычно используют смесь Becl2 и NaCl, а когда они получают магний, они используют обезвоженный каеналит или хлорид магния. Бериллий и магний-замечательные металлы, покрытые тонкой оксидной пленкой на воздухе, которая придает им матовый вид и защищает от дальнейшего окисления. Наиболее важные константы для обоих элементов сравниваются ниже. Плотность. Температура * / s * 3 плейеик. ° C кипячение. «С (НД)» — л)
Такой вещи не существует… 1.85 1283 2470 23 Мг. 。 。 。 1.74 650 1103 22 Светло-серый бериллий очень твердый и хрупкий, а серебристо-белый магний гораздо мягче и пластичнее. Оба элемента (особенно Mg) имеют важное практическое применение. При нагревании на воздухе Be и Mg сгорают вместе с образованием оксида ЭО. Оба элемента объединяются с галогенами, а также нагреваются с помощью серы и азота.
Реакция сопровождается выделением большого количества тепла, и магний обычно реагирует более энергично, чем бериллий. Только магний связывается непосредственно с водородом (при нагревании под давлением).Б-16 Вода не действует на бериллий. Магний почти не взаимодействует с холодной водой, но медленно выделяет из нее водород при кипячении.
Разбавленные кислоты легко растворяют не только магний, но и beryllium. In их соединения, оба элемента являются двухвалентными. Оксид бериллия и магния — это очень тугоплавкий белый порошок. С кислотами, они легко растворяются. Оксид бериллия также растворим в сильных щелочах. EO-оксид соединяется с водой и образует гидроксид E (OH) 2.20-24
Белый аморфный гидроксид бериллия и магния очень слабо растворим в воде. Растворяющая часть Mg (OH) 2 диссоциирует в зависимости от типа основания, а Be (OH) 2 обладает свойством обоих полов и диссоциирует по общей схеме. Быть-Ф 20ч ’^ Бе(0н)2 = 3H2Be02 ^ 2Н’ + ВЕО? / Из-за слабокислых свойств Be (OH) 2 соли (бернаты) с анионами BeOH в водных растворах сильно гидролизуются. Основное свойство Be(OH) 2 гораздо более выражено, чем кислотное, но оно намного ниже, чем у Mg (OH) 2, и является основой средней прочности.
В зависимости от своих химических свойств Be (OH) 2 растворим только в сильных щелочах и кислотах, а гидроксид магния-в кислотах. Большинство солей бериллия и магния очень хорошо растворимы в воде. «Присутсвие ионов Mg дает горькую жидкость, и Ион Be» имеет a sweetness. Be соли заметно гидролизуются водой даже при комнатной температуре, а соли Mg и Сильная кислота-только при нагревании раствора.
Все соединения бериллия являются высокотоксичными. Химические свойства обоих рассматриваемых элементов в целом аналогичны друг другу. Основное различие между ними связано со значительным увеличением ионного радиуса при переходе от Be2 *(0,34 а) к Mg * +(0,78 а). Добавь I) элементарный бериллий впервые был получен в 1828 году, а магний-в 1808 году. Первый элемент-это чистый » элемент (Be)».
Второй состоит из 3 изотопов: MMg (78,6), Mg (10,1) и Mg (11,3%).Имеются обзорные статьии многочисленные монографии по бериллию Структура электронных оболочек вне атомов Be (2i>) и Mg (Za1) соответствует их нулевому состоянию. Возбуждение до нормального бивалента (2s2p n 3sZp) требует затрат 63 n 62 ккал / г атомов соответственно. Энергия непрерывной ионизации атомов бериллия составляет 9,32 ЭВ и 18,21 эВ. А магний-7,64 и 15,03 звезды.
Сродство к электронам отрицательное, −0,2 (B©) и −0,3 эВ (мг). 3) тело содержит 100 процентов магния в 1-минутном количестве. Хлорофилл содержит до 2% мг. Общее содержание этого элемента в живых организмах оценивается примерно в 10 тонн, а в океанах его гораздо больше-около 6 * 10 граммов. Недостаток магния останавливает рост и развитие plant. It накапливается преимущественно в семенах.
Введение в почву соединений магния значительно повышает урожайность некоторых культурных растений (особенно сахарной свеклы) и прочность яичной скорлупы курицы. Для людей (особенно пожилых) соединения магния важны, главным образом, для предотвращения спазма сосудов. Его содержание относительно высоко в сухофруктах.
4) в большинстве из своих главных минералов, магний близко скреплен с кремнеземом. Например, перидотит [(Mg, FehSiO»]] и не менее распространенный форстерит (MgtSiO»). 5) обильные отложения берилла (mp 1650°С) встречаются очень редко(однако в 1 из них встречаются отдельные кристаллы массой до 16 г).Минералы хризоберилла[Be (АУ») з] и фенакита (betsio») даже не распространены.
Большая часть бериллия в земной коре распыляется на многие другие элементы, особенно минералы алюминия, в качестве примесей. Бериллий также содержится в глубоководных отложениях и угольной золе. в) прозрачный берилл, окрашенный различными примесями, известен как драгоценный камень.
К ним относятся темные хромовые (от примесей соединений хрома) изумруды, голубой аквамарин и др. Изумруды хорошего качества очень редки и считались самыми дорогими из всех драгоценных камней. Подобно рубинам, его можно получить искусственно, но гораздо сложнее(для этого требуется 15°C под давлением 1550 тысяч атмосфер).
Самый крупный природный изумруд — 1795 карат. Кристаллы аквамарина иногда могут достигать огромных размеров. Максимальный вес их составлял 100 кг. Шуберт, Дж.. Достижения в области химии. IMI M 4. МО •* С. В. .. Абрамова В. Ф.. Дружинин И. Г.. Винер Л. Р.. С ы р-р а ФТ В. Т. бериллий химический Фрунзе. Издатель Конг Академии Наук СССР. ССР. 1965 год. 201р. Сирина Г. Ф.. 3 аррембо Ю. И. .. Бертнана Л. Е. Бериллиоз. М.. Атом шз дата. I960. 120 секунд. Белый Д.. Б & р и Ж. бериллия. На Английском Языке. М. Б. Лейфман. М.- Публ., В I960, эиэ. Дарвин, Дж.. Бадерн. Бериллий. ПЭ | .На Английском Языке. М. Б. Лейфман. М.. Для знакомства. 1962.332 секунд Эверест Д. А. бериллий chemistry.
In английский. В. П. Масирея. М.. Химия, 1968.224 секунды.、 7) схема небольшого оборудования для производства металлического магния показана на рисунке. Расплавленная соль смешивается в емкости с железом, которое одновременно является катодом. Графитовый стержень, окруженный тонкопористой керамической трубкой, действует как анод, через который электролиз удаляет chlorine.
To во избежание окисления жидкого магния, собранного в верхней части сосуда, через него проходит медленный поток водорода. Современные промышленные электролитические емкости для производства металлического магния имеют более сложную структуру. Для получения 1 г металла требуется около 2 млн кВт мощности. 8) в дополнение к обычному электролитическому методу, электротермический метод получения магния очень интересен, и его значение увеличивается с каждым годом. первый из nnx основан на обратимости реакции MgO + C + 4-153 ккал CO + Mg.
Его равновесие сдвигается вправо при очень высоких температурах (выше 2000°C). На практике этот процесс осуществляется путем нагрева в электродуговой печи плотной смеси MgO (получаемой обжигом природного магнезита) и измельченного антрацита. Уходящий пар разбавляется, как только вы выходите из печи с большим количеством сильно охлажденного водорода. Именно поэтому температура в них быстро падает до 150-200°С, а равновесное состояние не успевает сдвинуться влево.
Металлический магний, осажденный в виде пыли(включая примеси MgO и C), повторно растворяется. Металл, полученный этим способом, характеризуется высокой чистотой (99,97%). В другом электротермическом способе получения магния углерод не используется в качестве восстановителя, но кремний используется для кремния (обычно используется ферросилиций с содержанием Si не менее 75%).
Сырьем служит прокаленный доломит, а его смесь нагревают с кремнием при пониженном давлении до ~ 1200 * С и более. Реакция в этих условиях протекает по формуле 2 (CaO-MgO)+ SI + 124 ккал CaiSiO * — f 2 мг. Его единственным летучим продуктом является магний-пар. 9) эквимолярная смесь BeClj и NaCl расплавляется при 224°С с целью получения металлического бериллия, помимо электролиза, реакцию проводят путем постепенного нагрева до 1300°С, широко используют по схеме: Befj-Mg-MgFs + be-44 kkk. 10) теплота плавления бериллия и магния составляет 2,8 и 2,1 соответственно, теплота испарения-74 и 31, теплота сублимации (25°С) — 78 и 35 ккал / г atoms.
In пара бериллия, это явно один атом. Пары магния также содержат молекулы Mgj(его энергия диссоциации составляет 7 ккал!).Степень сжатия бериллия очень мала, а магния гораздо больше (при давлении 10 миллионов атмосфер объем Be уменьшается до 0,96, а Mg уменьшается до исходного 0,85).Изменения в аллотропии обоих элементов неизвестны. 11) прямое использование металлического магния весьма ограничено(количество). он расходуется в качестве отрицательного электрода для электрохимической защиты от коррозии судов и трубопроводов, используется в металлургии(в качестве раскислителя), строительстве некоторых гальванических элементов и др.
12) из магниевых сплавов наиболее часто используются «магний»и » электрон«. 1, мг сплав 5-30% А1.Магний тверже и сильнее, чем чистый алюминий; обработка и полировка чистого алюминия легко. Технический термин «электронный» означает обычный сплав, в котором основным компонентом является магний. Обычно такие сплавы включают A1 (до 10,5%), Zn (до 4,5%) и Mn (до 1,7%). Cu, Be, TI и др. могут быть также введены, но из-за их превосходных механических свойств,»электрон» в плотности(около 1,8 г / см*) только немного выше, чем чистый мг.
Он покрыт «электронами» в воздухе, как в » магнии Рисунок XII-я■схема ячейки должны быть приобретены Защитная оконная пленка защищает их от дальнейшего окисления. Введение 0,05% мг в чугун резко повышает пластичность и сопротивление разрыву. Интересно, что Монокристалл был получен из сплава магния и небольшого количества indium. It может быть увеличена в длину в несколько раз без разрыва при относительно низкой температуре под действием внешних сил, приложенных вдоль определенного направления (вертикального на рисунке XII-39).
Ежегодный мировой объем выплавки магнита составляет около 15 миллионов тонн (без учета Советского Союза). 13) в настоящее время атомная энергетика является основным потребителем металлического бериллия. Поскольку бериллий меньше всех других металлов устойчив к воздействию воздуха (например, А1 в 17 раз), он задерживает рентгеновские лучи, поэтому является незаменимым материалом для изготовления этих частей рентгеновской трубки, а излучение выделяется наружу. Для этого пения используются пластины толщиной 1-2 мм. used.
An интересной особенностью металлического бериллия является очень высокая скорость распространения звука-12,6 км / ч ss. In в жидком состоянии бериллий смешивается со многими металлами (Al, Zn, Cu, Ag, Fc, N1 и др.), но не с магнием. Это естественно. Очевидно, что будут (1.13) большие различия в атомном радиусе n Mg (1.60 A).
14) добавление бериллия к меди значительно увеличивает ее твердость, прочность и химическую стойкость. Сплавы, содержащие 3%бериллия, обладают 4-кратной стойкостью к разрыву по отношению к чистой меди, в то время как последние сплавы, содержащие 2% Be, в 2 раза прочнее нержавеющих сталей и очень устойчивы к механическим и химическим воздействиям. Сплав с медью с содержанием бериллия 0.5-1.3%имеет превосходный золотистый цвет и отличается отличными акустическими свойствами при ударе.
Добавление 0,01-0,02% бериллия к меди улучшает проводимость меди. Аналогично, добавление небольшого количества бериллия (0,005%) к магниевому сплаву повышает стойкость к окислению. Очень хороший результат может быть достигнут аналогичной алитизацией путем обработки бериллием поверхности чугунных и стальных изделий (XI§ 2 add.13). Добавление 1% Be к пружинной стали значительно повышает прочность и долговечность изделий, изготовленных из it.
In в частности, пружины из такой стали не теряют упругости даже при Раскалении. 16) в компактном состоянии масса воспламенится примерно на 650 в воздухе. Бериллий-около 900°С. Кроме оксида ЭО, при сгорании обоих элементов в воздухе образуются нитриды 3jNj. Очень сильная люминесценция при горении магния основана на его использовании в производстве осветительных ракет и в фотографии («магниевая вспышка»). в обоих случаях магний обычно смешивается с веществом, которое легко выделяет кислород. В состав ракетного освещения могут входить, например. 45%мг, 48-Нанож, и 7-связующее органического вещества.
16) теплота, выделяемая некоторыми соединениями бериллия и магния, рассчитанная в кКал на грамм эквивалента металла, сравнивается со следующей: F CI Br I O S N 59 44 20 72 28 23 Знак. ………. 77 62 43 72 42 19 Быть соотношение / мг. 。 。 。 。 0.90 0.77 0.71 0.47 1.00 0.47 1.21 Из приведенных данных следует, что теплота образования аналогичных производных бериллия и магния определяется относительно небольшим количеством атомов металлоида(F, O. N), близких к большим(01. Br. I, S) сильно расходятся.
- Поскольку сам атом бериллия значительно меньше атома магния, это указывает на важную роль объемного соотношения в образовании рассматриваемого соединения. 17)нормальный потенциал быть и Мг равны −1.85 и −2.37 в(в кислой среде) или −2.62 и −2.69 в (в щелочной среде).Поэтому оба металла должны разлагать воду. Однако при нормальной температуре (и в случае Be при нагревании) такое разложение на самом деле не происходит. Это связано с низкой растворимостью оксидов обоих элементов, которые образуют защитный слой на поверхности metal.
By свойства и толщина оксидной пленки Бериллий подобен алюминию (XI§ 2 add.16).18) бериллий и магний легко растворяются в разбавленных кислотах (HCI, H2SO и др.) , которые не являются окислителями, но бериллий реагирует с HNO только при нагревании. С HF бериллий растворяется легко, но с магнием он практически нерастворим(за счет образования защитного слоя mgft, который плохо растворим на поверхности).
Оксидная пленка на поверхности магния более толстая и рыхлая, а ее защитный эффект значительно слабее. Людмила Фирмаль
19) раствор сильной щелочи практически не влияет на магний, но растворяет бериллий(он разбавляется при нагревании, но уже концентрируется при охлаждении) и образует соответствующие бернатные соли. Например, по схеме 2NaOH + + Be-NatBeOt +Н. Бериллий не вступает в реакцию с аммиачной водой. Магний также плохо реагирует, но постепенно растворяется в растворе аммониевой соли(по схеме 2NH ^ + Mg = Mg » + Ht + 2NH3).Бериллий из аммониевой соли растворяется только в сильном растворе фторида (по схеме: Bc-f4NH» F =(Ana) tbcfa+ + Ht + 2nhaj) или в растворе дифталида как видно из приведенной выше схемы, растворение обоих металлов различно. он образует анион).
Бериллий вступает в реакцию с натрием расплавленного металла. 20) расстояние ядра E-O кристаллов BCO (mp 2580) и MgO (2850 ° С) составляет 1.64 n 2.10 a. отдельные молекулы (пары) равны 1.33 и 1, 75A. пары обоих оксидов сильно диссоциированы на элементы. Для энергии диссоциации дается 106 (Be) или 94 (Mg) ккал / моль. В отличие от MgO, пары оксида бериллия содержат не только молекулы BCO и продукты их термической диссоциации, но и молекулы полимера (BCO)(n = 2-6). предполагается, что полимер со значением N> 2 имеет циклическую структуру.
Минимальная температура плавления (1838°C) обоих оксидных сплавов составляет 69 mol. It это а 21) оба окиси легко растворимы кислотой, а более твердые, ранее были прокалены. Такая сингенная реакционная способность обусловлена в данном случае только укрупнением кристаллов. При хранении на воздухе оксид магния постепенно поглощает влагу и CO и превращается в Mg (OH) и MgCQ*. 22) бериллий хорошо теплопроводен и устойчив к температурным колебаниям (не так много о MgO).Высокое электрическое сопротивление даже при высоких температурах.
Тигель, изготовленный из него, выдерживает нагрев до 2000°C и химически устойчив практически ко всем металлам, кислотам (кроме HF) и щелочным растворам. BeO широко используется в ядерной энергетике. Очевидно, что перспективным является применение оксида бериллия (или керамического материала на его основе) при изготовлении некоторых деталей реактивных двигателей и газовых турбин.
Существует специальная монография об окиси бериллия. 23) оксид магния редко встречается в природе (минералогия пероксилазы).MgO, полученный обжигом природного магнезита MgO, является исходным продуктом производства различных огнеупорных и искусственных строительных материалов (таких как»ксилолит«).Чистый оксид магния («жженая магнезия») используется в медицине как средство от изжоги и слабительных.
Смесь оксида магния и рафинированного бензина может быть использована для удаления жирных и масляных пятен с поверхности автомобиля. paper. It смазывает в Пентагоне, испаряет бензин, а затем удаляет жир, адсорбированный на оксиде магния. 24) ксилит основан на магнезиальном цементе, полученном смешиванием предварительно прокаленного магниевого стекла при 800°с с 30%-ным водным раствором MgClj(2 части MgO лучше всего принимать внутрь с безводным MgCl9 из 1 части массы).
Полимерная структура образуется из атомов магния, связанных друг с другом через индолоксильные группы или атомы хлора, поэтому через несколько часов смесь будет белой, очень прочной, с массой, которую легко полировать. * Беляев Р. А. оксид бериллия. М госатомиздат. 1962.230 секунд При производстве ксилолиса, опилок и др. смешиваются в первую смесь и в дополнение к ксилолиту, который в основном используется для настила полов, жерновов, шлифовальных кругов и др. часто их готовят на основе магнезиального цемента.
25) осаждение Bc (OH) t при нейтрализации кислых растворов происходит около рН 5,7, а Mg (OH) — при рН = 10,5. Наиболее достоверные значения продукта растворимости этих гидроксидов во вновь осажденном (аморфном) или кристаллизованном состоянии при 25°с явно равны. 2-U «11 или 3•| 0〜**(Be) и b•10 — * 0 или I * 10«и (Мг).2-я константа диссоциации основного типа характеризуется значениями 3 10 e (BeON) и 3-10 ′ 5(MgOH). 26) гидроксид магния существует в природе (синие минералы сайта). кроме кислот, он растворим в растворах солей аммония (что важно для аналитической химии).
Например, растворение в NH C1 C1 обусловлено образованием гидроксида Mg (OH),+ 2NH C1 A *с последующим соответствующим MgCl * + 2NH OH OH и относительно слабо диссоциированным (особенно в присутствии избытка NH C1 C1 C1).Многие другие гидроксиды металлов работают аналогично Mg (OH)*, который слабо, но заметно растворим в воде[например. Mn (OH) 2].напротив, гидроксиды, которые практически нерастворимы в воде, такие как be (OH)}.Нерастворим в растворе соли аммония.
Однако гидроксид бериллия растворяют в растворе этиленового ламината. 27) в технологии бериллия, в отличие от A1 (OH) 3, важен его гидроксид. Он хорошо растворяется в растворе jCOi (или насыщенном растворе NaHCO). иногда он используется для отделения Be от AI при обработке берилла. Последний сначала сплавляют с K «CO», а полученный сплав для осаждения кремниевой кислоты обрабатывают hiso » разбавленным при нагревании. Большая часть алюминия отделяется в виде калиевых квасцов, остальная его часть (и смесь Fe) осаждается раствором (NH4) fCO3.
Из подкисленного фильтрата HCl удаляют со кипячением, затем осаждают be (OH) аммиаком. Окончательная очистка использует переработку Be (OH) / перекристаллизацию и сублимацию карбоната аммония или основного ацетата бериллия: 2 $) при нагревании гидроксида бериллия на воздухе он начинает терять йод, который уже превышает 230°С (однако полное обезвоживание достигается только при 500°с).Однако при очень высоких температурах молекула be (OH) стабильна.
Именно поэтому свечение BeO с потоком водяного пара выше 1000°с сопровождается выраженным образованием Be (OH) 2 и его последующим разложением, которое существенно сводится к возгонке оксида бериллия. В случае MgO такая летучесть из — за водяного пара наблюдается. 29) общая константа диссоциации HtBeO *(по 2H * + BeOj) оценивается в 2-10-м. вновь осажденный Be(OH) растворяется в избытке разбавленного щелочного раствора, но когда такой раствор остается стоять, его кристаллическая форма снова высвобождается и очень сильна (10 и.)
Растворяют только в щелочном растворе. Отделение берилатов возможно только от спиртового раствора. Бесцветные KrBeO и NajBeOi были приобретены в аналогичном way. In в водной среде, благодаря отсутствию избытка щелочи, обе соли практически полностью гидролизуются. Скорости горения некоторых двухвалентных металлов также были получены сухим методом.
30) функция магния совсем не характерна для гидроксида магния. Однако при взаимодействии Mg (OH)со 100% раствором NaOH при 65°С образуется бесцветный кристаллический гидроксид натрия карбонат магния-Na «[Mg (OH)»]. СР, Ба. Все эти соединения полностью гидролизуются при контакте с водой. 31) для обоих элементов известно производное этоксида E (OS * H»L, аналогичное гидроксиду. Этосенсидиум магния получают взаимодействием спирта с его амальгамой.
Этоксильный комплекс Cz [Vs (OS * Nz)]. 32) взаимодействие Mg (OH) 2 и 30% (Н20) свежеосажденного при 0°С магния с образованием Mg02 peroxides. It описывается как бесцветное микрокристаллическое вещество[d (00)= 1,50, d (MgO) -= 2,08 а), слабо растворимое в воде Он портится при хранении в воздухе. Эти данные. Очевидно, что это не считается reliable. It возможно, что гидрат перекиси действительно был получен (известны 2MgO2-H2O и MgO1-H1O).Их последний нагрев осуществляется при 100°С путем их обезвоживания, а при 375°с путем перехода от MrOj к MgO.
Теплота образования MgOj из элемента оценивается в 149 ккал / моль. Препараты, содержащие его, используются для отбеливания тканей, дезинфекции и медикаментозного лечения (некоторых желудочно-кишечных заболеваний), а также могут быть смешаны в составе зубной пасты. Пероксидные производные бериллия не были получены, но образование BeOg сообщалось в результате взаимодействия озона с суспензией be (OH) 65°C фреона −12 be (OH) 2.
При аналогичных условиях из MgO / частично образуется (до 60%) L-пероксид магния Mg-Mg (0*) t, только стабильный ниже −30 ° С. 33) вероятность отравления соединениями бериллия в основном связана с их присутствием в воздухе (в производственных помещениях оно должно превышать 0,001 мг / М5).При вдыхании нерастворимых соединений основная масса этого элемента откладывается в легких, а при вдыхании (или через рот) он растворяется в костях. Первыми симптомами острого отравления обычно являются раздражение верхних дыхательных путей и глаз.
Хроническое отравление может проявляться только через очень длительное время: общая слабость, несварение желудка, одышка, кашель, серьезные изменения в легких. Соединения бериллия также могут вызывать повреждения костей и кожи. 34) be и Mg галогенид бесцветны. Сравните некоторые из этих констант ниже. BcFj BcClj SunVg * BeJ2 MeFt MgCI, MdVg, M * Ij Температура плавления. °С. 。 。 Chwe 821425509 1263714710550 Температура кипения. День. 。 。 。 1 (69 510 520 488 2260 1418 14″ L (например)、1.40 1.75 1.01 2.10 1.77 2.18 2.84 2.5 т.
Приведенные значения ядерного расстояния связаны с отдельными молекулами парных проблемных соединений. Эти молекулы линейны. Тенденция их ассоциации слабо выражена > пары befj показали, что существует незначительная релевантность_ g_________— J — — — — — — p Вай. Бецит и галогенид магния✓I \ .. г включен Только около 1%молекулы (EG2b и снова меньше, чем> 100 (EG7) 3. 3.Сплошной Бэк! для t комбинация отдельных молекул, показанных в полимере, показанном на рисунке XI1-2, показана на рисунке XI1-2. * * — BeCljBcCb — * * с мостом Связывание атомов бериллия и хлора (d (BcCl)= 2.02 A, ZCIBeCl= 98 \ Bebe ^br®.
Отметим, что твердый бериллий может существовать в различных модификациях, и в зависимости от характеристик может быть очень разным. Известная форма BeFj имеет температуру плавления 542°C. галогенид расплавленного бериллия очень беден по электропроводности. Следующее значение (ккал / моль) — МГТ? 553(1). 35) почти все Галоидные соли Be и Mg растворимы в воздухе и легко растворимы в воде.
Исключение составляет MgF*, который имеет очень низкую растворимость (0,08 г / л).в растворе практически не диссоциируют только ионы BcF *(K = 5-10″*) и MgF *(X = 5-10’*).Подвижность Иона Be составляет почти половину Иона Mg. Кристаллический гидрат: BeCli-4HjO, MgC! «- 6HaO и так далее. При нагревании часть соляной кислоты отсекается, а основная соль перестает растворяться в воде. 38) реакция присоединения характерна в основном для фторидов, образующих комплексы типа M [EGv]и Mt (3r).Здесь M-металл с 1-валентностью.
Примеры к BcFj и KJMgFj](1070), KJBeFJ(791), и KjJMgF *](разл. Это 846 ° С).Производные типа Mj[BcF <J. In растворимость, она подобна сульфату. Ядерное расстояние Rf (BEF) [BeF«] ионов, _ составляет 1,55 а, константа силы связи K = 3,5, общая константа диссоциации в растворе (Be «4-4F») оценивается как 4•I0 ″ 17.Многие соли также известны из комплексной кислоты H2 (BeFjOH).Есть обзорные статьи * о BeFi и fluoroorberate.
37) для других галогенидов бериллия комплексообразование с соответствующими галогенидами щелочных металлов не характерно, но известны некоторые производные [BeC1<] * — анионов (</(ВеС1) = » 1,89 с тетраэдрической структурой).Дихлорид магнида производит производные типа M (MgCla• * 6H20, особенно содержащие соли аммония, подобные природным carnalite. By нагревая последний, можно получить безводный MgClj (без образования основных солей).
Используя очень большое количество катиона тетраэтиламмония, [N (CjHshHMgCM безводный BeC12 легко растворяется в спирте на эфире (кроме того, соль отделяется от последнего раствора, содержащего кристаллизационный эфир из 2 молекул).Водный комплекс (Be (hl) 2) C12.MgBr2 и Mgl2 также легко растворяются в эфире (и многих других кислородсодержащих органических жидкостях).При взаимодействии с эфиром соли последнего образуют 2 слоя и смешиваются друг с другом(ст. § 2 доп.
21).D его идлизис при взаимодействии с водой протекает очень интенсивно, и удобно получать Бел *за счет действия сушки HI против карбида бериллия при 700°С (затем очистка вакуумной сублимацией).Стекловидное Be(NCS) t и кристаллическое Csj [Be (NCS) C)2H20 были получены из тиоцианата бериллия. 38) в практическом применении ГАЛОИДА BE и Mg, главным образом MgClj найдено. КС получают в больших количествах в виде отходов от переработки плотского света.
При 17°С каенит растворяется в кристаллической воде и растворяется одновременно. KC1 осаждается почти полностью, MgCl2-6H20 (mp 106c) остается в виде жидкости. Хлорид магния используется для получения из него мг металла. Цемент магнезии, медицина и так далее. Mgl2 также для медицинского использования. Кристаллическая спиртовая настойка MgIj-bСНзОН может быть отделена от спиртового раствора этой соли метилового. 39) гидрид бериллия и магния представляет собой белое твердое вещество.
Нелетучая и текущая природа полимера (вероятно, образованного водородным сшиванием).Оба нерастворимы в эфире, и схема е (CH3b-f LiA! H » = Лия! Вы можете получить его в соответствии с H2 (CH3h +ЭН2).Под давлением водорода 100-200atm, при температуре порядка 400-500°в присутствии следовых количеств йода, MgH2 получают непосредственно из элементов (теплота производства составляет 18 ккал / моль).
Оба гидрида стабильны в сухом воздухе, но они разлагаются в воде(BeH2 коричневый, MgHj медленно).Пиролиз BHH2 (5 ккал / моль тепла выхода) MgH2-около 300 SS. Как и другие гидриды металлов, oi является сильным восстановителем. (CH3) ганический Амин, на примере 3NBeH2 (M. точка плавления 128℃).он также подготовил Na2BeH, » сообщил KMgHj. Растворимость водорода в расплавленном металлическом магнии составляет около 100 г 1 см на 50 кубических граммов. 40) для магния, в виде эфиров, гидрогалидов HMgr — (CjHs)^(где Γ-C1, Br. I) также известно. Это белые твердые частицы, которые распадаются при контакте с далеким эфиром или водой.
41) эти азидные элементы-Bc (Nj) 2 и Mg (N3)} были получены взаимодействием при очень низких температурах с производными Be и mg d-метила и эфирным раствором HNj. Они белые твердые. Цианид бериллия известен как эфират 2Be (CN) 2•(C2H5) 20. Также описаны дополнительные продукты BeCI2-4HCN. Цианид магния можно получить с осторожностью Новоселова А. В., успехи химии, IW9, St 1, 33. Его аммиак (Mg (NH3) 2 (CN) 2) нагревают в вакууме.
Осаждается за счет действия HCN и NHj на концентрированные растворы Mg (N03). Mg (CN) j гидролизуется водой, а при нагревании выше 200°C переходит в цианамид. Магний-MgNCN. 42) в случае бериллия известно соединение состава Be(N [Si (CHj) 3b. аналогично соответствующему производному алюминия (XI 2 postscript 71).Группа N-Be-N в молекуле линейна (d (BeN)= 1.57, d (NSi)= 1.73 A). 43) нитраты бериллия и магния легко растворяются не только в воде, но и в спирте.
Нормально, быть(N03) 2•4H20(mp. Go) и MG (N03) кристаллизуются в виде 2•6HjO (90°C).При нагревании выше температуры плавления оба нитрата отсекают не только воду, но и n-HN03, переходя на соответствующий оксид. Безводный быть (с бортовым номером 03) J и МГ(с бортовым номером 03) и J получаются путем тщательного нагрева 2-х компонентный компаунд быть (с бортовым номером 03) Дж.2NaO мг мг мг (с бортовым номером 03) Дж•N204 (образуется при взаимодействии оксида азота с хлорид безводный) ethnlac-Тата).Это бесцветные твердые тела.
44) сульфат бериллия и сульфат магния характеризуются слаборастворимыми кристаллическими гидратами BeSO-4HjO и MgS04-7Il20.Первая из них полностью обезвоживается при 400°С, вторая-при 200 ° С. В случае солей бериллия установлена структура с тетраэдрической средой атомов B (и (BeO)= 3,0 константы силовой связи) по 4 молекулам воды (Be (0H2) 4] S04.Аналогичная структура [Be (OBe) 4lSO «интересно, что растворимость этого основного Золя больше, чем растворимость самого сульфата бериллия.
Последний раствор может также растворять металлический магний и его оксиды(по схеме: 2BeS04 — F Mg +2Н20=Н2 * * -f(Be0H) 2s04-fmgso α и 2BeS04-f MgO + H20 =(Be0H) s} MgS04). Диссоциация MgS04 характеризуется постоянным значением 5-10-3.Bes04 безводный (Мп.540 куб. см) слабо растворим в холодной воде (но превращается в растворимое, легко плавящееся состояние).Это может быть связано со структурой ионного и полимерного типов. * * Be02s0jbe02s0r » аналогична хлоридной структуре (рисунок CP-2).
Примерно при 580°C SOj начинает трескаться и происходит пиролиз mgs04 (точка плавления при быстром нагреве.30°C) будет заметен, если он превысит 1000°C. 45) в природе MgS04 можно найти в виде горькой соли (MgS04•7H20) и минерала кейерита (MgS04•H20).Последние минералы растворяются очень медленно, даже при нагревании(видимо, только после перехода в богатые водой кристаллогидраты).Природный кизерит разлагается при нагревании с углем по схеме MgS04 +С-f 64 ккал » =СО-F S02 + MgO, поэтому он служит подходящим материалом для производства MgO и sojf. Соль горького вкуса используется в текстильной и бумажной промышленности, а также используется в медицине в качестве слабительного средства.
46) в некоторых сульфатах одновалентных металлов BeS04 и MgS04 образуют двойную соль и бериллий (Be (S04) 2l 2U•типа M.А для магния, так называемого M2 (Mg (SO») 2) шейка и шейка• * 6н20 м Шейита K2(Mg (S04), который является одновалентным катодом.6H20 иногда используется в качестве неорганического удобрения для калия. 47) бериллий и магний обыкновенный водонерастворимый обыкновенный карбонат (ES03) получают только при наличии большого избытка СО в растворе одновременно.
Если нет, то почти нерастворимые основные соли также выпадут в осадок[например. (E0H) 2C03].Последний всегда образуется при воздействии солей Be или Mg с раствором щелочи carbonate. By нагревание с сильным раствором KHC03, он может быть преобразован в нормальный карбонат. Этот карбонат характеризуется Кристаллогидратом BeC03-4H20 и MgC03 * ZN20.Основная соль приблизительного состава 3mgc03 * Mg (OH) белой магнезии, названная j-ЗН20, имеет медицинское применение (повышенная кислотность желудочного сока) и также может быть введена в состав зубных паст.
48) обычные карбонаты Be и Mg, относительно легко отделяемые углекислым газом и мигрирующие в соответствующий оксид. Для BeC03 такое затухание является В случае MgCO это заметно уже чуть выше 100-около 500°С при использовании природного магнезита для производства кроваток и MgO на его основе. Выделяющийся таким образом углекислый газ очень чист и особенно полезен для производства искусственной минеральной воды. Кальцинированный Магнезит (т. е. в основном MgO) используется в производстве огнеупорного кирпича и тому подобного.
49) когда»со» пропускают через жидкость, содержащую взвешенные MgCO*, MgCO,+ HjO +СО? Схема, по которой происходит реакция растворения осадка. Mg (HCO) » в кристаллическом состоянии вы получили гидрокарбонат магния при 0°C под давлением CO? В 18 он очень нестабилен и отделяет COj в воздухе. 50) карбонат, растворенный в избытке карбоната щелочного металла, особенно легкий сильный раствор (NH«) * COj.
Растворение обусловлено образованием двойных солей типа Mj (Be (COt) s).Подобные малорастворимые соли получают карбонатом магния при обработке сильным раствором щелочного карбоната (или бикарбоната). (Мг (СО.) Т) * * 4Н?0 и другие. Природный доломит Ca (Mg (C03) a) также относится к этому типу солей. Образование аналогичного, но легко растворимого производного аммония, возможно, содержащего сильный раствор (NH) соли магния) tCOs напротив, растворение этого реагента не существует другие соли аммония вызывают частичный осадок первичного карбоната магния (в основном при нагревании или только после того, как он остается в течение длительного времени).
51) безводный перхлорат магния («Андрон») очень практичен для сушки многих жидкостей и газов. Их получают дегидратацией кристаллогидрата Mg (CI04), 6Н«0 (mp 146°С) (вакуум при 240°C) и выделяют из водного раствора этой соли. Сила дренажного действия разгрузки приближается к фосфорному ангидриду (IX§ 5 постскриптум 34), который имеет важное преимущество перед latter. By нагревание до 240°C под вакуумом в течение длительного времени, поглощенная водой соль может быть снова обезвожена и повторно использована с использованием jh8. Пиролиз Mg (Cl04) 3 происходит при 382°C.
Эта соль хорошо растворяется не только в воде, но и во многих органических растворителях. 52) известный как перхлорат бериллия-Be (CI04) i * 4НаО. Как и другие четыре гидрата Non-Be*, эта соль, вероятно, имеет структуру (Be (0H})]] (CI04).j. при нагревании он не теряет воду до тех пор, пока не начнется разложение Анона. 53) обычный ацетат бериллия-Be (CH, COO) a-не получен из водного раствора solutions.
In в частности, Бекл образуется при нагревании с уксусным ангидридом. Эта соль не растворяется в органических растворителях или в воде (но медленно разлагается с образованием основных солей). При температуре 295°C он растворяется и плавится. 54) ацетат магния, легко растворимый в воде, характеризуется Кристаллогидратом Mg (CHjCOO) 2-4HjO (mp 65°C).Раствор этой соли протекает в несколько раз сильнее тока, чем обычно для солей типа EC *, и при высоких концентрациях становится очень вязким. Оба они, по-видимому, вызваны полимеризацией молекулы Mg (CH $ COO) t, которая протекает с появлением 0-«mg донорно-акцепторной связи из карбонильного кислородного аниона.
55) оксалат бериллия-BeC » 04•3HjO-единственный оксалат двухвалентного металла, который очень хорошо растворим в воде. Электрическая проводимость разбавленного раствора приблизительно в 5 раз больше, чем у BeS04. n практически не изменяется при увеличении концентрации. Поведение этой соли согласуется с интерпретацией структуры Be {Be (Cj04) a]•6HjO type. At в то же время константа диссоциации молекулы BeCj04 была найдена со значением 6 * 10’*.Сложные оксалаты также известны, например N’a (Be (C, 04).] * HjO.
56) В отличие от бериллия, оксалат магния-MgCj04•2NeO-слабо растворяется в воде (0,1 г / л).Для константы электролитической диссоциации этой соли значение 4 * 10 * равно given. In раствор (NH4) C * 04, он растворяется с образованием достаточно стабильного комплекса (NH4) i(Mg (Ct04) 2). в то же время раствор щавелевой кислоты может растворять больше MgO, эквивалентного реакции нейтрализации. Это указывает на то, что легко образуется растворимый основной оксалат магния.
57) для фосфата магния-Mg (PO»h (точка плавления 1357°C)-приведено значение PR ^ 2-10«.То есть эта соль очень слабо растворяется в воде. Образование кристаллических осадков MgNH4304 (E * P или As) используется в аналитической химии для обнаружения ионов Mg, а также для обнаружения фосфорной кислоты и мышьяковой кислоты. Например, MgCl,+ NH4OH-f Na2HPO «- MgNH » P04 | + + 2NaC!+ Ч * 0.Фосфат бериллия известен, но он мало изучен. 58) бораты бериллия и магния могут быть получены в эфирной среде по следующей схеме: EN2 +В3Не » -э (ВН.) и оба являются белыми твердыми веществами, растворимыми в эфире и разлагаемыми водой.
Бериллий борная кислота Летучая (то есть овощи выше 91, 120°С).Магний Болан, с другой стороны, нелетуч (он плавится в вакууме около 180°C и разлагается только при 260 ° C и выше). Молекула be (BH4) полярна(q » 2.06).Данные из 3 различных исследований по структуре сильно расходятся, но Mg (BH4) j, вероятно, имеет ионную структуру. Очевидно, что Борат бериллия может служить высококалорийной добавкой к реактивным топливам.
59) в эфирной среде по схеме Алена и бериллия и магния были получены:3I * t + 2UA1H4-21ЛГ / | E (A1H»L (G-C1, br).Белое твердое вещество, легко растворимое в эфире, может быть разложено водой. Его структура. Вероятно, hjalhiohhalhs-мосты, такие как более стабильный MG(AlH4) » пиролиз (если нет воздуха) только выше 140°C 60) среди других солей рассматриваемого элемента особое значение имеют комплексные производные бериллия interest.
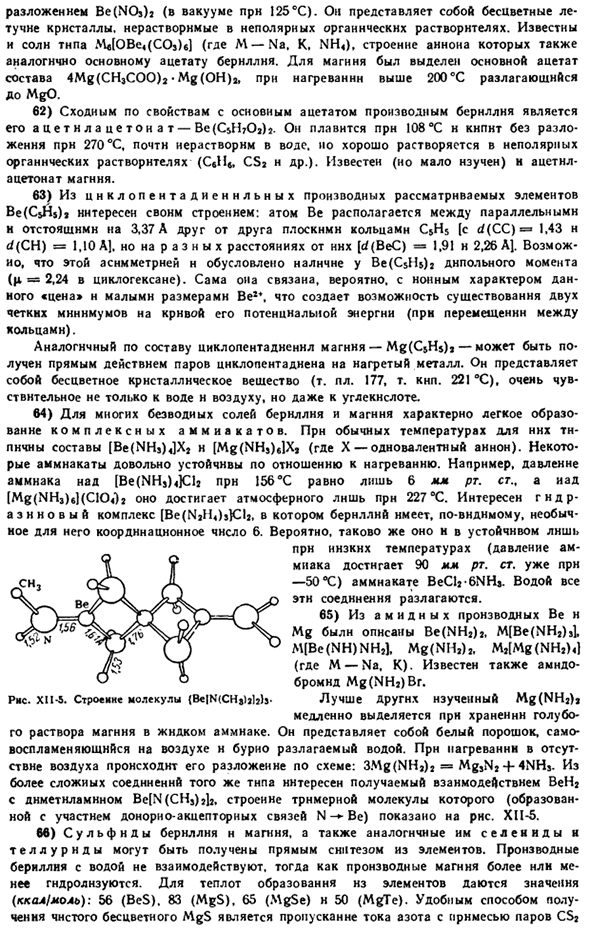
In в этом случае координационный кислород является главным центральным атомом кислорода. Получают взаимодействием основного карбоната и безводного CH3COOH. Рисунок XI1-3.Пространственная структура основного ацетата бериллия. Ряса. XI1-4.Валентная схема основана на ацетате-uoro burnldai. Как безобразие от фиг.
Центральный атом кислорода представляет собой тетраэдр, окруженный 4 атомами бериллия, а последний-4 атомами бериллия соответственно. Кроме 8 обыкновенных баритовых связей, в образовании молекулы участвуют 8 преимущественно 0-«Be связей акцепторных связей (рис. XH-4).Полученная замкнутая структура настолько прочна, что основной ацетат бериллия, кристаллизованный в октаэдре, будет не только плавиться, но и кипеть без разложения(Мп.285. mp.331 * С). он используется для отмывки бериллия от смеси многих других элементов.
Основной ацетат растворяется не в воде, а в неполярных органических растворителях. Производные бериллия, подобные ему, известны по некоторым другим органическим соединениям. acids. At в то же время он отличается от Mg1, A1′ и многих других катионов. Be14 имеет тенденцию комплексироваться с трилонамном(X§ 2 add.88).Это естественно.
Видимо, это очень маленький радиус. c») подобное соединение бериллия неорганическое основной ацетат, свой основной нитрат 10Be4 (NOJ) 6J. (NOj) разложение (125 ° С в вакууме) это бесцветный испаряющий Кристалл, неразрешимый в неполярных органических растворителях. Также соли типа M [«OVe»(SOe) b) (где M-Na. К. Также известный как» НХ»), своя структура подобна бериллию основному acetate.
In в случае магния основные соли состава 4 мг (CH3COO) 2•мг (OH) 2 выделяли и разлагали на MgO при нагревании выше 200 ° С. 62) производное бериллия, аналогичное по своей природе основному ацетату, его ацетат и t-Be (C * H702) 2. Он плавится при температуре 108 ° C, почти нерастворим в воде с рН без разложения 270 ° C, но очень растворим в неполярных органических растворителях (CtH, CS2 и др.).
Ацетилацетонат магния также известен (но редко изучается). 63) из циклопентадиенильных производных исследуемого элемента Be(CsH5h интересен своей структурой: атом Be расположен между параллельным и 3,37 a разнесенным плоским кольцом C5H5 (d(CC)=1,43 и NN , которые позволяют существовать 2 различным минимумам на ее потенциальной кривой.
Энергия (REC перемещается между кольцами). Циклопентаденил магния (Mg (C3Hs) a), который аналогичен по составу, получают прямым воздействием паров циклопентаденила на нагретый metal. It представляет собой бесцветное кристаллическое вещество (mp 177, mp 221®С), которое очень чувствительно не только к воде и воздуху, но и к углекислому газу. 64) во многих безводных солях бериллия и магния наблюдается незначительное образование аммиака. characteristic.
At нормальная температура, состав[Be(NHs) α] X2 иMg(NH3) elXj (X-одновалентный Анон) характерен для nnh. Некоторые виды аммиака очень устойчивы к нагреванию. Например, давление аммиака (Be (NHs)}} Cb pr pr 156°С составляет всего 6 мм рт. ст., а яд (Mg(NH3) 6) 2 достигает атмосферы только pr 227°С. Комплекс DPR-azn (Be (N2H4) 3) Cl2.Бериллий имеет явно аномальное координационное число 6. При низких температурах(аммиак давление уже достигло 90 мм рт. Уже при −50°С) becl2-6nh3 аммиак. Все эти соединения разлагаются в воде.
65) амидных производных Be и Mg, Be (NH2) 2,M(Be(NH2) 3).М (до н. э.(Нью-Хэмпшир) NН 2), мг (nн 2) 2. M2 [Mg (NH2)<] (где M-Na. К) Амндо-бромид Mg (NH2)Br. Рисунок hp-5.Построить молекулу{Be | N (CHt) 2) 2) j. наиболее часто изучается Mg (NH2) j При хранении синего раствора магния в жидком аммиаке выделяется slowly. It представляет собой белый порошок, который самопроизвольно воспламеняется в воздухе и быстро разлагается водой.
При нагревании в отсутствие воздуха он разлагается по схеме: 3 мг (NH2) 2 = MgsN2-f 4NH3.Среди более сложных соединений того же типа интересно получить BeH2 с металлическим названием BelNfCHj).На рисунке 5 НР-5 показана структура его 3-D молекулы (образованной при участии донорно-акцепторных связей N — * Be).
66) прямой синтез элементов позволяет получать сульфиды Берна и магния, а также аналогичные целиды и теллуриды. Производные бериллия не взаимодействуют с водой, но производные магния находятся в большей или меньшей степени при низких температурах. что касается теплоты образования элемента ns, то приведено значение (ккал / моль): 56 (BeS). 83 (MgS), 65 (MgSe) и 50(Mgje).
Удобным способом получения чистого бесцветного МГС является пропускание потока азота, смешанного с парами с ^Он может быть нагрет до 800 ° C с оксидом магния. При 1200°C оксид бериллия реагирует аналогично CS2.Для магния также были получены полные сульфоны MgS»n MgS». 67) бесцветные нитриды Be и Mg получают путем соединения элементов непосредственно с азотом. В случае Be реакция начинается при 900 С, а в случае Mg она быстро прогрессирует от 500 ° С.
Теплота образования нитрида составляет 140 ккал / моль и 111 ккал / моль соответственно. Оба принадлежат к соединению ионного типа (радиус N3 составляет около 1,4 а). Бериллий Ntrnd (Be3K2) очень твердый, он плавится только при температуре около 2200°C (под давлением) и почти не разлагается на холоде water. An интересным методом его синтеза является реакция, протекающая при 700°С по уравнению: ЗВе+ 2kbn = Be3N2-f 2C + 2K. более 700°C нитрид магния (Mg3N2) начинает разлагаться на элементы, а при нагревании на воздухе он сгорает до MgO.
И он быстро распадается на Mg (OH) j и NHS. Смешанный нитрид 3NL1 (E Be. Известен также фторид магния (Mg2NF, Mg3NF3). Для аналога MgsN приведены следующие значения теплоты образования от элементов (ккал / моль): 128(Mg3P»). 96 (Mg3As2), 79 (MgjSbj) и 40(MgjBij).Соединение фосфора Be3P2 известно как бериллий. 68) карбид бериллия в Be2C-композиции (точка плавления 2150°Cdecomp.)
Образуется при нагревании угля и Бэо в электрической печи. теплота образования элемента ns составляет 22 ккал / моль. Судя по структуре кристаллической решетки (инвертированный тип CaF2), карбид бериллия можно считать неионным соединением (Be ^ C4 -).OI медленно разлагается с водой и выделяет метан. Карбид бериллия, образующийся при 450 ° С по схеме be +Н2С » =Н2-fBeC2, разлагается водой с выделением acetylene.
So Oi-типичный ацетонид (X§ 1. добавлять.187). 69) карбид магния-из MgC2 и MgjC-сначала получают нагреванием порошкообразного Mg с потоком этана до 500°C, а затем-нагреванием до 600°C с потоком пентана. Оба карбида являются эндотермическими соединениями с теплотой образования из элементов −21 и −18 ккал / моль соответственно. MgC2 в воде разлагается на ацетилен автоматически, Mg2C3 представляет арилен(СН3—С «СН)и Аллен (Н2С=С=СН2)разлагается.
Он является единственным соединением этого класса, который содержит объявление[С = С = С] 4〜в структуре. 70) силицида магния, Mg2Sl (mp 1100°С) и Mg3Sif известны. В отличие от MgC2, теплота генерации элементов mg2siн3 положительна (19 ккал / моль).Бериллий сплавляется с кремнием, образуя ИНН и некоторые соединения. Mg2Sn(mp 780°С) и Mg2Pb (теплота образования элемента ns, 18 n 13 ккал / моль соответственно) были получены из аналога силицида магнезии.
Последнее соединение бурно реагирует с водой. 71) основными типами досок являются, очевидно, бериллиевые Be «B, Be2B, BeB», BeB.Для Магнен-MgB2, МГБ<, Мгбэ. Наиболее отличительными из них являются медно-красный Be2B и черный MgB2.Хотя содержание бора в кислоте относительно невелико (это не вода), она не разлагается при большом содержании.
72) бериллий обычно очень характерен для образования относительно большого числа атомов Be и соединений, содержащих другие металлы («бериллид»).Примеры: MoBei2, WBei2. Дэйв 2. UBe)3, PuBei3.Последнее из этих соединений используется в качестве источника нейтронов. есть обзорная статья в beryl-lndam. 73) полученный размер с производным одновалентного бериллия.
Очевидно, что Be * n Mg * Nonon образуется в качестве промежуточного продукта при анодировании этих металлов. Частичная растворимость магния в расплаве хлорида(порядка 100 атомов на 1 молекулу), вероятно, связана с равновесием по схеме MgCl2-f Mg * * 2MgCl. Наличие BeF и BeCl при высоких температурах установлено для системы: Befj®+ Be(g)* * 2 BeG (g).Теплота образования газообразного БЭФ из элементов •О и О Ш В Ш * Г. В. Успехи в химии. 1966, м. 5.779.
Положительный (40 ккал / моль), BeC1 отрицательный(-4 ккал / моль).Теоретические расчеты показывают, что железы EG не должны стабильно присутствовать в нормальных условиях (поскольку диспропорционирование по EG и E энергетически благоприятно).Наоборот, при очень высоких температурах одновалентное состояние более стабильно, чем двухвалентное. Результаты теоретического расчета равновесия термической диссоциации хлорида магния XI1-6,
Как видно из того, что показано на рисунке. 74) недопустимое состояние Be и Mg недостаточно изучено производными dnnndrnnyal-3 (Dipyh. It они представляют собой твердые темные цвета, а раствор Тетрагидрофурана (без даже следа кислорода) имеет цвет зеленого (Be) или красного (Mg). 2000 3000 1000 5000 Рисунок XI 1 дюйм. Термическая диссоциация хлорида магния.
Смотрите также:
| Семейство актинидов | Кристаллы |
| Вторая группа периодической системы | Щелочноземельные металлы |

