Оглавление:
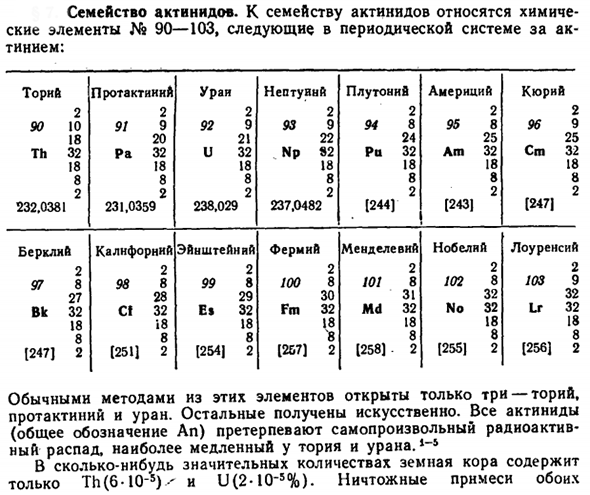




















Семейство актинидов
- Семейство актинидов. Семейство актинидов включает в себя химический элемент No. Она включает в себя 90-103. Торн протактиний уринептун плутоний Америки кюрий 2 2 2 2 2 2 2 2 2 2 90 10 91 9 92 9 93 9 94 8 95 8 96 9 18 20 21 22 24 25 25 Го 32 Ра 32 и 32 НП 82 Ра 32 Ам 32 см 32 18 18 18 18 18 18 18 8 8 8 8 8 8 8 8 2 2 2 2 2 2 2 2 2 2 232.0381 231.0359 238.029 237.0482 [244] [243] [247] Беркли, Калифорния Эйнштейн, фермен, менделиус, Нобель, Лоуренс. 2 2 2 2 2 2 2 2 2 2 97 8 98 8 99 8100 8 101 8 102 8 103 9 27 28 29 30 31 32 32 ВК 32 С! 32 Е » ФМ 32 32 32 32 32 Мкр Не ЛР И8 18 18 18 18 18 18 18 8 8 8 8 8 8 8 8 [247] 2(251)2 1254 | 2 1257] 2 [258] 2 [255] 2 [256] 2
- В обычном виде встречаются только 3 из этих элементов: торий, протохний и Уран. Остальное приобретается искусственно. Все актиниды (обычно обозначаемые как Ан) подвергаются наиболее медленному самопроизвольному радиоактивному распаду в тории и Уране. Небольшая смесь обоих элементов является частью общей породы, такой как гранит. К ним относятся в основном Тритикум (ThSi04) и уранинит (UOn, 2 <i <3).
Значительное количество земной коры содержит только Th (6-10″*) ^и U (2-10_5%). Людмила Фирмаль
Первые 7 членов семейства актинидов более или менее известны, а последние 7 членов малоизвестны. овлено в основном достаточно сложно провести комплексное исследование его химических свойств или даже невозможность получения такого следового количества элементов кюрия. С большим трудом тяжелые актиниды создают очень высокую радиоактивность.
В свободном состоянии первые 7 членов этого семейства-серебристо-белые металлы, которые очень мягкие и легко обрабатываются. Наиболее важные константы для них сравниваются ниже. Го Ра и НП Пу Ам см Плотность, г / см * ……. 11.7 15.4 19.0 20.4 19.8 13.7 13.5 Температура плавления. * S 1750 1575 1133 637 640 1176 1350 температура кипения,°С. 。 4200 3860 3900 3235 2600 Проводимость тория примерно в 5 раз, а проводимость урана в 3 раза выше, чем у ртути. Торий практически устойчив к воздействию воздуха и воды, но Уран медленно окисляется.
Уран более растворим в кислотах, чем торий. Щелочной раствор не действует на оба металла. При высоких температурах оба элемента энергетически связаны с галогеном, кислородом и серой, а также азотом и углеродом. Поглощение водорода в больших количествах очень характерно. Нептуний и последующие актиниды 9-19 близки к Урану по химическим свойствам В соединениях актиниды проявляют гораздо более разнообразное валентное состояние, чем лантан.
Го Ра и НП Пу Ам (2.3)4(3.4)5 3.4.5.6 3.4.5.6.7 3.4.4.6.7(2)3.4.5.6 Cm Bk CI Ea Fm Md No Lr 3、4 3、4(2)3(4)(2)3(2)3 2、3 2、3 3 Наиболее характерные валентности выделены жирным шрифтом, а нехарактерные, злонамеренные валентности выделены жирным шрифтом. parentheses. As как видно из приведенного выше сравнения, наиболее характерная валентность увеличивается, а затем уменьшается. 20-1!
Состояние полцены, которое максимально достигается нептунием и плутонием, не является для них наиболее характерным. Поэтому зеленые или синие растворы npvxi и производных каламбура образуются под действием озона на щелочные суспензии Нептунов или плутонатов, например по схеме. 2K2E04 + 03 + 2KOH = 2KzE05 + 02 + N20 Типичным примером индивидуальных соединений являются соли бария типа Ba3 (E05) 2-lH20, отделенные от обоих элементов. Стабильность значений+7 при переходе от Np к Pu существенно снижается. шестивалентное состояние gs является наиболее характерным и стабильным для Урана.
Оранжевый высокий оксид при кипячении в воде (U03)Он превращается в практически нерастворимый желтый гидроксид [U02(0H) 2, или H2UOJ. Последние обладают амфотерными свойствами, преобладание которых является более основными свойствами, чем кислотные. Соли урановой кислоты (уранаты) практически нерастворимы, поэтому под действием щелочи они не переходят в раствор.
Напротив, кислота образует зеленовато-желтую соль Ионов UOj +, которая легко растворяет U02(0H) 2 (r a n и l a).Большинство этих солей хорошо кристаллизуются и легко растворяются в воде. Из них нитрат уранила [U02 (N03) 2]является распространенным урановым продуктом, доступным на рынке. Окислительные свойства производного шестивалентного урана не являются характерными. Как и другие соединения U, они все токсичны.
Оксиды eo3 Np и Pu не получают. Соответствующий коричневый гидроксид является по существу амфотерным. Из них, с одной стороны, получают Нептун и плутонаты, а с другой стороны, получают Нептун П л в Ниле (МРОГ) и его Н И Л и (Риог).Твердый, но Летучий фторид 3Fe (PuFe нестабилен) был получен с U, Np и Pu. Подобные хлориды (UC16) известны только в отношении Урана. В серии U-Np-Pu-Ash характеристики шестивалентного состояния снижаются.
Лучшим оксидом, полученным в безводном состоянии, является U03 для Урана, Np308 (Np20s-Np03) для нептуния и Pu02 для плутония. Образование производных NpVI и PuVI в растворе возможно только под воздействием самого мощного окислителя, а нептуний легче окисляется, чем плутоний. Производные NpVI и PuVI сами окисляют соляную кислоту (NpVI-медленно, PuVI-довольно быстро), поскольку они являются очень сильными окислителями в кислой среде.
Пятивалентные производные актинидов относительно плохо изучены. Они характерны в основном для протактиния, но некоторые также характерны для U, Np и Pu. Белый огнеупорный материал Ra205 легко образуется при нагревании Ra в кислороде. Соответствующий гидроксид [Ra (OH) 5] практически нерастворим в воде и характеризуется очень плохими основными свойствами. Из других производных Ра, в частности, известен только RaC15.Соединения протактиния обычно бесцветны.
Соединения урана, полученные из других пятикомпонентных производных актинидов в их отдельных состояниях, очень мало относятся к U2O, UF5 и UCU. Для U, Np, Pu и Am установлена возможность присутствия ионов E02 в кислой среде, причем NpOi является наиболее стабильным. Свойства окисления государственной пятивалентной характерны только для плутония и америция.
Валентность 4 является воплощением тория и играет более или менее важную роль в химии многих других веществ. actinides. In в случае нептуния и плутония эта валентность является одной из наиболее характерных 1, но соединение UIV (полученное действием Zn в кислой среде против ураниловой соли)явно выражает восстановительные свойства. Подавляющее большинство производных тория бесцветны, а другие четырехвалентные соединения актинидов характеризуются наличием 1 или другого цвета.
Оксид Е02 представляет собой твердое вещество, которое практически не растворяется в воде. Последний применяется к гидроксиду е (он) 4, который обладает основным свойством. Соли, полученные из них, подвергаются очень важному гидролизу в растворе. Трехвалентное состояние наиболее характерно для последних 8 актинидов (за исключением норберия), америция и некоторых из них плутония.
Производные Риша сами по себе стабильны, но легко окисляются. Поскольку соединения NPN в растворе уже окислены кислородом атмосферы, а затем переведены в Um, восстановительная активность становится очень большой, растворимые 3-валентные соединения урана медленно разрушают воду замещением водорода(то есть, как и в активном металле, они окисляются ионами H*).
Труднорастворимый гидроксид E (OH) 3 является по существу основным, образуя сильную кислоту и соль, которая лишь незначительно hydrolyzed. In его растворимость, oii подобна соответствующему соединению лантана. Аналогия с этой характеристикой еще раз подтверждает, что рассматриваемый химический элемент является правильным сочетанием в семействе актинидов. Вт-101 В то же время имеющиеся фрагментарные данные решения показывают, что устойчивость двухвалентного состояния ряда Cf — Es — Fm — Md — No возрастает, что наиболее характерно для новеллия.
Однако, как и в случае лантаноидов, невозможно привести последний актинид (Lr) в двухвалентное состояние. ш-м Добавь 1) элемент нет. Актинидийская интерпретация 58-71 была предложена Вильяром (1942).Сравните годы их открытия со следующими. Th Re и Np Pu Am Cm Bk C (Es Fm Md No Lr J828 1917 1789 1940 1940 1 944 1944 1949 1950 1954 1954 1955 1958 1981 2) актиниды и лантаноиды в нашей стране часто называют актинидами и лантаноидами. Эти названия используются в древнегреческом языке
В языке(от формы, в которой генерируются имена обоих типов) трейлинг»ida»означает»потомок»,»следуй», а трейлинг»onda» означает «подобный«.Если оба термина более или менее правомерны в отношении лантана и лантана, то совершенно очевидно, что торий и его последующие элементы нельзя рассматривать как актиний. Поэтому изменить общепринятое в мировой науке название группы обоих элементов NoTm БФ БК См-Ам / МНН ФЛ Л Л Л Lr Md ES Ыб Ор Ды Й ГД ЕС Число и N PL Лютмут Отсчет падения- Диаграмма XI-54. елуя-Ромика Коков Е3 последовательности * актинидов против Лам-ти МФА.
Товарищей быть не должно. 3) тяжелые актинидные элементы были получены в очень малых количествах. Их разделение достигалось хроматографией (VII§ 3) — при обработке использовали специально подобранный катонит, в котором адсорбент отдельных актинидов непрерывно промывали каплей соответствующего чистящего раствора («элюента»), начиная с самого тяжелого. РНС. XI-54 показывает. При элюировании в тех же условиях актиниды ведут себя аналогично лантаноидам. Изучение радиоактивности первых выщелачиваемых фракций позволяет установить, известны ли уже входящие в них атомы или получены первыми.
Например, открытие менделия (М-101) было сделано в 17 атомах Md, которые в порядке экссудации располагались непосредственно перед атомом с номером элемента 100 (Fm) и были известны до настоящего времени. 4) торий, первый член семейства актинидов, является «чистым» элементом mTh со средним атомным временем жизни от 2 до 10 лет. Из протоковых изотопов Титан — самый важный элемент в природе-I, Ra (средняя продолжительность существования атома составляет 48 000 лет).
Природный уран состоит из 3 изотопов — (0,006), (0,720) и » U » (99,27%).Самый прочный » U » (средняя атомная жизнь составляет 6,5•10 * лет).Для нептуния и других актинидов известно много радиоизотопов, и те, которые цитируются в тексте, являются наиболее долгоживущими. * Год.)л4 «Пу (МО * л),*» М.(Л.’oo4 л),^ СГА(310 г / л), » БК(110 л с). M’c (1-10 «l),^ Ez (400 d). «ФМ (115 г), *» МД(78 г). «Нет (4М),» ч. G (35 секунд). 、 5) структура внешнего электронного слоя атомов актинида до сих пор почти наверняка была установлена только для тория, урана, плутония, америция и кюрия.
Первый на этом основании официально не актинид, а аналог гафния, то есть член 4-й группы. Однако весь набор данных по характеристикам самого тяжелого элемента считает Th актинидом (имеющим аномальную электронную структуру). > Распределение внешних электронов в оставшихся атомах актинидов дано на основе данных 5 элементов выше и общих соображений об изменении относительной стабильности отдельных подгрупп электронов с увеличением заряда ядра (VI§ 3, 7). это может быть не полностью accurate.
It следует отметить, что подгруппа 5 / в 6d, в зависимости от энергии связи электронов, близка друг к другу (эти энергии сравниваются на рисунке XI-55).Очевидно, что их взаимное расположение может в некоторых случаях изменяться даже под влиянием изменения состава исследуемых соединений. 6) основной промышленной рудой терновника является монацитовый песок (§ 6 add.4)и может содержать до 25% Th.
Уран используется в основном для уранинит (урановая смола руды) и kariotite (САО•2UOj•V1O5•3HjO).Ежегодная мировая добыча металлической мочевины оценивается в десятки тысяч тонн (за исключением СССР). 7) на данный момент ядерная энергетика фактически является единственным потребителем урана, использующим либо 1,5 ЕД изотопов, выделенных из общей массы элемента, либо обогащенных uranium.
In дело в том, что в ядерных реакторах расходуется более нескольких процентов исходного количества урана, в то время как остаток, обедненный изотопами mU, составляет waste. In в этой связи вопрос об ассимиляции урана с точки зрения неядерного использования (§ 4ext.9) очень важно. 8) Содержание протактиния в земной коре составляет всего 8 «l0-rt%.It всегда входит в состав урановой руды, с соотношением около 1000 г Ра на U0, 3 кг. Эти руды также содержат Pu в количестве порядка 10 «%против U, и даже несравнимое количество neptunium.
In земная кора есть обзорная статья 0) ThF4 является общим исходным сырьем для металлического тория production. It восстанавливают металлическим кальцием или подвергают расплавленному электролизу смеси NaCl 4-KC1.Теплота плавления и испарения тория составляет 4,6 и 130 ккал / г атомов соответственно, а теплота атомного заряда (25°С) оценивается в 137 ккал / г атомов. Электронная функция работы от поверхности тория составляет 3,39 эВ.
Небольшое количество (1-2%) его добавок значительно увеличивает электронную эмиссию вольфрамовых катодов. * Цадвгка Р. Лапяцкий А, В., успех», 1М0, J * 12, 1487 Ст. 69 91 93 95 97 99 атомный номер Диаграмма XI-55.Относительная энергия перешла mektrobo 5Ф с 6д. 10) свежая поверхность компактного шипа в воздухе постепенно сереет, но окисление толком не распространяется(с другой стороны, мелкодисперсный шип порфоричен, то есть при нормальных условиях он уже самовоспламеняется в воздухе).
Когда корни обрабатывают кипятком, они покрываются кислородной пленкой. Продуктами взаимодействия с водяным паром при нагревании являются TH02 и водород. Разбавленные растворы кислот (включая HF) медленно воздействуют на компактный металл. Концентрированная HNOj пассивирует его. Напротив, сильный HC1 растворяет Th довольно быстро.
Однако, это частично формирует черный цвет и неразрешимо в веществах HCl. Его образование можно предотвратить, добавив к кислоте небольшое количество фторида или Фторсиликата. Эти же добавки стимулируют растворение металла в азотной кислоте. Лучшим растворителем для шипов является царская водка. Имеется обзорная статья о специальной монографии тория* n 11) путем разложения прокладок на вольфрамовой проволоке в высокотемпературном вакууме был получен элемент проточний (100 граммов 1-минутного количества).
Это серебристо-белый блестящий металл, выцветший на воздухе. Давление пара на нем при температуре около 2000°C составляет всего 5-10 ″ * атм. У меня есть обзорная статья о протактинии. 12) основным способом получения металлического урана является восстановление УФ магнием. Известны 3 аллотропа, но точки перехода между ними находятся при 668 и 774°С. низкотемпературный Тип (А) является относительно малоупругим.
Средняя температура (p) хрупка, а высокая температура (y) очень пластична. Теплота плавления и испарения урана равна 3,7 и 101 ккал / г атомов соответственно, а теплота сублимации (25°С) оценивается в 126 ккал / г атомов. Первый потенциал ионизации атома U составляет 6,3 вольта. 13) поверхность свежего серебра компактного урана в воздухе быстро приобретает золотистый оттенок, после чего она покрывается черной пленкой оксн, которая не защищает металл от дальнейшего oxidation.
As с торием, в тонкоизмельченном состоянии, Уран нитрофоис. Компактный металл бурно взаимодействует с кислородом, фтором и водородом при температуре около 250°C с серой и хлором при 500 ° C с азотом. Кипящая вода реагирует медленно в соответствии с уравнением. U + 2HzO-u02 + 2H*. Основным непосредственным взаимодействием водяного пара с U является та же реакция, но при относительно низких температурах частично(с разной скоростью) протекают следующие подпроцессы: 2U +ЗНа = 2uh3 и 2uh, + 4Н * 0= «взаимодействие 2uo * +7н урана с водяным паром еще более активно, чем горение металлов в кислороде.
Уран, как и торий, очень быстро растворяется в HCl, частично образуя нерастворимое вещество черного цвета (его появление можно предотвратить добавлением небольшого количества фторосиликата).Уран медленно реагирует с HF и H2SO, но довольно быстро с HNOj(в мелкодисперсном состоянии, вплоть до взрыва).Щелочь растворяет этот металл только в присутствии окислителей (H2Oj и др.).
Есть специальная монография об Уране. 14) элементарный НП. Pu, Am и CrH были получены в очень небольших количествах (за исключением Pu) путем уменьшения фторида 3FS с кальцием или барием на максимуме temperatures. As а также литий, БК (Мп. Получают с использованием 986°C). в случае нептуния известны 3 аллотропа(точки перехода 280 и 577°C), а в случае плутония-6 гомологов(точки перехода 122, 203, 317, 453, 477°В) также известны. От «Рябчиков Д. И. Гобра а х Е. К..
Достижения в области химии.1939, м. 4. 406. • * К * п А и Г. Е. Успенская Т. А.. 3 Об а ре м б ю. И. Из ч и р И. В. О Тории. М «атом» дата. 1900.22 секунд •••M vji и I-Это О В. А.. Достижения в области химии. I960, M 7. 882, B о u и D, M»dd о a, chi-MIN успех. В 1966 году М. С. 460. Это к. Рабинович и Д. Е. химия урана. М от английского пер.. Пламя фамильного герба. I9S4. Страница 491 Вдовейко В. М., улайя и Триест элементная химия. Л. издатель Академии советских наук. I960.- 700С、 Рисунок XI-56 является характерной особенностью плутония типа U и b ’.
При нагревании они не расширяются (как и все другие предметы), а несколько сжимаются. Теплота испарения плутония составляет 80 ккал / г атомов, а первый потенциал ионизации атома составляет 5,5 вольт. Плутоний легко растворяется в NS! Он медленно взаимодействует с разбавленным H3SO4.Однако он нерастворим в концентрированных HaSO ’и HN’J любых concentration. It также инертен к щелочным растворам.
15) значительная часть исследований по химии НП и последующих актинидов(особенно в первые годы исследования) проводилась в количестве, рассчитанном в микрограммах (мкг или у).То есть 100 миллилитров по 1 грамму. Это потребовало разработки специальной ультратонкой химической методики, при которой все реакции проводились в капиллярах под микроскопом и с использованием кварцевых пружинных весов с чувствительностью до 10〜* г нТл. 3 мм, образец металла составил 40,32 мкг.
16) химические исследования многих vctiiid в значительной степени затруднены быстро происходящим радиоактивным распадом. Таким образом, самый доступный изотоп кюрия-J42Cm (средняя атомная жизнь 235 дней)-распадается примерно на 0,5% за 1 день и является очень горячим, а раствор соединения всегда находится в контакте с ним. Он выделяет газы (образующиеся при разложении йода под действием радиоактивного излучения).Имеется обзорная статья*и специальная монография по химии актинидов.
17) поглощение водорода элементами актинидов уже замедляется в нормальных условиях, но значительно ускоряется при mounted. As итог АН образуются гидриды. Они имеют вход черного или серого (в зависимости от размера частиц) порошка и приближаются к формуле EN4 (для Th и Np) или ENE (для Pa, U, Pu, Am) по отношению к их предельному составу.
18) гидрированный Уран был изучен лучше других, поэтому мы обнаружили, что он точно соответствует составу UH $в пределах 150-330°C(при атмосферном давлении водорода).Конфигурация атома урана в кристалле этого соединения показана на рисунке. XI-57, и атомы водорода, вероятно, будут находиться в пустотах решетки (cf (UH)= 2.32 A).Гидрид урана обладает довольно значительным тепловыделением (30 ккал /моль).
При плотности 10,9 г / см9 он характеризуется высокой твердостью и хрупкостью, но в то же время имеет 4 металлических блеска и хорошую проводимость (например, равную проводимости мочевины).По-видимому, его внутреннюю структуру можно представить схемой U * * — FЗН-U4 * — fзн«+×.Гидрогенизированный Уран имеет очень высокую reactivity.
It самовоспламеняется на воздухе и является сильным восстановителем(особенно при нагревании) J00 ЮО 200 МО соо * с Рисунок Xl-56.Аллотропия и рутоний. РНС. XI-57. In3 массив атомов урана в кристалле. — С. С3!% * N и Р. В, К Р и К и т. успех в химии. 19С3, 7 * 5, 583. «В.» Челебренников. Химия актинидов. Томский. Идоин Томского государственного университета.1956.101 е. Сивог Г. Т.. К А и Д. Д. Хнмни актинид. С английского, Изд. Джекоб Рис-Могг, М. «Я не собираюсь этого делать», — сказал он. I960. 542р. 4 Б, В. Некрасов
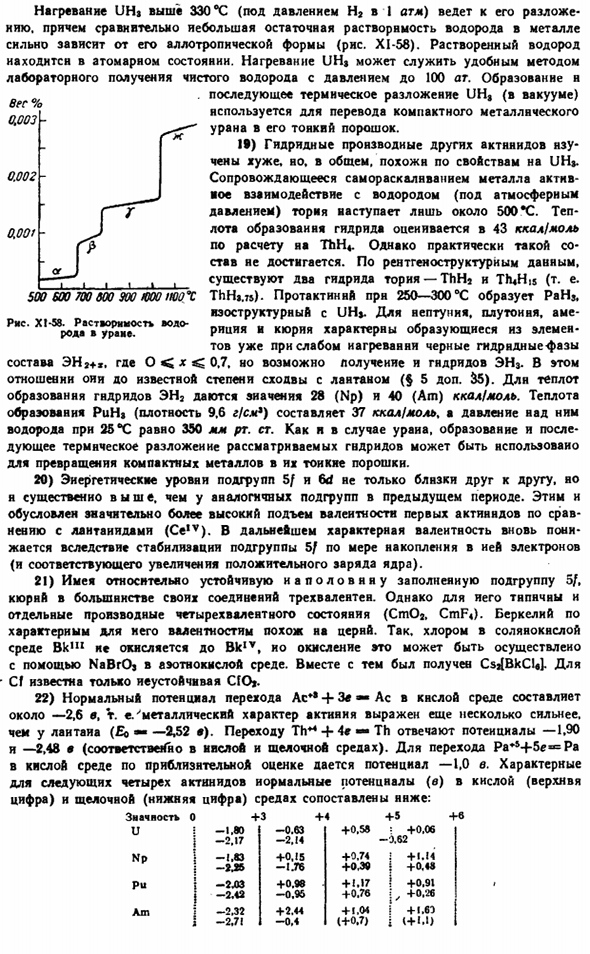
Когда UHj нагревается до температуры выше 330°C (под давлением 1 атм H2), он decomposes. In кроме того, относительно небольшая остаточная растворимость водорода в металле сильно зависит от его аллотропии (рис. XI-58).Растворенный водород-это атомарное состояние. UH $heating является удобным экспериментальным методом для получения чистого водорода при максимальном давлении 100 атм.
Образование и Последующий * uh пиролиз (в вакууме) используется для превращения компактного металлического урана в его мелкодисперсный порошок. 19) другие производные гидрида актинида не очень хорошо understood. In в общем, свойство похоже на UH.»При саморазрушающемся металле-активном взаимодействии с ториевым водородом (при атмосферном давлении)происходит только около 500 * С.
Теплота образования гидрида оценивается в 4 ккал / моль, рассчитанная при тнн 43.Однако на практике такой состав не был достигнут. Согласно данным рентгеновской дифракции, существует 2 гидридных ториома THHj и TJuHjs(то есть 500 600 700 600 900 10 000 WQX TIN. it это не так. Протактиний при 250-300°С образует пробег. Та же структура, что и ух. Нептуний, плутоний, америций и кюрий характеризуются образованием черной гидридной фазы в составе EN2 + X.
It образуется из элемента даже при слабом нагреве (O <x <0.7, но мы также получаем гидрид EN3).в этом отношении они несколько похожи на фонарь ($5 ext&5). Для теплоты образования гидрида EN2 приведены значения 28 (Np) и 40 (Am) ккал / моль. Рин образуя тепло»(плотность 9,6 г / см*) составляет 37 ккал / моль. Давление водорода при 25 * 0 составляет 390 мм рт.
Искусство. Образование рассматриваемых гидридов и последующий пиролиз, как и в случае с Ураном, могут быть использованы для превращения компактного металла в его мелкодисперсный порошок. 20) энергетические уровни подгрупп 5 /и 6d не только близки друг к другу, но и значительно выше, чем энергетические уровни аналогичных подгрупп в предыдущем периоде.
Это является причиной значительно более высокого увеличения валентности первого актинида по сравнению с лантаноидами (Ce, v).Впоследствии, со стабилизацией подгруппы 5/, характерная валентность снова уменьшается, за счет накопления в ней электронов (соответственно, увеличивается положительный заряд ядра). 21) полустабильная подгруппа 5 / относительно стабильна, поэтому Хан большинства соединений является 3-валентным.
Однако отдельные производные четырехвалентного состояния(CmOj, СМИД) также типично. Со своей характерной валентностью, беркелий подобен а turn. So хлор Bk1 в среде соляной кислоты окисляется до BkIV«, и это окисление может быть выполнено с использованием NaBrOs в азотной кислоте medium. At в то же время, мы получили CsJBkCU}. «Cf известен только в нестабильном SJ.」 22) переход Ac ** + Ce в кислой среде » нормальный потенциал переменного тока составляет около ~ 2,6 вольт.
То есть металлические свойства актиния еще более выражены, чем металлические свойства лайтерии(£o—2.52•).Переход Th * 4 + 4#Th соответствует потенциалам от −1.90 и −2 ГГц до 2.48 В соответственно в белой и щелочной средах. Для перехода Pa ^ -fSe ^ Pa в кислой среде получен приближенный потенциал −1,0 вольт.
Сравните типичный нормальный потенциал © со следующими 4 актинидами в кислой (верхняя цифра) и щелочной (нижняя цифра) среде: 0.001- Рисунок Xl-58.Растворимость водорода в уране. +3 +4 +5 Плавучесть 0 Да! 1 я −1.80 −0.63 +0.58 +0.06 −2.17 −2.14 −0.62 — Это 4.-0.15 +0.74 + 1.14 −2 «-1.76 +0.+0.48 — 2LZ +прибл. + М7 +0.91 »-2.42 −0.96 +0.76✓ + прибл.」 232 +2.44 + 1.04 + 1.60 −2.71 −0.4 1 + 0.7 (+1.1) НП Pu Утро Обычный потенциал перехода Bk * 4 + e в кислой среде = «Bk°» составляет около + 1,6 вольт.
23) возможность существования семивалентного состояния N’P и Pu была установлена лишь недавно(Н. Н. Крот и А. Д. Гельман, 1967 г.). для получения их производных можно использовать не только Озон, но и другие окислители (внпохлорит и др.). При тщательном подкислении щелочного раствора Npvn (до pH 5) выделяется черный осадок Np02(0H) s-nHa0.Имеет амфотерное properties. In кислота, она образует нестабильный коричневый катион.
Это«очень сильный окислитель (1МНС10 NPV,/ / npvl, нормальный потенциал выше + 2.1 V).Получил соль Ba * \ Sra *и некоторые others. In в твердом состоянии и в щелочных растворах (когда концентрация избытка щелочи превышает 1 моль / л) они практически стабильны, но соли пуоевого аниона темно-синего цвета (полученные с помощью Baa * n Sr’) разлагаются постепенно.3V,, / 3v1 пар в щелочной среде получали сухим методом, близким к+ 0,6(Np) или + 0,9 в (Pu)- ’ 100eC смесь LljO и E02 в потоке кислорода-Pubn производные Npvn и типа 1 LEO были получены. 。
24) при сжигании урана в кислородной атмосфере (или воздухе) не образуется UOj. Уджот. Получение триоксида урана удобно осуществлять путем тщательного обжига (ниже 450°с) нитрата уранила. Теплота образования от элемента очень высока (293 ккал / моль).он известен своими аморфными и 5 различными кристаллическими метаморфозами.
25) показано наличие нескольких кристаллических фаз в середине композиции между U03 и UO.Наиболее важным из них является зеленовато-черный оксид U, O (теплота образования из элементов 856 ккал / моль). он возникает в природе и образуется при нагревании многих соединений урана air. In в чистом виде его получают, например, пиролизом при 800-900°С (Nha) 2UaOr. Кристалл U30 $содержит атомы и U * 4.То есть структура этого смешанного оксида представлена формулой UOj-U ^ Oj.
26) В результате взаимодействия производных NpIV или Npv при 400°C с NO* образуется коричневый NP «0 $оксид с той же структурой, что и U30 *formed. It можно также получить путем нагревать 300-400 ° С (NH») aNp * 07 в воздухе. Когда этот оксид нагревается еще до 600 * C, он переходит в MrO2. При растворении Np3O в хлорной кислоте образуется смесь производных Npv и N’VR.
27) встряхивание UOj с водой приведет к образованию HaUO ^ HjO[вероятно-(HjO) HUO»l. при нагревании этого желто-зеленого вещества непрерывно образуются желтый H2U04 (100), светло-желтый H2U2Or (160) и UOj (400°С). 28) на основе продукта окисления Np°озоном (расплав Eut LiN03 + KCOe)получен состав Np03-2H20 (вероятно (HjO) Hnpa) бурого гидроксипнеутония. Легко получить гидратированный оксид путем обработки водной суспензии гидроксида нептуния 18 * C при 5 валентности озоном.
29) цвет Урана сильно зависит от природы cation. So соли Na и K имеют желтый цвет.’- RB и CS оранжево-красные. При сильном нагреве дна AG-сверла I уранат щелочного металла (выше 1000°С) будет постепенно разлагаться по схеме 2Ma04 — M10 + M2i207. В серии LI-Cs термическая стабильность уранатов снижается. Это, по-видимому, связано с увеличением летучести одного и того же ряда оксидов MuO (или продуктов их дальнейших превращений). 30) коричневые Иептунаты и Плутоиаты сходны по общему характеру с Уракатами. Однако, он более растворим в воде.
Шестигранный камень состояние NP и PU в щелочной среде стабилен. 31) кроме обычных солей урана, известны некоторые металлические мезоулины. Производится из богатых водой форм мочевой кислоты-Н»УО и Н» Уоэ. Примеры красный Na U05 или ярко-желтый CseUOe. As как правило, они похожи на месопелат(VII§ 6 дополнение.58).Сушка (из оксида) В атмосфере 400 ч-900°С) для нептуния, плутония и америция, а также соли типа m, E05 и MЭEOv (M-это Li. Na) был получен.
- 32) когда щелочь воздействует на раствор шестивалентного производного урана, в большинстве случаев почти не образуется простой уреат (M, UO»), а на самом деле нерастворимый MjUjO? В частности, Oracija NajUjO; является основным продуктом химической переработки уранового концентрата и служит нормальным исходным материалом для получения остальных соединений урана.
Триуриаты MiUjOw и более сложная полимочевина (MjOnUOj) также являются known. 33) окисление нептуния и плутония до шестивалентного состояния удобно проводить в высокотемпературных сернокислотных средах с использованием KMnO или KsS ^ O *(в присутствии ионов Ag, играющих каталитическую роль).Под действием КБРО *в аналогичных условиях НП быстро окисляется, а Пу только очень медленно. Как NpVI, так и PuVI в водных растворах медленно восстанавливаются продуктом собственной радиоактивности и взаимодействия со средой.
An примером может служить желтый Na3UieO»». Людмила Фирмаль
34) производных ОР | +ионы, U. Он играет важную роль в химии НП и Пу. Особенно первый из этих элементов. Ионы UO * имеют симметричную линейную структуру, а расстояние rf (UO) несколько отличается в зависимости от соединения( 1,6-2,0 А), но в большинстве случаев ближе к 1,9 А. константа силы связи E-O уранила и его аналогов составляет 7,2 (U). 7.0 (НП) и 6,8 (Пу).Большинство солей этих катионов (в частности, F», СГ, no», с1о7, chscoo») легко растворимы в воде и выделяются из раствора в виде кристаллогидратов. Среди труднорастворимых солей наиболее распространены йодат, фосфат и оксалат important.
In сильно кислая среда, равновесие осуществляется по схеме UO,+2НHTO-fUO :;и характеризуется величиной K 6-10″*. 35) ЭО? Основные свойства гидроксидов (он) не столь выражены, и гидролиз образующихся из них перхлоратов становится заметным даже в достаточно кислой среде. Для большинства других солей это не так много, но это связано с наличием ионов EO *, которые, как правило, комплексуются с соответствующими anions.
As в результате такого комплексирования розовый цвет Ионов NpOj ’ и PuOj обычно изменяется на зеленый или желтый. 36) В дополнение к комплексному растворимому ацетату Na-типа, который очень характерен для U, Np, Pu[30j (CHsC00) j]. Там был осадок Na [UO«(NOs) j]. CsjUOaF]. KjIU07F5J. Cs, [UO, КР. К ^ uohso.).]. «NaalUOifCjO»)] и так далее. Растворимость этих соединений часто сильно отличается от растворимости исходных простых солей.
Особенно характерным для Урана является наличие UV / Naj (UOj (CO») j]и Na, растворимых в сильном растворе соды с образованием комплекса [U02 (C03) j].Их основной uainla car-sonate (UOjCO) представляет собой слаборастворимое бледно-желтое вещество, которое расщепляет COсложный карбонат K2 (CO2 (CO2b)) также известен для нептуния и плутония. Также был получен Pu02C03.Существует специальная монография о производных уранила.
37) наиболее практически важными солями hqhob 30j *являются таковые и их стоимость (соль Jeptunl известна только в растворе).Они растворимы в эфире и достаточно удаляются последним из водных растворов, подкисленных HNO3 (особенно насыщенных NH» NOs»).При взаимодействии с эфиром кристаллогидрат U02 (N0sb-6H20) образует 2 слоя, а кристаллогидрат UOj(NOj) j-2HjO растворяется равномерно. Состав U0, (N03) i-2Hl0-2 (C, H$), 0 (mp 45) и U0, (N03h-2H, 0 ^(CjHshO(mp 2°C)).
Эти этоксониевые соли (соответственно кислые и умеренные) комплексных кислот h4u0″(N03) J. смешанные * Л ’П И Л И И и И. И. у раненых» связь. м.. И БК, Академии Наук СССР. 1959 год. 315 С. Стальной сольват U02 (N0s) j-3Hj0-(CjH.) jO(mp 62°С).Среди других производных уранилнитрата, желто-зеленого CsjlUOjfNOsb]и продуктов присоединения U0, (N03), 2DMF (x§ 2 add.84), U0, (N03), — 2CH3CN следует отметить. Ц0,(с бортовым номером 03),- * 2СН3СООС2Н5, U0J(с бортовым номером 03) Дж Nj04.By их последний пиролиза (пр 163°С) безводный U02 (с бортовым номером 03) 2 получается.
38) его перхлорат u02 (СУ4Ь ’ * 6hjo (MP 185 ° С)) был близок по свойствам к nitrate. At 270 он теряет кристаллическую воду, и prn 375°С разлагается(из-за образования UO).Уран-и (OSZN$) в * темно-красной жидкости, может быть дистиллирован при пониженном давлении без разложения, но очень чувствителен к влаге. 39) среди галогенид-ионов UOj * наиболее сильно связывается с ионами F «.Когда бледно-желтый U02 нагревается, он не плавится, но начинает разлагаться при 700°С или более (в основном формула: 9U02Fj =«3UFe-f2u30§-L0z).
Постоянная непрерывной диссоциации уранилдифлуранта в водорастворимом (около 7: 10 по массе) составляет 5-U «4 и 2-10»*.То есть эта соль представляет собой соединение, которое недостаточно диссоциировано. Оставшийся Галанд, напротив, сильно диссоциирован в растворе урана (U02I2 очень нестабилен). 40) константа диссоциации не-U02Nj равна 5 * 10-3.То есть, с точки зрения прочности связи с UOJ*, Ион NJ приближается к Иону F.
In в растворе роданидное производное уранила сильно диссоциировано. 41) уранилсульфат имеет интересную особенность. Когда его молекулярный раствор нагревается до 300°C (под давлением), жидкость разделяется на 2 слоя. Аналогичное поведение наблюдалось в растворе U02Fi в диапазоне 320-333°С. Пиролиз UO * SO («U30» и оксиды серы) происходит только при температуре более 720°C).
42)при действии соли уранила (NH -) 2S в раствор образуется коричневый осадок сульфида уранила-UOaS-осадок. Последний почти нерастворим в воде, но легко растворим в разбавленном виде acids. In влажные условия, он быстро достигает UO»(OH) через воздух. Продукт растворимости гидроксида уранила составляет 210″». 43) взаимодействие между U03 и KF при 850 ° С привело к образованию оранжево-красного KU03F, слабо растворимого в воде.
Это вещество разлагается с сильной кислотой (образование производного уранила) и с аддуктом слабого органического вещества form. An примером является желтый KU03F-2CH » C00H, который разлагает уксусную кислоту только около 400°C. 44) ацетат натрия Na [AMO *(CHjCOOhJ) в сочетании с (NH, в слабокислой среде при нагревании) (NH.) 2S20e окислением 3-валентного америция и последующим добавлением в раствор CH3COONa. Аналогичные производные U, Np N Pu изоморфны красным CsJAmOiCUJ.
Если константа прочности связи Am = » 0, то не-AmOj *присваивается значение 6.1.Окислительная активность не-АТО примерно такая же, как и у не-Кэ: очень высокая. Действие собственной радиоактивности. 45) гексафторид U, Np и Pu получают реакцией четырех фторидов с избытком фтора при 300, 500 и 750°C соответственно. Теплота, выделяемая из элемента, оценивается в 516, 472, 460 ккал / моль.
Молекула гексафлуорона представляет собой октаэдр, имеющий следующие значения ядерного расстояния (а) и силы связи: 2.00 и 3.8(U), 1.98 и 3.7 (Np), 1.97 и 3.6 (Pu).Некоторые свойства этих веществ сравниваются ниже. UP, НПФ, ПФР 64 (пресс) 55 52 57 (w3d. (55) 62 Бесцветный оранжевый цвет бесцветный Бесцветный бесцветный Корти Температура плавления. ° Point температура кипения,°С. Цвет (T » * pa°m ^ \ в парах. Хорошо.
Под действием света НПФ «и ПНФ» (но не UF$) разлагается постепенно по схеме 3F» — «* 3F» — F«. AMF извлекает «терпит неудачу, но AmO» F известен. 46) гексафторид урана образуется, когда BrF присутствует в большинстве соединений этого типа. element. It является очень реакционноспособным веществом(например, оно реагирует уже при 100°С по схеме UF + 2HBr UF4 + 2HF-Bn).
Интересно, что при взаимодействии в парах с CS. Раздавить УФ, — сказал SF4.In кроме того, Ди-и трисульфидные производные трифторметильного радикала — (CFshS и (CF») > Sj (cf. X§я добавляю.165).Текущая UF вода легко гидролизуется и была предложена в качестве ее стабилизатора (при хранении в стеклянной таре). Под действием UF # для NAF, разделенного на мелкие), образуется желтый аддитивный продукт композиции UF # -nnaf.
Вещество устойчиво в сухом воздухе (при давлении пара UF, выше его достигает всего 30360 мм рт. ст. при 7°С), но гидролизуется в воде. Фторид К. аналогичный желтый аддукт был получен в Rb, Ag и TI(не в LiF). Желтая соль типа mhuft и бесцветный MUF7 (M-Na, K) также имеют меньшие характеристики урана. Среди других продуктов, добавленных UF, » самый интересный солеподобный зеленоватый НУФ? И Ноджюфы.
Имеется обзорная статья по химии фторида урана. 48) первый бесцветный PuF » становится коричневым при хранении. Это, по-видимому, связано с довольно быстрым (1% в сутки, около 1,5%) возникновением частичного разложения своими силами radioactivity. It энергетически фторирует многие другие вещества (например, по реакции PuF «- fBrFj = PuF »- fBrF*).
Во влажном воздухе PuF является » puojf * (около 1 г / л), который легко гидролизуется в воду и трудно растворим. НПФ обладает аналогичными свойствами.」 49)шестивалентный хлорид черного урана образуется при разложении UCI5 по схеме: 2UCU- * UCl4-fUCI#.Теплота образования от элемента составляет 273 ккал / моль. Это вещество очень неустойчиво, и если оно уже выше 100°C, то оно отсекается с переходом CI в UCI. Реакция по схеме 2UF «+ UCU — » 3UF4-f3Clj протекает медленно со смесью обоих гексаголов.
Молекулярная структура UCU соответствует октаэдру с U в центре (d (UCI) −2.42 A). он немедленно гидролизуется до UOjClj( mp.578°с). 60) сульфидный состав 3S известен в мочевине. Урантрисульфид получают путем нагревания Усж в течение длительного времени с серой до 600 ° С в герметичном корпусе tube. It представляет собой глянцевую черную листовку, которая лишь медленно разлагается под действием разбавленных минеральных кислот, но легко растворяется в концентрированной хной.
По-видимому, (как и при эквивалентном использовании) US На самом деле не является сульфидом UVI, а производным полисульфида uiv. То же самое относится и к PuSj. 5!Из пероксидных производных Уран характеризуется в основном плохо растворимыми желтыми гидратами, а также пиками 1×4 4H, 0 и u04-2Hj0.Оба получают действием избытка Н * ОА на подкисленный (до рН 2) раствор уранилсульфата. 1X4-4HaO (растворимость около 5 мг / л) осаждается при комнатной температуре (80°С U04-2Ht0) из 2 м блеска.
Структура этих соединений до сих пор не установлена, но было показано, что они являются истинными пероксидами(а не продуктом комбинации H2Oj и UO).Оксо-соль надурановой кислоты — может интерпретироваться как «(HiO) 2H2UO » и (HjO) HUO*. 52) нагрев U04-4Hi0 сопровождается переходом этого гидрата в U04-2H * 0 и переходом в UOs-aq (полностью теряется вода только при 300 * C и выше).
В качестве промежуточного продукта термического разложения U04-2Hj0 описан оранжевый UjOr (он разлагается на UO3 и U04 при взаимодействии с водой).Пожалуйста, обратите внимание Ю. Л. ..О Л О и А. А. А. О、 * Тихихити И. В. Николаев Н. С. Л, время к химии. ИНИ. М 12. ИЛ、 Чтобы получить чистый U03, лучше всего нагревать пероксиды мочевины (ниже 500°C). 53) вследствие действия избыточного количества Н2О2 на производное урана в щелочной среде образуется уреат (аджурайт).
Они известны в разных формах: в соотношении числа ре-оксида к атому урана, от 1: 1 до 3: 1.Наиболее типичными производными являются Перикислота h2u05, H2UO * H uoe и HiUfO*.Последний характеризуется значениями K \ = 10 * 7 и Kt■ » 10 ″ °(по грубым оценкам), а его натриевая соль Na2U20 «- 7H » 0, практически нерастворимая в воде. Уран шестивалентный.
54) теплота образования Pa2Oj из элементов оценивается в 530 ккал / mol. By при плавлении при 700-1000°с в кислородной атмосфере, содержащей стехиометрическое количество карбоната лития или натрия, были получены вещества в составе MPaO, M3PaO <и Li7PaO§.Вероятно, не настоящая соль, а сплав оксида (IX§ 3) в воде, который полностью разлагается из-за осаждения Ra (OH)*.Горячая серная кислота значительно растворяет Пато (вероятно, образуются бесцветные ионы РАО).
55) Ra20 $, а еще лучше HF, K * [PaF? Те, которые практически не растворяются в воде, легко отделяются от такого раствора. Известны также аналогичные соли Rb, Cs и NH4.Белые паф-фториды под ними образуются только при взаимодействии элементов (образуя тепло 525 ккал / моль), ионы и Па208 нагреваются до 700°с потоком фтора. Комплекс MjPaF (М. Ли-Р-ЗС. Он также известен как отель NH<), MPaF (м-ч литий-ЗС, НХ * AG) и кристаллический гидрат паф | 2HaO. В результате пиролиза последнего при 160°С был получен белый оксофторид Pa ^ OF.
56) в нормальных условиях(mp. At 301°C) твердый, Пато образует довольно Летучий бледно-желтый хлорид PaClj при нагревании в потоке фосгена (согласно реакции PafOs-f5COCl,= 5COa4-2PaCU). Это более удобно, чтобы получить в результате взаимодействия РА (О) и SOClj. Вода PaCU (тепло, получаемое из 268 ккал / моль элементов) легко гидролизуется до HC! Примером комплексного хлорида протохния является желтый CsPaCU и[N (CH3) JjPaCl. At 170°C последнего становится [N(CH»)») пактом».RaBr5 оранжево-красного цвета (mp.317) и черный RaC (подъем выше 300°C путем разложения) также известны.
Взаимодействие между PaCl1 и 400 ° C 02 привело к образованию энергонезависимого RaOC13.RaBr8 оранжево-красного цвета (mp.317°С) также известен. Индивидуальные комплексные производные черного RaC (поднимаются выше 300°С в разложении), соответствующего оксогарида RaOG3 и типа MPaH. 57) с помощью вакуумного испарения раствора РС1 $в пары HN03, протактиния oxonaite-ПАО (Ной)»/ jHfO (1 <<л < 4) » / РА (О) 6 или MPaSC [м-КС или N (СН3)»] жидких Н * операционная система-комплекс гПа белый осадок (нет») или (с бортовым номером 03$) МПа.
Все эти соединения разлагаются даже при слабом нагревании и быстро разлагаются водой. Также разлагаются в воде, но гораздо более термостойкими являются h3pa0 (S04) 3 и HsPaOtSeOOs, которые получают выпариванием раствора Р20 в смеси концентрированной HF-серной кислоты или селеновой кислоты. Первое из этих соединений примерно при 400 ° С превращается в HPa0 (S04) j. затем в HPa02S0 ″ и только при 750°С-в P20$.И способностью к соединению Pa4 *в водной среде установлены следующие ряды: F ’ > IO〜> SOj — > SG NO,> > сы;.
68) из-за влияния HaOj на слабокислые растворы соединений протактиния образование осадков замедляется. Осадок является, в некотором смысле, пероксидным производным этого элемента. Они еще не изучены. Наиболее характерной аналитической реакцией протохния является осаждение в виде фосфатов из сильнокислых растворов. 59) пятивалентный оксид урана-фиолетовый UjO может быть получен нагреванием U3Ot с раствором KHCO в течение длительного времени(возможность схемы реакции: U30,+ 4KHC03-K4(U02 (C03), 1 + U205 + C02 + 2H20).
Судя по его магнитным свойствам, это обычный пятивалентный оксид урана (а не двойное соединение типа U02 U0).Некоторые соли, соответствующие ему, например фиолетовый Люо, также были получены путем сушки. Желтый Li3UO » и зеленый LirUOe. 60) нагревание до 250°С с частичным расщеплением кислорода под вакуумом образует промежуточный оксид U 0 0.По магнитным данным, его структура соответствует схеме u2oj-2110g.
С другой стороны, окисляя U02 при температуре около 150°C, получают промежуточный оксид u205 * U02 с предполагаемой структурой u3Og. 81) 2 формат (Мп.287 и 348. mp. Бесцветный UF, известный при 530°C), образуется в результате взаимодействия Ufa с UF4 при 100 (p) или 200°C (a).Тепло, получаемое от элемента, составляет 485 ккал / моль. Концентрированный (не безводный) HF легко растворяет UF (около 48% кислоты 5 моль / л).
Кристаллогидратный 2HUF » — 5H20 и 4HL Альф—5HjO были изолированы от полученный темно-синий раствор. Также получают много солей типа MUF. M2UFt и MjUFg(М представляет собой щелочной металл. AG или аммония). UF Ион «» представляет собой октаэдр с атомом урана в центре\ d (UF) −2.06 AJ. Нестабильная светло-желтый Электроионизационный# — БПЛА представляется, наверное, соль. 62) 5-хлорный Уран (полученный из элемента 262 ккал / моль) получают с реакцией 520 ° C.
It образован 2-мя октаэдрами, Соединенными по краю. Его коричневый порошок немедленно пиролизуется до UC1. И UC1*.Вода UCU быстро разлагается по схеме 2UC15 4-2HjO = U02C12 + UCI4 + * f4HC1.In в случае тетрахлорида фосфора oi производит соединения с композицией PCU’CU. Его структура четко соответствует формуле[PC1″] [UC1*].Напротив, в случае UCU•A1C13 возможна структура[UC14] [A1C1″].
В среде SOCl2 образовался коричневый сольват UCl3 ’SOCl2, и были получены комплексы типа M’UCU и[N (CH3) 4] 3UCI. Благодаря взаимодействию UOjCI с UCI можно получить коричневый оксо UOClj при » 400 ° C (в герметичной трубке)». он растворим в воде и некоторых органических растворителях(спирт, ацетон).Известны и оксокролид, и Огкл.
63) взаимодействие U03 и CBg4 дает черно-коричневый UBr3 и красно-коричневый UOBr. Оба являются нестабильными твердыми телами. 64) производное аркозена U (или) 6 типа, представляющее собой R (органический радикал), очень характерно для пятивалентного урана. Что лучше, чем другие, так это то, что изученный этоксид представляет собой одномерную структуру(U (OC2Hj) 6b), коричневую жидкость, дистиллированную без разложения при пониженном давлении(но очень чувствительную к влаге и воздуху).
И хлористый водород — [U (OCtH3) 4lCI. 65) число независимо известных производных Npv, Puv и Amv относительно невелико. Темно-коричневый оксид Np20 *может быть получен взаимодействием нептуния с расплавом LiC104 или нагреванием NpOj-НгО более 300 ° с. Теплота образования элемента NS оценивается в 510 ккал / моль. При нагревании до более чем 500°C он разлагается. Используя сухие смеси, композиции Li3304, Na3304, и L7EOv(добавить.54).Термическая стабильность этих соединений снижается в серии Np-Pu-Am.
Хотя простой фторид 3F3 нептуния и плутония не был получен, соответствующие комплексы mnpf (Na-Cs, NH4), Cuspufe и Rb23F7, а также многие производные оксо нептуния-NpOFj, Knp022f2, Cs2NpOCI*. Oxonntrates-зеленый Np02(с бортовым номером 03) * НПО и розовый Нп0(с бортовым номером 03)3 * Знго-интересные в различной цветовой гамме. В неводной среде синтезировали бледно-зеленую щавелевую кислоту Np02C204H * −2HtO и из Pu02(N0j)f получали плутонит общей формулы M ^ Pu ^ MNgO (M = Na, K, NH4). в случае Npv, Puv и Amv известны композитные карбонаты, такие как MChEOgCO3, а в случае америция-аналогичные фториды M’lamojfj](M-Rb, K), хлорид Cs3 [amotcl4], и гидроксид am (Oh) также известны.
66) Рентгеноструктурные исследования комплексов K [302C0S]показали, что ядерное расстояние Zr02> A12Oj> MgO).Растворимость в воде вновь осажденного Th (OH) составляет «5-10» * моль! Это хорошая идея. 70) черный Pa02 был получен путем обжига Pa2Oj в потоке водорода при 1550 * C. теплота, выделяемая из элемента, оценивается в 246 ккал / mol. In сильно кислотная среда (6-9 м HCl), Pav может быть восстановлен до Pa, v двухвалентным хромом.
71) если u02 [2 пиролизуется или UsOe выдерживается при 1500°C в потоке водорода, то получается черно-коричневый U02 (mp 2775°C).Теплота его образования и 5 элементов равна 259 ккал / моль. 72) бледно-зеленый гидроксид U (OH) 4, значение PR-1 * ID-59 равно given. It обладает довольно слабыми основными свойствами и легко окисляется до урановой кислоты под воздействием атмосферного кислорода. Тип MnUO $, соответствующий кислотной функции этого гидроксида(M-Ca, Sr. Ba) коричнево-коричневый золь получали путем раскаления соответствующих солей урана потоком водорода.
73) зеленый Np02 (Мп.2300) и желтый Pu02 (mp.2100°C) получается удобно путем обжига этих элементов нитратом или нодето. Теплота образования диоксида составляет 257 и 252 ккал / моль соответственно. Под действием N0, «при 400°С диоксид нептуния окисляется до Np «0». получить аналогичный оксид плутония не представляется возможным. * Алкмдрмн И. П. Золотев Ю. A., Usdekhm hyaynv, 1W7, M 6, 625. 74) для U (OH), зеленовато-серого Np (OH)<и зеленого Pu (OH) 4 3Fe, Mj3Fr, м ^ ф *и М * 3 «Ф»(М-одновалентный металл).
Пример CsThFi(Мп.839), CS В Тгф. (Мп 869) и CS » ThFf (Мп 980°с).В частности, ЛОФ комплекс был получен со всеми элементами из Е-см серия и (Нью-Хэмпшир-Нью-Хэмпшир)»3Ф«комплекс был получен с серией па-Ам. Рентгеноструктурные исследования кристаллов KjllFr показали, что ионы UFJ представляют собой «7 пятиугольных двойных конусов с равным расстоянием rf(UF) (рисунок XI-59)» 2.26 A.
79) при комплексообразовании с фтором am, v стабилизируются против воды: при обработке At (OH) 4 концентрированным (10-15 м) раствором фторида K образуется розовая жидкость с концентрацией Rb, Cs, NH4, Am, v, а при 02 м. твердая фаза в равновесии с ними состоит из соединения фторида Am1 v (например, Rb, AmF, 10 м RbF iln (NH4) 4AmF»15 Ai NH^). На 0eC、 Ю. В., ФВ XP и Уран Л. А. Tetraftornd. М. Атомздат, 1966.223 секунды Бледно-желтый раствор cmf15 / I CsF CmF4 с Виреном (раствор другого фторида Cm, v быстро уменьшается до Cm111).
Если нет большого избытка F’, то Am:: ионы будут рассуждать по общей схеме 3Am | V = 2AmII! + Ашу1 и частично окисленная вода. Кюрий характеризуется реакцией последнего типа: 4Cr.:: ±2П | 0 «4ct на — + — 4ч ф — ф ОА-есть монография на фтор соединения актинидов 80) в производстве, например, хлорида и бромида, обычно соответствующий оксид и уголь накаливания используются в потоке паров галогена или пара SG или A1G3.
Типа проверка системы Тетра предметное стекло(Г-хлор, бром, я), Схема ЗРаГ$4-А1=»А1Г$ -fЗРаГ4 (400°С в закрытой таре)согласно полученным урановой и ториевой четвертичного иодида, элемент непосредственного взаимодействия получается. Некоторые свойства рассматриваемых галогенидов сравниваются ниже. TSC PaC1 3bl. M2 [Th (NO.) » J, M, (Th (S04) 3], M4 lTh(SO») 4].Me [Th (S04) e].Избыток оксалата тория (NH») 2C / 04, дает легкорастворимый (NH4) 4 (Th (C / 04) 4J.
It фактически используется для отделения тория от фонаря и фонаря (при обработке монацитового песка). * Тихикб И. В. Николаев И. С. Лукаяев Ю. А. Алехьякова И. < Е. Функя фторид. М.. Издательство Академии Наук СССР. 1963.228 п. Соль тория осаждает основной карбонат Th0C03•8H20 и производит Nae [Th (CO»)»], который легко растворяется najcoj в избытке. Благодаря образованию этого комплекса, Th (OH) 4, который не растворяется в воде, также растворяется в разбавленных карбонатных растворах.
Комплексы U, v сходны по типу и общим характеристикам с аналогичными производными тория. Комплексные соединения нептуния и последующих актинидов содержат специальные монографии. 86) из обычных 3-х сульфидов производные Торна и Урана изучены лучше других, а еще хуже-NpSj и PuS2.Коричневый ThS2 (mp.1905 ° С) получается взаимодействием элементов при 500 ° С (теплота образования по ккал / моль), действием H2S при 1300°С серо-черного US » — U30.что касается воды, то ThS устойчив, но US2 медленно разлагается.
Раскаленные на воздухе, оба сульфида легко мигрируют в соответствующие оксиды. Для всех четырехвалентных элементов серии Th-Am были получены оксосульфиды типа 30s, а для урановых шипов-также известные производные типа 3Se2. 30Se, ЭТе2, Эоте. 87) ThF4 по реакции с N UF4 и A1 (BH4) 3, бесцветный Th(BH4) 4(mp 204 ″ C с разложением. И был получен темно-зеленый U (BH») 4.И то и другое похоже на соль. Кристаллическое вещество, которое растворяется в эфире, бурно взаимодействует с водой и легко разрушается, когда heated.
In в частности, при температуре около 100°C Летучий U (BH4) превращается в красновато-коричневый, Нелетучий U (BH4).3.It взорвется, когда он вступит в контакт с воздухом. Также ясно получены нептуний и плутоний. 88) в случае разорванного урана, общий тип E (C & H») циклопентадиен (X§ 2 ext.34) кристаллические производные * подвергаются пиролизу (азотная атмосфера) при 170(Th) или 250°C(U), слабо растворимы в бензоле. Бесцветный Th (CbHs) » растворяется в воде, но ярко-красный U (CsH5) 4 не взаимодействует с water.
In напротив, темно-красный(CsH3) 3UCI растворим в воде (его зеленый раствор содержит non (CjH5) 3U ’и CI’).Подобный pclopeitadienyl хлорид (C * H3) eES1 известен для тория и нептуния. Ацетилацетонат-UfCsHjOj)^также был получен в уране 89) при действии Н202 на нейтральный или слабокислый раствор корневой соли постепенно выделяется бесцветный осадок поперечного производного, состав которого изменяется по отношению к содержанию пероксидной группы, соответствующей формуле Th4 (02). насколько это возможно, пероксид не является кислым, а скорее основным по своей природе.
Это неудивительно, ведь, кроме воды, осадок обычно содержит химически связанные вещества Anon. An примером может служить пероксисомат.(Ot) / 0 (NO3) 4•IOHjO. It характеризуется серной кислотой Th (02) S04•3HjO peroxo, которая превосходит другие и очень стабильна. Подобно окислителю, производные пероксида шипов ведут себя как перекись водорода.
90) если добавить HjOf в раствор соли Puiv, жидкость сначала окрашивается в красно-коричневый цвет, а затем медленно осаждается большое количество зеленого осадка(осадок будет наиболее полным при рН = 4).Потому что с точки зрения состава и свойств этот осадок напоминает оторванное производное перекиси. Вы можете подумать, что он основан на соединении, подобном четырехвалентному плутонию.
91) если добавить H202 к раствору Np (OH) 4 в 3M HNO3, то медленно образуется серовато-фиолетовый осадок. По содержанию пероксидной группы он соответствует формуле Npj (Oa) 3 и явно образуется из 5-валентного нептуния. 92) соединение Pu111 может быть получено в растворе путем восстановления производного Pu’V различными восстановителями, особенно S02 (реакция протекает медленно при низкой температуре, но быстро прогрессирует при высокой температуре).
Аналогичный препарат соединения Np » 1 требует более мощного восстановителя (Zn +кислота).Преобразование из U, v в U1 может быть сделано только с цинком. Было показано, что охлаждение снижает Pav до Pa111. * Германик А. Д.. Мечеть бин А. И.. 3 л ФТ ФТ е и Л. М. Мефояева М. П. комплексные соединения трансурановых элементов. М.. И^ Д-Ио АН СССР. ВВТ. 223р. Под действием раствора цинковой амальгамы, содержащего этот элемент (в атмосфере водорода).
93) среди оксидов трехвалентных актинидов производные Th-Np неизвестны, а RigO3 был получен с помощью Пуо-нитей? До 1800°C в глубоком вакууме тепло, получаемое от элемента, составляет 387 ккал / моль. Что касается неустойчивости к действию окислителя, то этот оксид, по-видимому, аналогичен Cej (§ 6, дополнение 12).Соответствующий гидроксид Pu (OH) 3, под действием раствора избыточного аммиака и соли Pu111, осаждается в виде бледно — голубого осадка (PR = 2 * I0-0).Благодаря кислороду он окисляется очень быстро.
Pu, n, кислотная среда, количественно окисляется перманганатом при комнатной температуре до Pu, v и PuVI при 60°C. 94) оранжево-красный AmjO был получен путем обжига AmO2 потоком водорода. Теплота, выделяемая элементом, оценивается в 420 ккал / моль. Соответствующий гидроксид розового цвета при (OH)3 осаждается аммиаком из разбавленного раствора солей Амина. Белое Cm2Os (mp 2265°C) было получено путем держать Cm02 на 600 * C в глубоком вакууме.
95) сульфид 32Ss известен многими актинидами-Th, U, Np, Pu, Am. In помимо прямого синтеза из элементов, они приобретались и другими способами. Например, черный NpjS $был получен при 1000°С длительной обработкой NpO * паром H S + CS2 mixture. As как правило, эти сульфиды черного цвета. Коричневый Th2Ss(Мп.1950°C) и результирующая теплота черного Pu2S3 составляет 259 ккал / 256 ккал / моль соответственно. Ничтожное количество получается и у Черного CfjSj.
Интересной особенностью UjS $является проводимость полуметалла. Аналогичные композиции селенидов и теллуридов также известны для тория и urea. In кроме того, для плутония, оксольфойла Pu202S. серы производные актинидов(и lanthide. Sc. есть обзорная статьяо Y и La). 96) производные трехвалентных актинидов соли нет», СУ7, сг, ВГ -, Г. найти » легко растворяется. Производная F«, Yu, C, Oj -, PO] — слегка плавится. Ioicm * * бесцветен, Am * * розовый, а Rie * синий. Nps * бледно-фиолетовый, U * is * is red.
An важным отличием между Cm111 и Am1 «лантид» является то, что растворимость Фторсиликата значительно выше. higher. An интересным производным трехвалентного америция является плохо растворимый(Yu- * моль / л) оранжевый перкисат-Ам»(XeOeh * 40Н20. 97) комплексообразование в трехвалентном состоянии гораздо менее характерно для актинидов, чем в четырехвалентном состоянии.
Однако некоторые комплексные производные являются isolated. An пример-синий Na [Pu (S04)2]•4H20 и зеленый CsjPuCU•2H20.In в серии Np * s-Pu * 3-Am * 3 было подтверждено, что стабильность комплекса хлорида и бромида улучшена(кроме того, хлорид более стабилен, чем бромид).Napufa и NaAmF4 были получены из фторидных комплексов. 98) общий способ получения безводного Галогенида U111 и Np1 «(и PuF3) заключается в восстановлении соответствующего Галогенида EH4 путем нагревания его в потоке водорода.
Приблизительные данные) УФ * НПФ, PuFj Ан-.Фдж UCIj NpClj PuCl, AmClj Цвет………….Черный. З. З. Роза. Белый. Бесцветная Зеленая Роза; Тепло электрическое. Полисмены. ккал / моль. 。 。 。 357 ЕНП 375382213216216227249 Температура купания°С. 1430 1380 1426 1393 840 802 760760 850 Температура кипения. °С. 2300 2200 2300 5070 1700 1500 1770 1750 — УБРС NpBrj PuBrj AmBrj У1, НВК Pulj Ами) Цвет………….Нажмите на нее. Эррей. Зеленый бесцветный Херес. Колич. Зеленый, желтый Тепло электрическое. Полисмены. ккал / моль. 。 。 。 17017418815512013
Температура плавления. °С 750680767767780 * Самсонов Г. В. Р С, В. советует по химии!! МЛТ X I. 60. Плохо растворимый CmFj (mp 1406 ° С) может быть получен путем добавления HF к водному раствору соединения Cm111. Для CmClj теплота образования составляет 226 ккал / моль. Из следующих производных актинида BkFj был получен в очень небольшом количестве. BkClj и CFR(где-ки. БР. Я).
99) что касается плутония, то известны все возможные оксоганды (зеленые) типа RiOG, но производные этого типа не очень характерны для других актинидов (они дают серый ТОФ и красновато-коричневый UOCI, а количество BkOCl, CfOCI незначительно). 100) обменная реакция между UCI и NaC $ H $в Тетрагидрофуране привела к бронзовому U (CjHj) j. аналогичные «цены» известны для Pu, Am, Cm, Bk. Они все твердые и очень устойчивы к нагреву, если нет воздуха.
101) за счет взаимодействия тория с галогенидами (I, Br, CI) при определенных условиях (состав и температура) были синтезированы галогениды TNG»n TH«.Наиболее характерный Тхи известен в 2 формах. Низкая температура (а) представляет собой мягкий черный кристалл, который обладает хорошей проводимостью и выделяет водород при взаимодействии с кислотами.
При нагревании выше 600°С (в отсутствие воздуха) образуется Р-тип-золотое кристаллическое вещество с металлическим блеском, а при 860°С и выше оно вырождается по схеме 2ThIj = Thl— f Th. В качестве модели структуры «Th1» используется формула Th4 *(!) «) «( * ) *Было предложено. Теплота, выделяемая из элемента Thl $ n ThClj, оценивается в 156 n 190 ккал / моль соответственно. Попытка получить < ThF>не удалась.
102) если рассматривать сейчас производные шипа и менее, отвлекая внимание от оксидов сульфидов EO и 3s, то пока из отдельных соединений двухвалентных актинидов известен только SGHr(полученный восстановлением CfBr с потоком водорода 650°с).Однако в растворе 3-валентный новеллий является сильным окислителем(обычный потенциал в кислой среде составляет 4° — e = » No * * составляет около + 1,5 в).
То есть 2-валентное состояние является наиболее стабильным. Аналогично, Md111 и Md11 государств было показано, что примерно эквивалентно качестве признаков Менделя(обычный потенциал МД ** * * +■е= МД * J-это около −0.2 в).В Эусо растворов с трехвалентными примесями хвостатого, он сообщил, что равновесие устанавливается согласно схеме см + ЕС ** ** МВ ** 4-ЕС>.Есть также признаки того, что Am11, Es и Fm11 могут присутствовать в решении. 103) когда Th, U, Np распались. ПУ в концентрированном HCl (без доступа воздуха), остается небольшой черный осадок оксида EO(по-видимому, образующийся из-за субреакции E +Н20= 30-fH2).
Оксиды этого состава получали на сухой основе. Черные окна АТО образуются в результате восстановления AmOj водородом pr 800 ° С, и ПАО обнаруживается в поверхностном слое металла. Сульфиды 3s подобного состава известны Для плутония, урана и шипов. Все эти вещества, как и NaCI, кристаллизуются. Это также характерно для оксидов и сульфидов MgO и многих других двухвалентных металлов. С точки зрения как состава, так и структуры представляется, что двухвалентное значение актинидов в рассматриваемом соединении не вызывает никаких подозрений.
Однако, с вышеуказанным веществом, 3Н нитрида кристаллизуется в виде нацмен(Т, У. НП, несмотря на типичный валентных различий в o, n и C, то ядерной расстояние из УО Кристалл (2.46). ООН (2.44) и UC (2.48 A) почти идентичны. Очевидно, что эту ситуацию трудно совместить с идеей о том, что Уран имеет разную валентность во всех трех соединениях. Нет достаточных оснований относить его к определенной валентности, особенно если учесть металлические свойства рассматриваемого вещества, то есть наличие слабосвязанных electrons.
In вообще, вопрос о валентности актинидов в производных типа ЭК пока не может быть решен однозначно. 104) для теплоты образования ЭО-оксидов из элементов приведены следующие значения (ккал / моль): 145(Th), 135(Pa), 129(U), 115 (Pu).Ядерное расстояние<(EO) Их кристаллы равны(A): 2.60 (Th). 2.48 (Ра). 2.46(у). 2.50 (НП). 2.47 (Пу). 2.48 (Am), то есть для серии Pa-Am, практически без изменений. Точка плавления ТЖ. UO и R&D оцениваются в 1900.2500 и 1000 * C.
It следует отметить, что химическая индивидуальность некоторых из рассматриваемых оксидов бесспорна (то есть они, вероятно, являются фазой переменного состава системы E-EO1). 105) для сульфидов типа Е. аналогично, аналогичные значения ядерного расстояния определяются структурой селенида и Теллурида (а): Это пусто тыс. долларов США Юта Puspute 2.84 2.93 3JI 2.74 2.83 2.76 3.07 3.09 Теплота, производимая ThS (mp 2200°C) и US, оценивается в 100 и 73 ккал / МОКС соответственно.
Наиболее хорошо изученной в США является огнестойкость с металлическим блеском (Мп.2460°C) желтые кристаллы, растворимые в неорганических кислотах, нерастворимые в CH5COOH и щелочных растворах. Из 106) нитридов, в дополнение к типу EM, желтый ThsN4 известен для тория (thjnj, фактически не найденный для того чтобы быть Оксо-нитридом OTh | Nt) и мочевины-U » Nj. Под высоким давлением азота (больше чем 100 атмосфер), ООН можно также приобрести(согласно другим источникам, у «Н»).
Теплота образования из элементов лучше, чем у других изученных пурпурных Ун составляет 71 ккал / моль(Мп 2,5°С при давлении в НС 2850 атм).Очень не отвечает также ThN (mp 2630). NpN (2560) и PuN(2580®С).Ядерные расстояния кристаллов нитрида 3n урана, нептуния и плутония примерно одинаковы(2,45 а).Нитрид урана не вступает в реакцию с кислотами (HCl. Ч> S04).Но он легко окисляется воздухом.
При взаимодействии тория с NHj при 340°С в результате ее nmide-й (Нью-Хэмпшир) T, а при 55°С-imidejide HNThjNj. В случае тория и мочевины, nitrogaland N3T (Γ является F, СL, ВГ, I) является известной, и в случае мочевины, нитридных у (Нью-Хэмпшир) С1 тоже известно. 107) фосфида рассматриваемого элемента описывается Tbp4. ТДФ. Вверх, U5P4, UjPj. ЛМС, Np3P4. щенок. Аркады также известны(TlAz. Th «как«.РВП * УАС. UAs2.Пуас). атимоидииды (ThSb, TfoSb *.ThSbj. Usbf) и висмутиды (ThjBi * ThBij.
Уби, UjBi4.UBij).Для некоторых из приведенных соединений была найдена структура типа NaCl с расстоянием между ядрами (A): 2.92-ThP, 2.79-UP,2.82-PuP,2.98-ThAs,2.93-PuAs,3.18-UBi. 108) карбиды типа ES и Es}известны в Th, U, Np и Pu. UjCj и pu <Cj также были приобретены. Они все твердые тугоплавкие (температура плавления около 2500°C).Определена теплота образования из элементов (ккал / моль): 21-UC. 25-рис. 45-ТГК. 39-UC по структуре красно-серый UCa напоминает CaCi (рисунок X-5), а расстояние его кристалла d(CC) составляет 1,34 а(соответствует двойной связи между атомами углерода). в мелкодисперсном состоянии UCj пирофобен.
Oi реагирует с водой гораздо быстрее, чем фиолетовый UC. Желтый ThCj также постепенно разрушается водой (уже сделанной еще легче кислотой в нормальных условиях). 109) силицид 3sii, полученный для тория, урана, нептуния, плутония. Теплота образования ThSi3 и USit из элементов (mp 1700°C) составляет 42 и 31 ккал / моль соответственно. Че основным сидят, кроме того, UiSi, Щ, данные УЗИ, USij также известны.
Силикатный Уран применяется в области использования атомной энергии. 110) для боридов характерен тип соединения typesB(Э— U, Ри), эв4 (Th, U. ри). ЭВ «(м, Пу) И ППО(у, п \ я). Bornd UB » устойчив к HCl и HF(даже при кипении)» и только очень медленно взаимодействует с кипящим концентрированным HjS04. Ио легко растворяется в смеси азотной кислоты и перекиси водорода.
111) интересны дипиридицильные производные мочевины. Значение этого элемента равно нулю. U (Dipy) 4 темно-зеленые игольчатые кристаллы (полученные взаимодействием UC14 и LijDipy в Тетрагидрофуране) нерастворимы в воде и окисляются на воздухе. U (Dlpy) также известен.«Где d (UN)=» 2.10 A. попытки получить карбонил урана потерпели неудачу, и указание на возможность присутствия карбонила тория содержится только в патентной заявке(X§ 7 дол.71).
Смотрите также:
| Подгруппа скандия | Вторая группа периодической системы |
| Семейство лантанидов | Бериллий и магний |

