Оглавление:








Семейство лантанидов
- Lanthanides. It в предыдущем пункте уже отмечалось, что 14 родственных элементов, объединенных под названием лантаноидов, непосредственно примыкают к лантану. Членами последнего являются:: Черний празеодим неодим прометий Самарна Европейская гадолиния 58 2 59 2 60 2 61 2 62 2 63 2 64 2 9 8 8 8 8 8 9 Се 19 Пр 21-Й 22 РС 23 См 24 Ей 25 ГД 25 18 18 18 18 18 18 18 8 8 8 8 8 8 8 8 140.12 2 140.9077 2 144.24 2 [145] 2 150.4 2 151.96 2 157.25 2 Тербий диспрозий, гольмий, эрбий, Турий, тербий I, муртетий 65 2 66 2 67 2 68 2 69 2 70 2 71 2 8 8 8 8 8 8 8 9 ТБ ды 27 28 29 30 31 32 но ег ТШ Ыб Лу 32 18 18 18 18 18 18 18 8 8 8 8 8 8 8 8 168.9254 2 162.50 2 164.9304 2 167.26 2 168.9342 2 173.04 2 174.97 2
- Как видно из таблицы, 2 электронных слоя вне атомов почти всех лантаноидов состоят из одного типа. 3-й слой претерпевает значительные изменения, и при переходе от La к Lu число электронов увеличивается с 18 до 32. In в связи с этим все лантаноиды сходны по свойствам друг с другом и фактически являются членами «гомологического ряда» фонарей-3 В природе лантаноиды очень рассеяны, и лантан и иттрий постоянно смешиваются друг с другом.
In в случае внешнего электронного слоя изменение количества электронов в 3-м слое отражается на них достаточно сильно weakly. Людмила Фирмаль
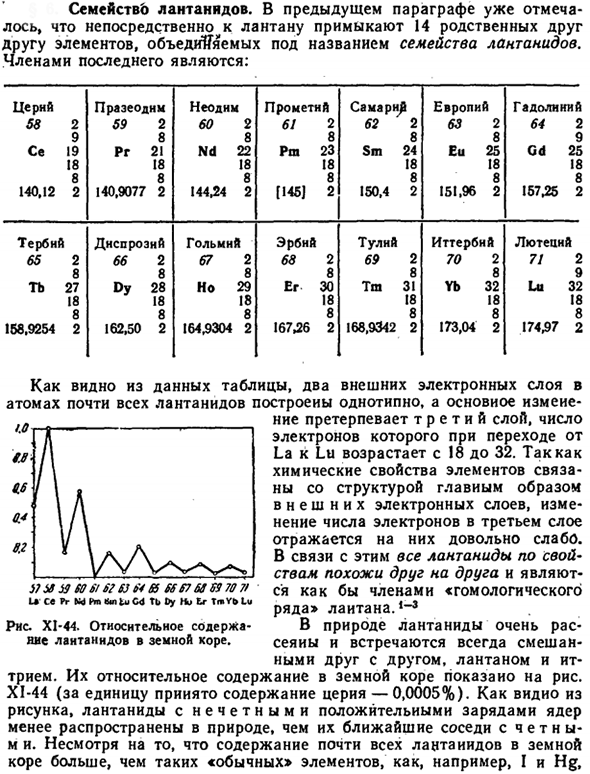
Их относительное содержание в земной коре показано на рисунке. XI-44 (берется 0,0005% содержания CE на единицу). как видно из рисунка, лантаноиды с нечетным положительным ядерным зарядом имеют четное число m и. Несмотря на то, что содержание почти всех лантаноидов в земной коре больше, чем»обычных» элементов, например, I и Hg、 РНС. XI-44.Относительное количество лантаноидов содержится в хоре Земли.
Фактическое использование их все еще относительно невелико.1. одной из причин этого является трудность отделения рассматриваемых элементов друг от друга. В свободном состоянии лантаноиды (родовое название Ln) являются типичными металлами, большинство их свойств сходны с лантаноидами. (Ce-Ei) или иттрий (Gd-Lu). как правило, они все trivalent.
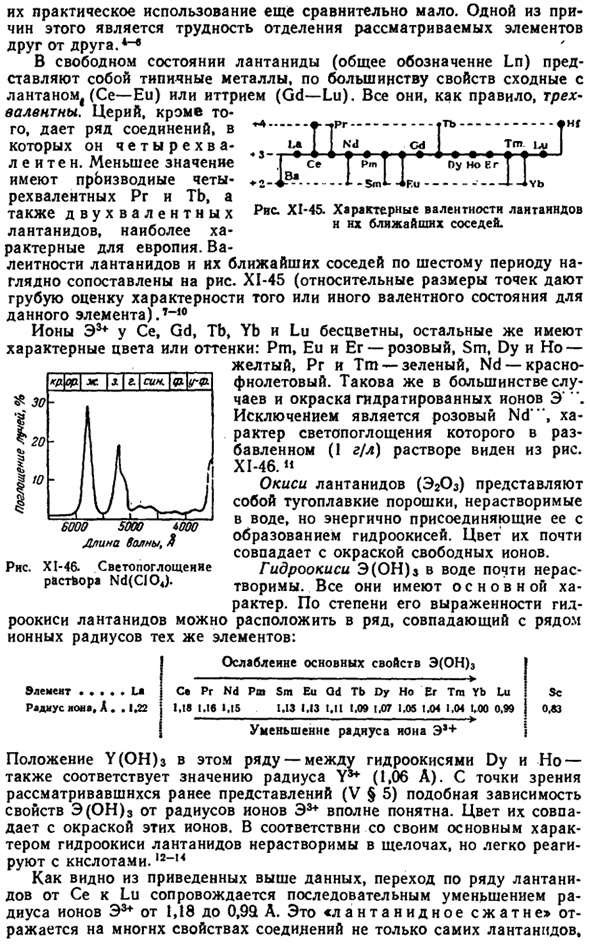
In кроме того, церий обеспечивает многие соединения, которые являются tetravalent. No менее значимыми являются производные тетрадата Pg и Tb, а также характерная валентность двухвалентного Pbc * лантана Ближайшие соседи лантаноидов, наиболее многочисленные НХ、 Для европия. Сравните валентность лантаноидов и их ближайших соседей в фазе 6 с рисунком.
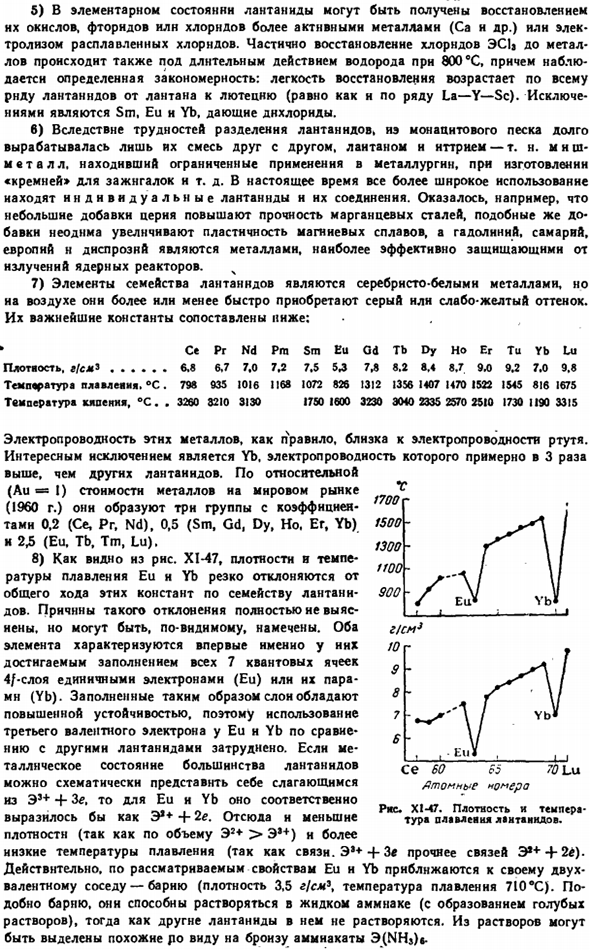
XI-45 (относительный размер точек указывает на приблизительную оценку специфичности валентного состояния конкретного элемента.)7 ″ 10 Ионы E ^Ce, Gd, Tb, Yb и Lu бесцветны, остальные имеют характерный цвет или оттенок: Pm, Ey и Er-розовый, Sm, Dy и Ho — Желтый, PR и ТМ-зеленый, НД-красно-фиолетовый. В большинстве случаев, цвет гидратированных ионов одинакова.«Исключением является розовый Nd», характер поглощения света в разбавленном (1 г / л) растворе можно увидеть из диаграммы. XI-46. ’»
Оксид лантаноида (E2O3) представляет собой огнестойкий порошок, нерастворимый в воде, но активно добавляемый с образованием гидроксидов. Их цвет почти совпадает с цветом свободных ионов. Гидроксид е (он) в воде практически нерастворим. Все они имеют базовый характер. В силу степени его выраженности гидроксиды лантаноидов могут располагаться рядами, совпадающими с числом ионных радиусов одного и того же элемента. ослабление основных свойств e (OH) 3 。11 г….. г……..
Торговая марка 4] второй Лтл «О нет е» [ Вч ♦3 6000 5000 4000 длин волн, I XI-46.Светопоглощающий раствор Nd (CI04). Фигура Предмет. •• * , Ла Rddius с отличием, А. 。 1.22 СЕ РГ НД РС 1.18 1.16 1.15 См ЕС КТ ТБ ды Э Ыб тра Лу 1.13 1.13 мл 1.09 1.07 1.05 1.04 1.04 0.99 Лоо СК 0.83 Уменьшение ионного радиуса E’ + Положение Y (OH) в этом ряду(между гидроксидами Dy и Ho) также соответствует значению радиуса (1.06 A).С точки зрения ранее рассмотренных понятий (V§ 5), аналогичная зависимость свойств Э (OH) 3 от радиуса ions ионов вполне понятна.
Их цвет совпадает с цветом этих ions. By свои основные свойства, окисоводопод лантаноида неразрешим в Алкалие, но легко реагирует с кислотами. Как видно из приведенных выше данных, переход ряда лантаноидов из Ce в Lu имеет последовательное уменьшение радиуса ионов E3 *с 1,18 до 0,9 а А. Это «сжатие лантаноидов» влияет на многие свойства соединения, а также на сам фонарь.
Но элементы, которые следуют за ними в периодической системе (Hf, Ta, Wh al.) Соли лантаноидов очень близки по свойствам к соответствующим солям La и Y. некоторые из них характеризуются другим цветом от ионов E3 +.Например, Pm (NOj) s-розовый, а PmCU-желтый. Важным отличием церия от других лантаноидов является его высокая оксидность и стабильность некоторых производных последнего.
Когда сам металл и его соли нагреваются на воздухе, образуется белый диоксид церия (Ce02).Соответствующий гидроксид Ce (OH) 4 представляет собой желтый студенистый осадок. Его основные свойства менее выражены, чем у Sc (OH). в щелочи Ce (OH) 4 практически нерастворим, а в kyoyaotto он растворяется, образуя соответствующие соли. Эон Се:; оранжевый. Соли четырехвалентного церия в растворе сильно гидролизуются.
Если в щелочной среде трехвалентный церий легко окисляется до четырехвалентного (уже с кислородом воздуха), то в кислой производной четырехвалентного церия он неустойчив и является сильным окислителем. Из-за взаимодействия Ce (OH)^с окисляемыми кислотами трехвалентная соль церия является formed. In в связи с этим количество производных известного четырехвалентного церия достаточно ограничено.
Четырехвалентная природа церия в некоторых соединениях делает этот элемент немного особенным положением среди других лантаноидов, но в целом последний проявляет себя очень близко к элементам в подгруппе скандия и естественно соответствует большинству характеристик между лантаном и скандием. В7 С5, Добавь 1) сравните год, в котором были обнаружены отдельные элементы лантаноидов, со следующим: Ce Rg Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 1804 1885 1885 1947 1879 1896 1880 1843 1886 1879 1843 1879 1878 1907
2) в зависимости от изотопного состава рассматриваемый элемент будет совершенно разным. Самый распространенный фонарь-церий-состоит из 136 (0,2) из 4 изотопов с массовым числом. 138(0.3). 140 (88,4) и 142 (11,1%).Празеодим, тербий, гольмий и Турий являются «чистыми» элементами (/4, Pr,, 5Hr. Иттербий-каждый из 7 изотопов.
3) прометий не имеет стабильных изотопов, а в земной коре содержится лишь несколько радиоактивных изотопов. Из них наиболее долговечным является<4Fsh, а наиболее распространенным-147Psh, который получают в качестве побочного продукта при эксплуатации реактора. Средняя продолжительность жизни атома первого изотопа составляет 26 лет. И 2-3,6 лет. Последний был недавно выделен из урановой руды(от 1 килограмма до 4-10 дюймов, включая только s g UTPm).
4)самый важный минерал для технологии лантаноида T. My песок и кварцевый песок в основном представляют собой смесь лантанидов (в основном Ce) фосфатов, лантана и иттрия, но содержат более или менее важные примеси, такие как ThOj, ZrO * SiOj и др. Его промышленная переработка достаточно сложна. Однако получение соединения nndnvndual лантаноида уже технически разработано. Существуют обширные монографии*по элементам этого семейства (включая Sc, Y и La) и обзорные статьи о том, как их разделить. *
Редкоземельные элементы Серебренникова В. В. Хнмня. 2 тонны Томск. Едботтомская Область. ООН-ТВ т.!。 1959 год. 584 Э. Т. Второй. 1961.801 п. Рябчиков Д. И. Тереятиев В. А.. Химик успеха, I & 55. 7 * 3.260. 5) в элементарном состоянии лантаноиды получают восстановлением оксидов, фторидов или хлоридов с более активными металлами(такими как Ca) или электролизом расплавленных хлоридов.
Частичное восстановление хлоридов / металлов ES1 происходит даже при длительном действии водорода при 800 ° C и наблюдается определенная закономерность. Весь ряд лантаноидов (и серии La-Y-Sc), от фонаря к Лютецию, увеличивает легкость уменьшения. Исключение составляют Sm, Eu и Yb.-Не думаю, что это хорошая идея, — сказал он. в) трудности при разделении Ранчин ДЕЗ, одиночных лесках, их взаимном смешении, только фонари и иттрий развивались в течение длительного времени и т. м и ш-металл.
Использование в металлургии, производстве «кремня» для зажигалок и др. ограничено. В настоящее время все чаще используются индивидуальные фонари и их соединения. Например, оказалось, что небольшое количество добавок в зернах повышает прочность марганцевой стали, а аналогичные добавки в неодиме повышают пластичность магниевых сплавов, а гадолиний, самарий, европий и диспрозий являются металлами, которые наиболее эффективно защищают от излучения ядерных реакторов. х 7) элемент семейства лантана-серебристо-белый металл, но в воздухе он сразу приобретает более или менее серый или слабый желтый оттенок.
Наиболее важные константы сравниваются с теми же самыми: Се РГ НД ПРН см но ГД ТБ ды но ЕР ти Ыб Лу Плотность. tlcM3…… 6.8 6.7 7.0 7.2 7.5 53 7.8 8.2 8.4 8.7 9л 9.2, 7.0 9.8 Температура плавления. °C 798935 1016 1168 1072 826 1312 1356 1407 1470 1522 1545 816 1675 Ияпення температура,°С. 。 3260 8210 31E0 1750 1600 3230 E040 2335 2570 2510 1730 1190 3315 Проводимость этих металлов обычно близка к проводимости mercury.
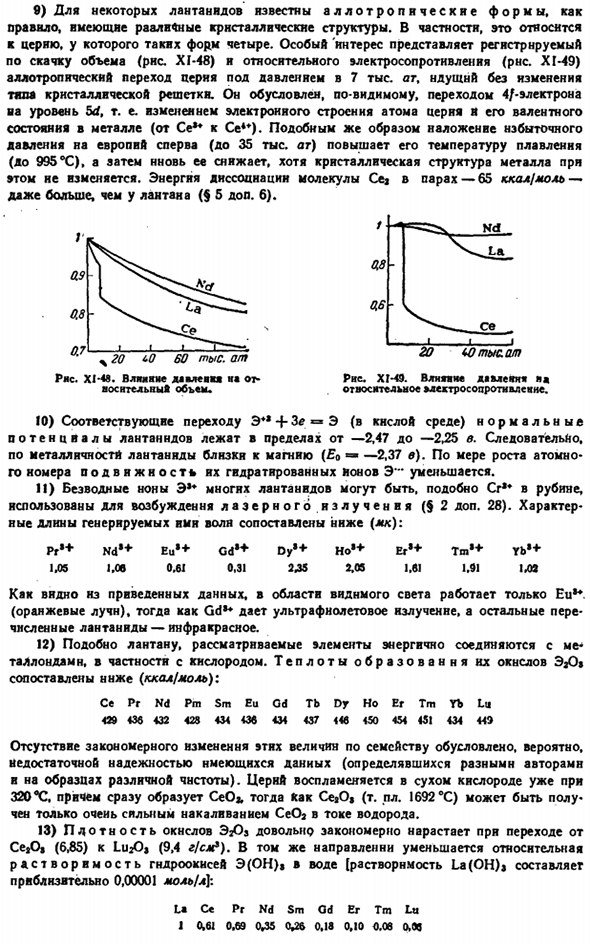
An интересным исключением является Yb, проводимость которого примерно в 3 раза выше, чем у других ланчей. По относительной стоимости металлов на мировом рынке (Au = I) (1960) они имеют коэффициент 0,2 (Ce, Pr, Nd), 0,5 (Sm, Gd, Dy, Ho). Er, Yb) и образуют 3 группы по 2JS(Eu. ТБ, ТМ, Лу). 8)Как видно из рисунка XI-47, плотность и температура плавления Ey и Yb в значительной степени находятся вне общего хода этих констант семейства ranchind. Причины этого отклонения до конца не изучены.
Но, в некотором смысле, она может быть очерчена. Оба элемента впервые характеризуются достижимым заполнением всех 4 / слоя из 7 квантовых ячеек одним электроном (Eu) или парой из них(Yb).Поскольку слои, заполненные таким образом, имеют улучшенную стабильность, использование EI и YB 3-валентных электронов затруднено по сравнению с другими лантаноидами.
Если вы можете примерно представить, что металлическое состояние большинства запусков состоит из E5 + + Ze. In в этом случае для нее и Yb он представлен как E1 * — + — 2e. следовательно, низкая плотность (для E2 * > E, + объем) и низкая температура плавления(для связи. Е* + + 3 *сильнее связывания е * + 4-2 г). фактически, согласно рассматриваемым свойствам, Eu и Yb приближаются к барию (плотность 3,5 г / см3, температура плавления 7°с), рядом с бивалентом.
Как и амбары, их можно растворить в жидком аммиаке(с образованием синего раствора), но другие фонари в нем не растворяются. Раствор ИЭ может выделять аммиак-3 (NHs) t, подобный бронзе. ce so S3 70 Lu атомный номер Ряса. Си-47.Плотность и температура плавления Ланкидов. 9) в некотором лантане, аллотроп с кристаллической кристаллической структурой обыкновенно known.
In в частности, это относится к CE. В CE существует 4 таких формата. Особый интерес представляет скачок объема под давлением 7000 атмосфер (рис. XI-48) и относительное электрическое сопротивление (rns), которые протекают без изменения типа кристаллической решетки. XI-49) является аллотропным переходом CE, который записан ниже. Это, очевидно, вызвано переходом от уровня 4 /электрон к уровню bd, то есть изменением электронной структуры атома церия и валентного состояния металла(от Ce до Ce4).Точно так же, если вы оказываете чрезмерное давление на европий(первоначально до 35 000 Ат.),
Температура плавления (до 995°с) повышается, а затем снова падает, но кристаллическая структура металла не меняется. Энергия диссоциации молекул Ccj в паре-65 ккал / моль-даже выше, чем энергия диссоциации лантана(§ 5 add.6). Рисунок Х1-4 с. Dvleikya эффект Си-49 от рисунка. В середине дня лег-ИД Объем карьеры. Относительная мехатроника.
10) переход E + Ze = E стандартный потенциал соответствующего Лантана (в кислой среде) находится в диапазоне от-2,47 до-2,25 e. As в результате металличность фонаря приближается к магнию (E0 −2.37 5). по мере увеличения атомного числа подвижность e гидратированных ионов уменьшается. 11) многие безводные не * * е * * лантиды, такие как Рубин Cr, могут быть использованы для возбуждения лазерного излучения (§ 2add.28).
Сравните характерные длины волн, которые они генерируют, со следующими (*/s): Ргя + ND, + EU $ * GD «+ DY ’+ ho »+ TM «+ YB» + 1.05 1.06 0.61 0.31 2 35 2.05 1.61 1.91 Вт Как видно из приведенных выше данных, только ее**(оранжевый луч) работает в области видимого света, Gd » * излучает ультрафиолетовое излучение, а остальные фонари в списке излучают инфракрасное излучение. 12) подобно фонарю, рассматриваемый элемент энергетически сочетается с металлоидами, особенно с кислородом.
Теплота образования их оксидов Е ^ О сравнивается со следующей (КЛ / моль): Се РГ НД ПМ См ЕС ОД Че Djr По Хо Эр ТМ ИБ Лу 429436432432428434436 ″ 443744645045445! Четыреста тридцать четыре тысячи четыреста сорок девять Отсутствие периодических изменений этих величин во всем семействе, вероятно, связано с недостаточной достоверностью имеющихся данных (она определяется разными авторами на разных образцах чистоты).
CE уже воспламеняется при 320°C сухим кислородом и сразу же образует CeO*, но CeiO (mp 1692°C) получается только при очень сильном свечении CeOj в потоке водорода. 13) плотность o2o3 окнслов очень естественно возрастает при переходе от Ce * 0″(6,85) к LujO} (9,4 г / см*). в этом же направлении относительная растворимость гидроксида E (OH) в»растворимости в воде[La (OH)» составляет приблизительно 0,00001 моль / л. У Се Пр НД См ОД Эр ТМ Лу Я 0.61 0.69 0″35 0″26 0.18 0.10 0.06 0.96
Согласно другим расчетам, величина-логарифм PR гидроксида E (OH), которая учитывается, равна: Ла Се РГ НД РСЧ См ЕС ОД ТБ Ды Hoer ТМ Ыб Лу 18.9 20.1 21.1 21 21.8 22.1 22.5 22.7 22.9 23.1 23.2 23.3 23.5 23.6 23.7 7 и путем нагревания в течение длительного времени до 200 ° С их суспензии. Раствор NaOH, эти гидроксиды получают в кристаллическом состоянии. Известные тепловые значения от образования таких кристаллических оксидов воды из элементов сравниваются ниже(Хал / моль): Пр (О) С НД (о) J в СРА (ой) » од (О) С Д. Ю. <О) Е Триста шестьдесят один триллион триста шестьдесят миллиардов триста пятьдесят девять миллионов триста пятьдесят восемь тысяч триста пятьдесят шесть В отличие от оксидов, которые уже заметно медленнее, наблюдаются периодические изменения величины.
При уменьшении радиуса e ’Иона ускоряется дегидратация рассматриваемого гидроксида E (OH).Производные типа Меоа (M-LI или Na), формально соответствующие кислотной функции гидроксида, были получены сухим методом из многих лантанов. Гидроокиси лантаноидов (и СК. Есть обзорная статья по Y и La). 14) какой-то фонарь (пр. НД, См, Б, Ды. Хо, Эр. Для Lu) было установлено наличие нестабильных латеральных производных.
Основной тип -«».По-видимому. 3j04-2Hj0 и e * 05-2Ng0.В В целом при переходе от La к Lu легкость образования перекиси возрастает. 15) соли Галогенида лантаноида (например), фторид слабо растворим в воде. Теплота образования CeFa и PrFs составляет 410 и 402 ккал / моль соответственно. Практическое значение имеет главным образом CeFa, который используется в производстве угля для дуговых ламп (их добавление резко увеличивает яркость свечения).При значительном повышении температуры фторид 3FS сначала переходит в мягкое покрытие 30F, а затем в соответствующее oxide. In в расплаве фторид щелочного металла образует комплекс типа Mj [3Fe], стабильность которого возрастает с уменьшением радиуса 3 и увеличением радиуса M. также получен состав na3fa комплексного фторида.
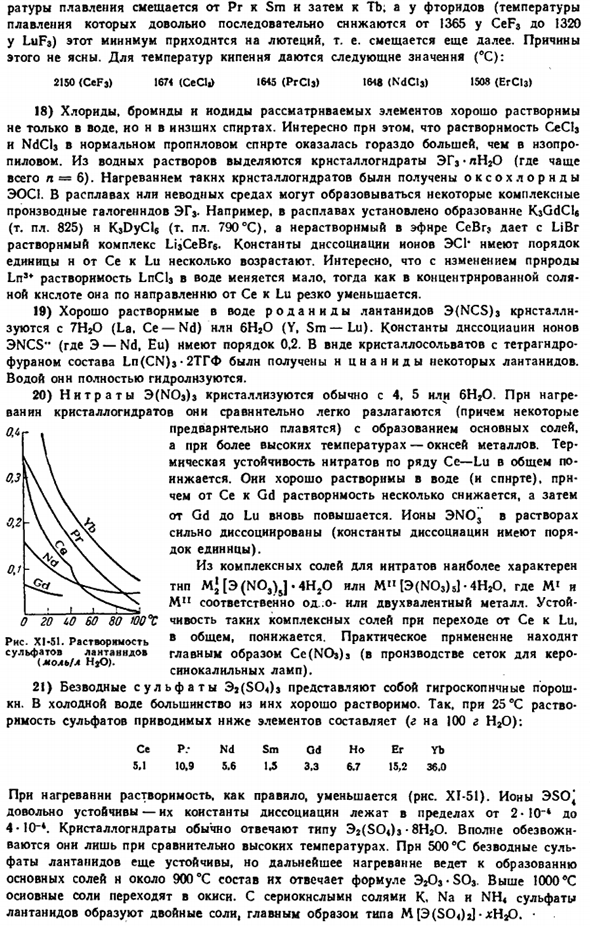
Для константы диссоциации Ионов GdF приведено значение L0-4.Есть обзорная статья о фториде лантаноидов. gb) сравните значения этих плотов ниже Ла РГ РГХ ЕС й но ту лу Уик. XI-50.Температура пламени Формирование желчного пузыря MH (ккал / моль); Ла С! 256 ВГ 221 1 157 1 ЕС ГД 240 203 148 TH 237, 200, 147 Хоер 233229191 142 140 2291901138 ТМ Ыб 230194130 Ла 226 СК 21560108 Се 253218156 РГ 252215153 НД см 246 244 212 207 150 149 Ды 236197144 205 152 Сто тридцать три
Как видно из приведенных выше данных, в целом по мере уменьшения радиуса лантана теплота образования уменьшается достаточно последовательно. Структура (пары) молекул ЭГ была установлена на примере неодима. Они имеют в центре Атом Nd, 2.22 (F), 2.58(C! А) Nd-T-плоский треугольник с ядерным расстоянием. 2.72 (Br) и 2.94 (1). 17) представляет интерес специфическое поведение изменения температуры плавления галогенового гена ЭГ.
При движении по X1-50, Серия 1-Br-CI, минимальная температура Ахсельруд Н. в. успех, хкш. 1963, № 7.800.Банк Л. Р.. Успех * химия, 1971, м. 6, 945. Точка плавления смещается от ПР с см, а потом к туберкулезу. С другой стороны, в случае фторидов(температура плавления значительно снижается с CeF3 1365 до LuF3 1320) этот минимум соответствует Лютецию. Это будет смещаться дальше. Причина этого не ясна.
Ниже приведены значения температуры кипения (°C: 2150 (CeFj) 1674 (CeCli) 1645 (PrClj) 164®(NdClj) 1508 (EGC1z) 18) хлориды, бромиды и йодиды рассматриваемых элементов легко растворяются не только в воде, но и в низших спиртах. Интересно, что оказалось, что растворимость CeClj и NdClj в нормальном пропиниловом спирте была намного больше, чем у нзопропилового спирта.
Кристаллогидрат EG3•LH20 (в большинстве случаев n-6) отделяют от водного раствора solution. By нагревая такие кристаллогидраты, получали оксо-хлориды ЭОС!。В сложной или неводной среде могут образовываться некоторые комплексные производные Галогенида EH3.Например, в расплаве установлено образование KjGdCU (mp 825) и KjDyCle (mp 790°C). Центром нерастворим в эфире, она производит растворимые LijCeBre комплексов С Либр.
Константа диссоциации Иона ES1 *находится в порядке 1 и незначительно возрастает от Ce до Lu. Интересно, что при изменении свойств Ln3 *растворимость LnClj в воде почти не изменяется, а в концентрированной соляной кислоте резко снижается в направлении от Ce к Lu. 19) лантанид 3 (NCS) J водорастворимый тиоцианат, 7НгО (la. It кристаллизуется при 6н20 (Y, SM-Lu) и Се — ND (се-ND). Константа dnssociaiin ионов 3NCS (где-Nd, Eu) имеет порядок 0.2.In композиция Ln (CN)j-2Tr , некоторые лантаноиды занинида были также получены в виде кристаллических сольватов, содержащих тетрантрон.
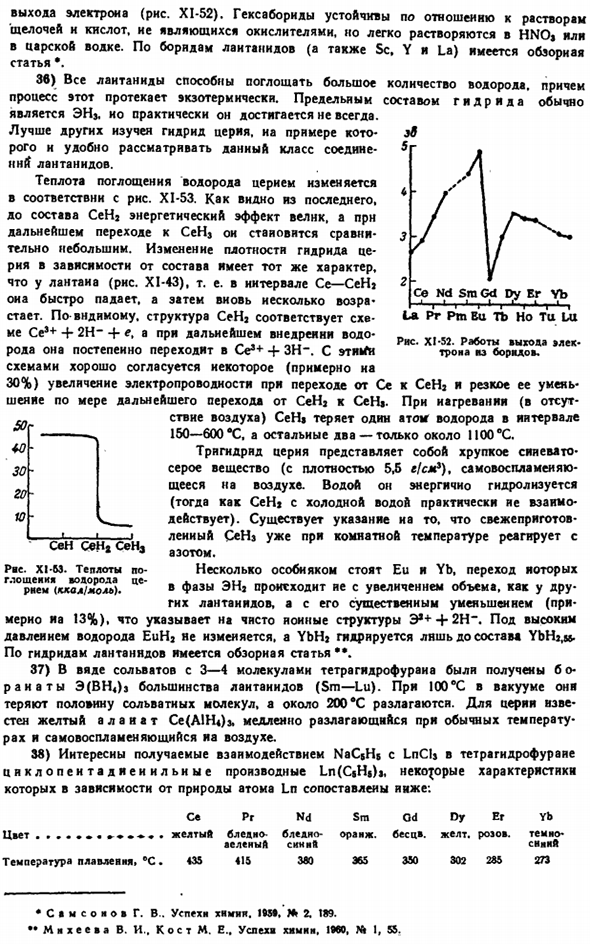
- 20) нитрат 3 (N0j) » обычно кристаллизуется при 4,5 или 6H * 0.При нагревании кристаллический гидрат разлагается относительно легко Образование основных солей (предварительно расплавленных), а при более высоких температурах-оксидов металлов. Термическая устойчивость нитратов в СЕ — серии Lu является, как правило, деградирует. Они хорошо растворяются в воде (и спирте), немного снижая свою растворимость от Ce до Gd и снова поднимаясь от Gd до Lu. Ионы 3N0 сильно диссоциируют в растворе(константа диссоциации порядка 1).
Среди комплексных солей нитратов наиболее характерным является Mn [E (NOs) J * 4НаО или М » 13 (n0.) 5J * 4HJO. Где » M » и » М » — металлы с 1 или 2 валентностями соответственно. Устой-О 20 М 60 80 10°С. Особенность такого изолятов при переходе от Се к Lu. Диаграмма XI-51. Растворимость < °>уменьшается. Практическое применение в основном находят в сернокислых литаврах Ce (NO») s (производство сеток для ксенокалькамп). В So при 25°С растворимость сульфата перечисленных ниже элементов(в расчете на г / ГГО 100 г): П. Се — НД См QD А Э Ыб 5.6 5.1 10.9 1.9 3.3 6.7 15.2 36.0
21) безводный сульфат 3s (S04) является гигроскопичным powder. Людмила Фирмаль
При нагревании растворимость имеет тенденцию к снижению (рис. XI-51). Ионы 3S0j очень стабильны-диапазон констант диссоциации составляет 2-10-4-4•10 4.Кристаллогидрат обычно соответствует типу 32 (S04) j•8Н * 0.It полностью обезвоживается только при относительно высокой температуре. Безводный сульфат лантаноида все еще стабилен, но при дальнейшем нагревании он образует основную соль примерно при 900°С. Его состав соответствует формуле 3jOj-SOj. В основном соль типа m [3 (SO») j] * xHaO.
22) карбонат (со») почти нерастворим в воде, относительная растворимость (2,6 * 10 ″ 4 моль широты!25°C (L в единицах) является самым маленьким в гадолинии. Ла-Се пр НД см ГД ды Э Б. 1 0.81 0.74 0.88 0.62 0.56 0.65 0А \ 0.90 С карбонатами щелочных металлов могут образовываться комплексы, наиболее распространенным типом которых является M [E (CO *) a]•6HjO (M-Na, K).При избытке щелочных карбонатов эти соли почти нерастворимы и гидролитически разлагаются с водой. Есть признаки этого.
Термическая стабильность карбоната с увеличением атомного номера фонаря не уменьшается, а увеличивается. 23) их иодат 3 (10″) «(лантан с растворимостью нодата 9,1-л (в единицах Н4 моль / л при 25°С) также имеет процесс своеобразного изменения растворимости карбоната Лантана. Ла-Се Пр НД См ГД Ды Э Ыб 1 0.98 0 37 0.80 0.77 0.54 0.65 0.69 0.76 Иттрий с растворимостью 0,60 близок к Gd и Dy.
24) среди солей лантаноидов и других неорганических кислот особый интерес представляет молибдиновая кислота гадолиния, кристаллы которой могут мгновенно перемещаться из одной стабильной внутренней структуры в другую стабильную внутреннюю структуру с добавлением слабых внешних воздействий (световое давление, напряжение 100 в).
Этот переход является обратимым. То есть, когда примененный эффект инвертируется, исходная структура мгновенно восстанавливается. До сих пор Wielkalieo расширила возможности практического применения молибдена гадолиния за счет свойств упругости стали (в конструкции некоторых оптических приборов, компьютеров и др.). 25) оксалат E2 (C20″)$очень важен для химии ranchine Des. Из-за низкой растворимости в воде, разбавленная кислота в растворе (NH ^ aCjO *используется для отделения вдовы лантана от thorium.
In 100 см * воды при нормальных условиях растворяется только 0,04 мг Cet (CsO«), а в 100 см’ серной кислоты-160 мг. Согласно серии Ce-Lu, растворимость оксалатов в воде немножко увеличена, и в разбавленном H2SO4 она decreases. As в случае карбонатов термическая стабильность оксалатов, по-видимому, возрастает с увеличением числа атомов лантана. 26) среди ланциндов очень много комплексных производных различных органических кислот.
Некоторые из них, например, Трилон А и в(x§ 2 доб.88) и комплекс используется для разделения ranchinedes. Для комплексных соединений этих элементов существуют обзоры и специальные монографии**. 27) состав 3S, 3js4 и SJS сульфид * полисульфид 32S4 и 3a0js оксосульфид известны в большинстве ранхиндов. Самый простой способ получения производного серы-синтезировать его непосредственно из элемента (это делается в герметичных ампулах при низких температурах).
Оксосульфид получают спеканием близкой смеси состава 23 * 0 «+ 3тс». Для Pr и Nd (и La) также были получены оксосульфиды ErO3Eg. 28) наиболее часто изучаются производные сульфида церия. Результирующая теплота желтого CeS (mp 2450), черного Ce $ S4 (mp 2050) и красного CeaS *(mp 1890°C) составит fl8, 422 N 300 ккал / моль (в расчете) на 1 грамм атомов серы соответственно 118, 105 и 100 ккал).
Черно-коричневый Ce» S » разлагается по меньшей мере при 720°С, а коричневый Ce ^ OiS плавится при 1950°С. * Терентьев » Е. А.. Успех-хямян. 1957, Дж * 9.1007. • * Яцимирская К. Б.. Костромская Н. А.. Щека 3. А. Д Айдек о Н. К. Крис Е. Е., Ермоленко В. N. It известен комплексными соединениями редкоземельных элементов. Кошечка. Наукова думка, 1966,493 секунды Все производные сульфида церия в нормальных условиях устойчивы к воздействию воздуха и воды, но легко разрушаются кислотами.
Стабильный CejS, меньше других, » производит осадок серы при разложении кислотой, подтверждая природу его полисульфидов. 29) свойства другого сульфида лантана derivatives. In в целом он напоминает свойства соответствующих производных церия. Например, теплота образования коричневого NdjSj (mp 2200 ° C) составляет 265 ккал / моль. Некоторые сульфидные производные известны в нескольких различных формах. Например. DysSs (mp 1490°C) красновато-коричневые, черные или зеленые. 30) моносульфид церия кристаллизуется в соответствии с типом NaCl(d (CeS)■■2.88 A]и имеет металлическую проводимость.
Аналогичные производные CeSe [d = 2.99], CeTe [d = 3.17 A]и Pr и Nd с ядерным расстоянием менее 0.02 и 0.04 A соответственно. Некоторые сульфиды и селениды этих элементов (например, Gd3Sei) обладают полупроводниковыми свойствами. Растворимый тигель особенно подходит для растворения активных металлов (в инертной атмосфере). 31) черный нитрид 3 N образуется в результате прямого соединения лантаноидов и азота при температуре около 1000°С(теплота образования CeN и TmN составляет 78 и 75 ккал / моль соответственно).
Благодаря своим свойствам ояэ очень близок к нитридам подрода скандия и кристаллизуется для каждого лантана подобно хлориду натрия со следующим ядерным расстоянием E-N (A).): Ce Pr Nd Sm Eu Qd Tb Dy Ho Er Tm Yb Lu 2.51 2.58 2.58 2.52&51 2.50 2.48 2.45 2.44 2.42 2.40 2J9 2Л Внутренняя структура большинства из них соответствует схеме Е * + — Е Н* -.Исключение составляет CeN, где рассматривается схема Ce4 * + N * — + C.
Интересна различная летучесть отдельных нитридов. Таким образом, YbN сублимируется при 1400, в то время как SmN не сублимируется даже при 1600. 3*) изучение аналогов нитридов является четным worse. It также соответствует формуле EC (X-P, A-Z, Sb, Bi) и следует за ядерной диссоциацией (A) i ГП РГ НД См п 2.93 2.93 2.9! 2.88 АА 3.03 3.00 2.96 2.96 ШБ 3.20 3.18 3.15 8.14 В| 3J4 3.22 3.21 3.18 Для LuSb д, фляги 3.03 А. фосфор медленно разлагается во влажном воздухе с выделением фосфина.
33) желтые (или черные) карбиды типа ES2 известны почти для всех фонарей. Лачи (§б добавить.32), они имеют структуру CaCt < f (CC) около 1.28 A и гидролизуются водой, обычно ацетилен образует смесь общих углеводородов. Для элементов от Ce до Ho также были получены карбиды типа 3jSj. А от см до Лу (кроме нее) — введите ЭЗС. 34) силицид 3sia-типа, большинство лантаноидов(Ce. It известен в русском языке (пр, НД, см, ЕС, ГД, ды).
Они представляют собой кристаллические вещества, плавящиеся при температуре около 1500°C. As для CE также описаны щели типов CesSi, Ce2Si и C ^ Sij. Существует обзорная статья о Лантаноидах CeSI (и Sc, Y, La). 35) бориды типов EV и EV4 известны для всех лантаноидов (ядра Pro и EuB4), а также типы DY, Ho, Er, Tm и Lu EVCS. ПРБ, ЦКБ, YbB3, и LuBj также перечислены.
Для наиболее хорошо изученного гексагидрата температура плавления порядка 2100-2500°С равна norm. An интересный способ изменить характеристику работ «Самсонов Г. В. успех „Химки“. 1962, N » 12. Одна тысяча четыреста семьдесят три、 Электронный выход(РНС. XI-52).Гексаборид устойчив к щелочным и кислотным растворам, которые не являются окислителями, но легко растворимы в HNO или царской водке.
Фонарь боридный (и СК. Есть обзорная статья * по Y и La). 36) весь лантан может поглощать большое количество водорода, этот процесс экзотермичен. Обычно предел гидридного состава равен HEY, но на практике это не всегда достигается. Гидрид церия изучен лучше других, и на его примере удобно рассматривать соединения лантана этого класса. Теплота поглощения водорода церием изменяется в соответствии с рисунком X1-53.As как видно из последнего, фронт композиции CeH2 обладает большим энергетическим эффектом, который относительно невелик при дальнейшем переходе к CeHj.
Изменение плотности гидрида церия в зависимости от состава обусловлено образованием лантана(rns. XI-43) с теми же характеристиками. То есть он быстро падает в интервалах Ce-CeHj и снова незначительно увеличивается. По-видимому, Structure3 структура схемы се + +2Н — Fe соответствует водороду, чтобы в дальнейшем постепенно вводить се3 * — Fзн-в преобразованный. Некоторые из них хорошо согласуются с этими схемами (примерно 30%) увеличение электропроводности при переходе от Ce к CeHj и резкое снижение при дальнейшем переходе от CeHj к СеЩ.
При нагревании (в отсутствие воздуха) CeH теряет 150-600 * C в диапазоне 1 атома водорода. Другие 2-это около 1100VC. Тригидрат церия представляет собой хрупкое голубовато-серое вещество (оно имеет плотность 5,5 э / см и самовоспламеняется в воздухе). air. It интенсивно гидролизуется в воде (CeH>фактически взаимодействует с холодной водой).Температура реагирует с азотом. ЕС и Yb несколько разошлись, и переход в фазу EN3 происходит с увеличением объема, как и в других лантидах, а его значительное уменьшение (около 13%) указывает на чистую ионную структуру E * + + 2H〜.
Под высоким давлением водорода EuHje изменится, но YbHj будет гидрироваться только в составе YbHj»есть обзорная статья по гидриду лантана. 37) б раны e (ЧД) и лантана (Sm_Lu) были получены в диапазоне от сольваты, содержащие 3-4 молекулы tetrandomeric. При 100°C в вакууме, половина молекулы сольватного теряется и разлагается при температуре около 200°C. В случае СЕ, желтый Ала и Т CE (Альфа) J не известно. Он разлагается медленно при нормальной температуре и собственной воспламеняется в воздухе.
38) интересным является циклопеитиадиальное производное (C | Hsh) Ln, полученное взаимодействием с LnClj в Nachs и тетрагидрофурии. В зависимости от природы атома Ln некоторые характеристики сравниваются ниже. Диаграмма XI-52.Выход работы от bordoffelectronic. Се НД Смгд ды Э Ыб » я «я 1″я. 1 я 1, Ла пиар ПМ Бу ТБ Хо ту Ла ЦВЗ CeHjCeHj Рие. XI-M. теплота поглощения водорода (ккал / моль) церием. Се Цвет. ……Желтый Точка плавления,®С.
Четыреста тридцать пять Ди Эр желтый, Роу. Триста две тысячи двести восемьдесят пять Yb РГ Nd Брэди-сиия ЗАО Oraizh см. Триста шестьдесят пять ОД бесцветный Триста пятьдесят Бледная Елена скажи-СМЭВ 273. Четыреста пятнадцать * Самсонов Г. В. химия успеха. ВВТ. М. 2.189. * * Михеева В. И. Костев М. Е. успехи в химии, I960, Nk I, 55. Примечательно, что температура плавления последовательно уменьшается по мере увеличения радиуса Ln *decreases.
In вакуум, соединение сублимируется при температуре около 200°C. At в то же время Золотая производная от пня евро, похожая по составу, неустойчива в вакууме, который уже превышает 100 градусов. Sv) в щелочной среде производное трехвалентного церия является восстановителем; например, свободные металлы отделяются от соединений Hg и Ag.
Напротив того. Перенос Ce в Ce:: в водной среде возможен только под действием сильного окислителя, например: Poa. Нм используется в аналитической химии для нахождения церия, так как это превращение связано с изменением цвета раствора (от бесцветного до оранжевого). 40) потенциал перехода Ce + 4 + * = Ce +§сильно зависит от характера acid.
At нормальные концентрации,+ 1.70 (в NSLF), 1.60 (в HN’OJ), на 1.44( в H2SO).Это различие обусловлено влиянием комплексообразования с Се4 *и соответствующими анионами (VII§ 5 add.15).Так как склонность комплексных соединений входить во внутренний домен CI07 является наименьшей, то не-Ce:: окислительная активность наиболее точно передает потенциал перхлоратной среды.
41) в случае перехода Pr * 4 + e = Pr* потенциал окисления оценивается в+2,9 В, а в случае TV4 + e, B, » i TV должен быть таким же или выше. Ионы пр::: ТБ:: энергично окисляется вода по схеме: 4Э:: + 2HaO-4Е «+ 4Н ’+ ОА. 42) белый диоксид церия желтеет при нагревании и снова желтеет при охлаждении. теплота образования элемента ns составляет 260 ккал / моль и плавится только при температуре около 2700°C (давление Оа).
Сильно кальцинированный Сеоа нерастворим в HCl и HNOj, но растворим в has04.Диоксид церия используется для шлифования оптического стекла. Введение серийных (и европейских) очков в состав самих очков защитит глаза от слишком яркого освещения. Стекло, содержащее церий, не темнеет под воздействием излучения из реактора и задерживает его в значительной части.
43) коричневый черный Prgo, PrzO » prn 500 ° C 100 at. It получается путем поддержания кислорода под давлением. Тепло, получаемое от элемента, составляет 240 ккал / моль. При давлении кислорода 1 атм он разлагается примерно при 400°С. малоизученный Тоа был получен окислением TbaOj атомарным кислородом pr 450 ° С. Для обоих элементов известны несколько фаз промежуточного состава между 320 и EOa(например, темно-коричневый Tb4Oy или коричневато-черный Pr * Op, образующийся при нагревании этих металлов на воздухе).
44) благодаря легкому окислению кислородом в атмосфере Ce (OH) 3 образуется промежуточный продукт, являющийся производным Ce(OH) e и Ce (OH)+, в цвете от фиолетового до темно-синего. Первый гидрат играет роль основания, второй-это acid. It то же самое. Возможно, природа синего смешанного оксида CE-1000 образовалась в результате взаимодействия Сеоа с водородом при 407°C 45) из кислого раствора Ce (OH) 4 начинает осаждаться уже вблизи рН 2.
Для его продукта растворимости приведено значение порядка 10-je. Некоторые методы отделения Ce от других лантаноидов основаны на слабости основных свойств Ce (OH) 4.Например, если раствор смеси сульфата Ce (S04) разбавить водой, то он подвергнется гидролизу и hydrolysis. As в результате большая часть CE осаждается, а остальные лантаноиды (N частей Ce) растворяются. 46) n-очень слабая степень, но, тем не менее, Ce (OH) 4 также проявляет кислую природу.
Некоторые центры. Пример: NaaCeOa. It был изолирован в твердом состоянии. Интересно, спекания CeOa и Bao или SRO дает соответствующее генеральный директор*, НО КоАП не взаимодействует с CeOa. Нагревая смесь NaaOa и Tb40? NaaTbOj был получен с потоком кислорода. NaaPrOj также известен.
47) Ce (OH) a окисляется кислородом до Ce(OH) 4, в то время как красно-оранжевый гидропероксид-Ce (OH) образуется под действием NaOa. Эта реакция очень чувствительна и относится к открытию cerium. In избыток H20j-n может образовываться на светлых сшитых производных вплоть до Ce (UN) 4. 48) радиус Иона Ce4 * составляет 1,02 А. из его Галоидных солей известен только бесцветный фторид-CeF4.Это кристаллическое вещество, полученное нагреванием CeF $до 400°C с потоком фтора и почти нерастворимое в воде.
Давление диссоциации по схеме 2CeF » * * 2cefs Ft составляет 500 мм С и менее 0,5 мм рт. ст. С водородом этот фтор уже восстанавливается до CeFj при 300°C (то есть намного легче, чем CeOa). 40) бесцветный ТБФ был получен путем воздействия фтора на Тбфж при температуре около 400°С. теплота образования от элемента составляет 478 ккал / mol. It почти нерастворим в воде и реагирует только медленно с разбавленными кислотами.
Потому что PrFj не взаимодействует с фтором. PrF был получен косвенно путем извлечения натрия из NajPrF®с использованием жидкого фтористого водорода (растворенного в NaHFt) в атмосфере фтора. Как ТБФ.-Оно бесцветное, — сказал он. 50) фторирование PrFj в присутствии фторида щелочного металла приводит к образованию соединения фторида 4-валентного празеодима.
MjPrFe Н MaPrF7(м НС-Р-ЗС).Последние 2 типа бесцветных комплексов со щелочным фторидом (Na-Cs) известны в виде четырехвалентных зерен. Интересно, что производное калия последнего типа оказалось гораздо более нестабильным, чем остальные. Для тербия в воздухе был получен бесцветный и стабильный комплекс csjtbfy (однако получить Cs»TbF*»не удалось).
При фторировании смеси NdF3 и DyF с избытком CsF частичное образование сложных фторидов Ndlv и DyIV также происходит четко, но возможно его разделение. 51) простой четырехвалентный хлорид лантана не был получен. Однако сольваты HsCeCl *, содержащие 4 молекулы диоксана, были выделены в виде оранжевых кристаллов. Эта кислота и соли с пиридином и тетраметиламмонием также являются known.
In последнее исследование, rf (CeCl)= 2.55 A было indicated. It удалось получить натриевые соли. Для празеодима была получена Желтая соль типа MjPrCU(M-Na-g Cs и NH4).Из них только производные Cs и Rb стабильны в воздухе. 52) нитрат CE * 4 является нитратом красного основания, известным как Ce (OH) (NOj) j-3HjO. Если вы добавите сильный HNO3, желтый раствор станет красным. Из такого раствора, нитрат зерна достаточно экстрагируют эфиром.
Нитраты Используют К. Н. MilCe (NOj) » типа NH4A образуется довольно устойчивая Красная комплексная соль. И двухвалентный нитрат металла типа M (Ce (N03) α] — 8Ha0.Константа диссоциации Ионов CeNO (0.06) значительно меньше, чем у не-CeNOs ^ 2.In получена смесь с азотнокислым празеодимом, n Pr (NO)* 53) В отличие от нитратов, перхлораты Ce-4 также известны как нормальная соль-Ce (СУ4) 4.
Интересно отметить влияние прямых солнечных лучей на раствор Ce (СУ4) 4-FC (подкисленный хлорной кислотой) сы4ь образуется смесь кислорода и водорода. То есть, фотохимическое разложение воды подобно перхлорату, и красный кристалл, четырехвалентный ацетат, Ce (CH9COO) 4, также известен как нормальная соль. 54) вследствие взаимодействия Сеот с высокотемпературным концентрированным HaSO4 безводный сульфат 4-валентного церия осаждается в виде кристаллического порошка темно-желтого цвета.
Известен оранжевый кристаллогидрат Ce (S04) j-4Hj0. Ce (S04) * оранжевый цвет раствора меняется на красный при добавлении H3S04.Двойные соли образуются с сульфатом натрия, калия и аммония. Например, желтый оранжевый KJC e (SOJ «1 −2 N» 0 и оранжевый красный (NRtUCefSO ^ J ^ HjO).На фотографии использованы 4 валентных сульфата. Анализ (является ли он более устойчивым к хранению, чем решения KMp04 или KiCraO?)
Было установлено, что константа диссоциации Иона CeSO ^ ’ равна 310. 55) желтый Pr (S04) j, полученный взаимодействием pr02 и концентрированной серной кислоты в сухом кислороде flow. It стабилен при хранении в таком Кислота (образуя таким образом соединение состава Pr (S04)»-2HjS04″).Но воздух медленно разлагается и приобретает зеленый цвет. Z) интересным соединением четырехвалентного церия является пероксидное производное его карбоната.
Cet (CO)образуется при введении трехвалентного церия в концентрированный «раствор»Натко, при отсутствии контакта с воздухом раствор этой соли постепенно приобретает темно-красный оттенок. Кажется, есть какая-то реакция. Согласно схеме, Cea (CO») » +2Н30+ Oj = Ce *(COj) «(OH),+Н20, а Cej(COj) s (OH) j + HiO *» — Ce3 (C03) 303 +2Н»0.в присутствии относительно слабых восстановителей (например, As303) перекись водорода расходуется на окисление, а не на 2-ю стадию процесса.
Результатом в этих условиях является окисление всего Ce до 4 валентности с образованием желтого комплекса Naa (Ce (COs) i).Затем реакция прекращается. Сильный восстановитель (например, глюкоза) восстанавливает не только HjOj, но и n Терней (до 3 валентностей).Последний снова окисляется кислородом воздуха, а затем окисляется до новой части, такой как глюкоза, которая служит катализатором для системы.
57) двухвалентные производные Sm, Eu и YB называются сильными восстановителями, а двухвалентные состояния наиболее характерны для нее наименее Sm. So в водном растворе восстановление водорода по схеме 2E ~ + 2H* 2E — f H3-это Sm-и довольно быстро, Yb-медленнее, а Ei еще более «медленный».»В обычном потенциале, соответствующем переходу е * * * + е«е * 4 (в кислой среде), даны следующие значения: −0.43(Ey),— 1.15 (Yb), −1.55 в (Sm), Ион Hey бесцветен, Sm-красный, Yb-зеленый краситель.
58) галогенид EG3 получают путем восстановления соответствующего ГАЛОГЕНИДА EG $водородом при нагревании. Бесцветный EuCI *(Мп.738, Мп.2190°С) начинает формироваться уже при 270°С, а красно-коричневый SmClj(mp.859, Мп.1950°C) −400°C, желто-зеленый YbCl3 (mp 723, mp. Поскольку стабильность двухвалентных производных от 2105°C до −560°C несколько повышается со многими галогенами CI-Bg-I, бромиды EG3 и ноды легче восстанавливаются, чем chlorides. In вода, рассматриваемый галогенид легко растворяется.
Хлорид европия (теплота образования от элемента 193 ккал / моль) может быть выделен из раствора в виде кристаллогидрата EuClj-2HjO. Из фторидов известны бледно-желтый EuFj и красновато-коричневый SmFt. Оба немножко солубле внутри water. As для иттербия были получены только продукты приблизительного состава Yb «F». 59) в остальных лантаноидах галогениды галогена почти нехарактерны. Темно-зеленый NdCI3 (mp.841) и темно-фиолетовый Ndlt (mp.562°C) лучше всего понять.
Мы также обсудили черный CeC13 и некоторые узлы E1 *.Из них Ndl3 и Tml3(Sml2, Eulf и Ybl3 и т. д.) являются обычными галогенидами двухвалентных металлов, а Кельт и Пр13 (Лал3 и др.) проводят ток хорошо и четко соответствуют структуре е * * + 21 ″+ С. имеется обзорная статья по дигалогенидам лантаноидов. 60) почти нерастворимые в воде (и поэтому более стабильные) сульфаты 2-валентных Sm, Eu и Yb могут быть получены катодным восстановлением соответствующего сульфата^(SOib.
Это позволяет относительно легко отделить рассматриваемый элемент от других фонарей. 10 «моль / л при 20°С) практически не растворяется в разбавленных кислотах (в то же время не окисляет вещества).Желто-зеленый YbSO «N Orange SmSO» растворяется в разбавленных кислотах с образованием водорода. 61) двухвалентные оксиды SM, Eu и Yb (и их аналоги с сульфидами) кристаллизуются в виде NaCI.
Ядерные расстояния, определенные для них, сравниваются со следующими (A): SmO SmS SmSe SrgTe j EuO EuS EuSe EuTe I / bO YfcS YbSe YbTe 2.49 2.93 3.08 3.30 | 2.57 2.98 3.09 3.29 | 2.43(2.84)2М ZD7 * Новиков Г. И.. Политоп О. Г. успешная химия. 1984 год. СТ Б / 732. значение d (YbS) — это значение YbSi. поскольку он определен для конфигурации u, он заключен в круглые скобки. Следует отметить, что присутствие SmO и YbO было поставлено под сомнение в последнее время.
62) темно-красный EuO (mp> 1700°C) образуется при нагревании смеси EtO3 и графита до 1300°C. In вакуум, он дистиллирован без разложения, он относительно стабилен на воздухе и только медленно разлагается водой. Синевато-черный EuS был получен нагреванием Eu2Oj с потоком HaS 1200°C. In в глубоком вакууме он медленно испаряется при температуре 1600 ° С, а в нормальных условиях практически не окисляется на воздухе. Остальные соединения плохо изучены.
63) за счет взаимодействия циклопентадена с раствором европия в жидком аммиаке был получен желтый цвет, а из ЭИ (с» Н5″) — газообразный конденсат, который возгоняется при температуре около 430°С в высоком вакууме, но очень чувствителен к воздуху и влаге. Yb (CsHe) j также был приобретен. 64) степень окисления Ce известна как производная от 0.Она характеризуется составом 3 Yb (Диппи) в виде комплекса с дипсилсами.
Интересно, что по Координационному числу центрального атома они отличаются от аналогичных производных скандия и нитрия (добавление§ 5.37). 65) как видно из рисунка фиг XI-45, любое отклонение от трехвалентного состояния является особенностью фонаря и группируется вокруг 3-х элементов: La, Gd и Qi.
Это обстоятельство свидетельствует об особой стабильности электронной структуры ЕС ions. La(2、8、18、18、8)и Лу(2、8、18、32、8)мало того, Gd (2, 8, 1, 25, 8) in, каждая из четырех квантовых ячеек слоя fourf заполнена одним электроном. 1層4fの7の 量子子セルのそれ れれは1つの電子で 満在する。С этой точки зрения ионы перечисленных 3-х элементов можно считать своеобразным»инертным газом».Их конфигурация пытается приблизиться к соседним элементам, либо возвращая электроны, либо соединяя их(см. Рисунок 111 * 34).
Смотрите также:
| Подгруппа галлия | Семейство актинидов |
| Подгруппа скандия | Вторая группа периодической системы |

