Оглавление:














Подгруппа титана
- Подгруппы титана. Титан составляет около 0,2%от общего числа атомов в земной коре. То есть 1 из элементов, которые очень распространены в природе. Процент циркония составляет 3-10-3,гафния-5-10*%. Содержание гафния в земной коре даже больше, чем, например, йода или ртути, но Титан N и его аналоги на самом деле относительно неадекватны и иногда могут интерпретироваться как»редкий» элемент.
- В основном это связано с их рассредоточенностью, в результате чего рудные залежи, пригодные для промышленного освоения, можно найти лишь в немногих местах на планете. В свободном состоянии элементы титановой подгруппы обычно получают восстановлением хлорида магнием по схеме ЕС1 <+ 2мг = 2MgCl2-е Реакцию проводят нагреванием исходного материала до 900°С в атмосфере аргона (под давлением). С точки зрения физических свойств, элементы подгруппы Титана являются типичными металлами, которые выглядят как сталь.
Еще одной важной причиной является трудность отделения рассматриваемых элементов от природных соединений. Людмила Фирмаль
Константы, характеризующие их, сравниваются со следующими: TI Zr Hf 6.5 13.3 Температура плавления. С…… …… 1670 1855 2220 4330 5690 Проводимость (Hg = 1)….. …… 2 2 3 Чистый металл подходит для механической обработки. Однако даже малейшие примеси некоторых элементов (H, O, N, C и др.) уязвимы. Семь ** В виде чистого и компактного металла, все 3 элемента очень устойчивы к различным химическим воздействиям. Они более отзывчивы в мелкодисперсном состоянии Это условие, но все же при нормальной температуре все кислоты взаимодействуют только с HF.
Оптимальным растворителем для них является смесь плавиковой кислоты и азотной кислоты, которая реагирует по схеме CE + 18HF + 4HN03 = 3H2 [3F6] + 4NO-f 8H20 При высоких температурах Ti, Zr и Hf становятся химически высокоактивными. В этих условиях он энергетически связывается не только с галогеном, кислородом и серой, но и с углеродом и азотом. Их порошок способен поглощать большое количество водорода. 9-13 Практическое значение Ti и Zr особенно важно для специальной металлургии стали.
Оба металла также используются в качестве независимых конструкционных материалов. Их соединения используются в различных отраслях промышленности. Гафний и его соединения используются редко. В наиболее важных и наиболее характерных производных элементы подгруппы Титана являются четырехвалентными. Сам титан относительно легко образует нестабильные соединения, которые являются 3-валентными. Производные двухатомного титана менее и очень нестабильно.
То же самое относится к производным трехвалентного и двухвалентного циркония, а также к соединениям гафния. Соединения гафния имеют очень близкие химические свойства к соответствующим соединениям циркония. Поэтому вдоль ряда Ti-Zr-Hf стабильность низкой валентности снижается. То есть это явление противоположно тому, которое имело место в германиевой подгруппе.
При нагревании элементов титановой подгруппы в кислородной атмосфере они сгорают с образованием белого диоксида (Е02).Последний очень тугоплавок и практически нерастворим в воде или в разбавленных растворах кислот и щелочей. При нагревании концентрированной серной кислотой он медленно переходит в раствор, но под действием HF или его слияния со щелочью легко переходит в растворимое состояние.
Диоксид Ti и Zr имеют различные практические applications. In в частности, диоксид титана используется для изготовления очень хорошей белой масляной краски («titanium white»). Гидроксид е02 е (он)*, полученный действием щелочи на соединение типа Е14, соответствует белому студенистому осадку, который почти нерастворим в воде (но легко образует коллоидный раствор).
Гидрат диоксида титана обладает амфотерными свойствами, его основные и особенно кислотные свойства выражены очень слабо. При переходе на Zr и Hf кислотные свойства еще больше ослабляются, но основные свойства усиливаются. Все они растворимы в сильных кислотах, так как преобладают основные свойства гидроксида e (OH), но разбавленная щелочь также мало влияет на Ti (OH) 4. 29130. Соли гидратов металлов и металлов-титанитов, цирконитов, гипса обычно получают сплавлением диоксида с оксидами металлов или щелочами.
Для образующихся солей наиболее характерны типы M2EO3 и Mi30a (M-одновалентный металл).Большинство из них нерастворимы в воде, а растворимые полностью гидролизуются. Основные свойства гидроксида TiIV и его аналогов сильнее кислотных, поэтому соль бесцветного катиона E * +к воде более устойчива, чем титанат, цирконат и гафикат. Тем не менее, гидролиз этих солей очень важен, даже в сильном растворе Образование двухвалентных радикалов титанила (TU), z и r Конила, а также (ZrO) и гафнила (NU**) по схеме: Е «+ Н20 = ЭСУ + 2У
Многие соли титана и его аналогов являются производными этих радикалов, а не ионов Е4 +.Они могут быть (ti0 все) S04-2H20, ЭОС-внго (е ЗР или КВ) и т. д. 35 — » 44 Среди других производных Ti, Zr и Hf наиболее важным является галогенид типа EG .Их обычно получают путем сияния смеси углекислого газа и угля в атмосфере галогена. Реакция протекает по схеме Э02+2С+ 2Го = 2со + ЭГ » свойства галогенидов сильно варьируются от Ti до ZR. Например, TiCU-это жидкость в нормальных условиях, а ZrCU-типичная соль. За исключением ZrF4(и HfF4), EH * галогенид легко растворяется в воде.
Комплексообразование с соответствующими гидрогенными кислотами и особенно их солями очень характерно для всех рассматриваемых соединений. Наиболее распространенными являются комплексные производные общей формулы M2 (EHB] (M — 1-валентный металл).Они проходят очень меньше гидролиза чем первоначально Галоид EH4, с хорошим crystallization. It показана стабильность комплексных ионов (EHB) в растворе Несмотря на то, что элементы подгруппы титана не похожи на кремний по своему атомному строению, производные их характерных валентностей хорошо согласуются с соответствующими Silicon.
In в частности, при переходе от Si к Hf свойства высших оксидов изменяются очень естественно. Напротив, как видно из сравнения теплоты, производимой Эог (ккал / моль), например, эта закономерность не встречается в серии Si-Pb: Pb Sn Ge SiCSi TI Zr 66 139 139 218 94 218 225 263 270. Добавь 1) цирконий был открыт в 1789 году. Титан-1791.Открытие гафния продолжилось в 1923 году. Элементы. Ви? Это было так 104.In есть смысл. Г. N. It впервые был синтезирован Флеровым и его сотрудниками(1964 г.). в СССР название курчат было предложено в США Ки (Ki) — Резерфорд (РФ).
Изотопы этого элемента известны некоторым и имеют максимальную продолжительность жизни атома со средней массой 261 (около 2 минут).С химической стороны, несколько атомов показали, что кручагов действительно напоминает гафний. Имеется монография по Титану и цирконию*. 2) природный Титан, массовое число 46(8.0)、47(7.3)、48(73.9)、49(5.5)、50(5.3%)он состоит из n изотопов. Цирконий-90(51,5). 91(11.2). 92(17.1)、94(17.4)、%(2.8%);гафний.-174(0.2)、176(5.2)、177(18.6)、178(27.1)、179(13.7)、180(35.2%)。
3) в основном состоянии атомы элементов титановой подгруппы имеют структуру внешней электронной оболочки 3d * 4s *(Ti), 4dJ5sJ (Zr), 5 <P6s7 (Hf) и являются двухвалентными. * Mlkkvileli Л. Д.. М акк внлелеа М. К. Тятая. Эд поет, с английского. С. Г. Грузнофф. М.. Iedatyanyat. 1938 год.»58 страниц. Горошкова, Я. Г. химия Титана. Киеп. «Данька науки. 1970.415 п. ч л и К и й н г. п. Титан химический М..«Химия.» 1971 год. ^ 71 стр. Miller G. L. Как я должен использовать это лекарство? С английского, Изд. С. Г. Glaznoff И. А. А. Chiacersa М., Изд-tiilnt. 1965.392 секунд Блум У. Б. химия закона.
С английского, Изд. Л. Н. Комиссарова И. В. Спунтозина. М. Igratinlit. 1963.311 п. Возбуждение четырехвалентного состояния Ti. Требуется Zr (4d ’ 5s) и Hf (5Я6*) Стоимость составляет 19, 14 и 40 ккал / г атомов соответственно. То есть он осуществляется гораздо легче, чем элементы германиевого семейства.
Непрерывная энергия ионизации рассматриваемого элемента показана ниже(своего рода): i и III IV Ти 6.82 13.57 27.47 41.21 ЗР 6.84 13.13 22.98 34 33 Ширина 7 14.9 (20.3) (30.8) 4) накопление Титана можно встретить в виде минералов Илите (FeTiOO и рутила (Ti02)).Значительное количество титана содержит некоторая железная руда, особенно Уральская тайская magnetite.
As для гафния отдельные минералы еще не были found. In форма примесей (на атомарном уровне, всегда содержится в ZR-рудах. Существует обзорная статья о том, как разделить цирконий и гафний V. 5)незначительное количество титана постоянно содержится в растительных и животных организмах, но армия этих организмов не ясно. установлено, что тнтан и его аналоги не токсичны. в) хлорид, отличный от Титана, восстанавливается, а его аналоги с магнием сопровождаются выраженным тепловыделением: 127 (Ti) и 77 (Zr) ккал / г атомов.
Другим восстановителем, который иногда используется, является металлический натрий, реакция которого более пирогенная (около 85 ккал / г атомов).Чистейший геометрический ти. Zr и Hf были получены термическим пиролизом с термическими вольфрамовыми проволоками пара в восстановленном многожильном поле (VII. 4 за $ 19.) 7) обычными формами металлов Ti, Zr и Hf являются те, в которых каждый атом близок к G(2. respectivelyP0; .3. расстояние 18 и 3,13 л) и слегка удаленные соседи(2,95; 3,23; 3,19 л). при температуре 882, 870 и 1750°с соответственно каждый атом переходит в структуру с 8 ближайшими соседями на равном расстоянии: 2,86 (до 3,13 а (Zr)).
8) теплота плавления и испарения элементов титановой подгруппы имеют следующие значения соответственно: 3,7 n 103 (Ti). 4.0 и 139 (Zr). 5.2 и 158 (Hf) ккал / г атомов. В жару при 25°С, 113 (Ti).! Дана оценка 46 (Zr), 100 (Hf) ккал / г-атом. 9) благодаря общей высокой стойкости чистого компактного металла к различным химическим воздействиям, элементы семейства титановых также проявляют некоторые индивидуальные особенности.
Например, по отношению к соляной или серной кислоте цирконий гораздо более стабилен, чем титан, а по гораздо более стабилен по отношению к влажному хлору или царской водке. Титан, напротив, гораздо более стабилен, чем цирконий. Под воздействием HF Титан переходит в 3-валентное состояние. Улипкомтфт и гафний-четырехвалентные. В отсутствие Γ ’ все 3 металла постепенно превращаются в амфотерные электролиты даже в слабых кислотах. Концентрированный Уно Чити (как и О’Хло) окисляется до нерастворимого Титаника acid.
In сильный раствор сильной щелочи, ее порошок растворяется с выделением водорода и образованием солей Титановой кислоты. Связанные с щелочью цирконий и гафний очень стабильны. 10) взаимодействие титана и фтора уже произошло с другими галогенами (пр-150°С), примерно при 300-10°С. 13 кислородный порошок титана воспламенялся не менее 500 раз В азоте-более 800°C порошок циркония воспламенится в воздухе уже около 250.
By сжигая его кислородом, можно получить температуру до 46f> 0 ″ C. I) обычно поверхность металла цирконий и Титан покрывают очень тонкой, но плотной оксидной пленкой, которая отлично изолирует металл от внешних воздействий. При определенных условиях (например, контакт с очень влажным воздухом 2g) «Комиссары» Л. Н.. Плющ » В. Е. успехи химпи, 1956. 10. 1197. Я в Я для Израился я. В. Достижения в химии, 19v7. 7. 1244.
Он утолщается, разрыхляется и легко отделяется в результате случайного воздействия (сотрясение мозга и др.).Металлическая поверхность, Внезапно освобождаясь от поверхности, начинает энергично реагировать с кислородом и влажностью воздуха, что иногда приводит даже к самопроизвольному воспламенению металла. metal. It следует отметить, что сжечь цирконий и выпустить воздух практически невозможно.
12) каждый грамм атома Ti, Zr или Hf может адсорбировать до 2 г атомов водорода, но эта адсорбция происходит быстро только при высоких температурах(примерно от 400 для Ti и 700°C для Zr).Если металл предварительно обжигался в атмосфере H2, то установить равновесие гораздо проще. Проще всего синтезировать эти гидриды при достаточном нагреве и медленном охлаждении металла в атмосфере водорода при любом его давлении.
При небольшом содержании адсорбированного водорода внешний вид металла существенно меняется, но при большом содержании он становится серым или черным порошком (плотность TiMj составляет 3,8,плотность ZrH * — 5,5 г / см3).Образование EN-гидридов из элементов сопровождается значительным выделением тепла: около 30 (Ti) или 40 ккал / моль (Zr).В нормальных условиях эти гидриды устойчивы в воздухе (они воспламеняются при воспламенении).
Они также довольно инертны к большинству веществ, которые являются сильными окислителями. Это все также показывает. Образование определенных соединений в водороде сорбина. Однако такие соединения должны быть очень нестабильными, так как количество водорода, поглощенного металлом, изменяется с давлением и уменьшается с нагревом.
Интересно, что образование гидрида водорода наблюдалось также при длительном воздействии на металл сильных кислот (по-видимому, основную реакцию можно объяснить следующей формулой: 4Ti-J-6NCI = 2T1C!).б-2тих «-fh»)、 Гидрид титана является подходящим катализатором для специфических реакций гидрирования органических соединений. compounds. It применяется также в порошковой металлургии (как расклснтол).
Гидрид циркония (как ядерный замедлитель) представляет интерес для ядерной энергетики. За счет термического разложения обеих водородных смесей получается тонкая пленка соответствующего металла и различных материалов, что важно во многих технических областях. 13) при нагревании TI и Zr также могут адсорбировать кислород(до 30 Ат.%).Кроме того, поглощение сопровождается лишь незначительным увеличением объема metal. In небольшие количества, другие газы (как Nj) также поглощены.
14) в металлургии Титан и Ниркоин используются в виде сплавов с Железо-Ферротитаном и ферротидилконием, содержащих 15-60% Ti или Zr. Bbipa66t * a из этих сплавов обычно получают раскаленным природным минералом TI Il Zr e coal в присутствии железной руды. 1Б)КТА. поскольку Титан, добавляемый к Ил, уже составляет 0,1% титана, твердость и эластичность эфт получается, эта сталь будет очень хорошим материалом для изготовления рельсов, осей, валов и т. д.
- Что особенно ценно при изготовлении броневых листов и щитов. Kflk TI, So, troften также вводятся в различные сплавы Cu и L1. 18) как конструкционный материал, Титан имеет очень благоприятное соотношение прочность / масса, с сочетанием высокой термостойкости и коррозии resistance. It особенно широко используется в строительстве самолетов, а Циркон I (освобожденный от примесей) является одним из важнейших конструктивных элементов для арсенала ядерных реакторов. 1 метилового чиа 1harconium порошок используется для iHoD в cOctaeax из iotroin предохранители.
Этот же порошок, смешанный с нитратом циркония, использовался для получения световых сигналов, которые излучают много света при горении. Ty +air иногда используется в качестве катализатора для различных реакций, включая свободный азот и водород. Когда Тхтана обсуждает стекло, последнее остается с тонкой пленкой очень тонкого стекла. metal. В нормальных условиях титан не смачивается ртутью. Поверхность металлического циркония гидрофобна и не смачивается водой или водным раствором пактеопама* th
It смогите быть использовано для высокоомного изготовления в электрической индустрии. Людмила Фирмаль
Это важно для конденсаторных агрегатов. Гафний главным образом использован в электронной технологии (как Католическая телевизионная трубка) и ядерной энергии (как амортизатор нейтрона).Стерлинговое серебро идеально подходит для пайки титана и циркония (атмосфера аргона).
17)ежегодное мировое производство титана оценивается в сотни тысяч тонн. Это десятки тысяч штук на цирконий, и только несколько сотен тонн гафния. 18) суммарному переходу по схеме e * 4 + Ae»E» соответствуют следующие значения нормальных окислительно-восстановительных процессов в кислой среде: −0,86 (Ti), −1,43 (Zr) и −1,85(Hf). Эффективные радиусы турнира TI4 *,ZR и Hf4 * ионы 0.64, 0.87,и 0,86 А. d
19) когда нагрев TiO2 (mp 1870°C) превышает 2200°C, кислород частично удаляется с образованием синего Ti3O (т. е. Ti02Ti203), а затем темно-фиолетового TijOy. In в стекольной промышленности диоксид титана используется в производстве огнеупорного стекла, в керамике-его часто вводят в состав эмали, глинозема, фарфора.
Прозрачный кристалл рутила, искусственно полученный в электрической печи, имеет показатель преломления (2,4) выше, чем у алмаза (2,6), и дисперсию света в 6 раз. Поэтому драгоценные камни, полученные из них, по красоте лучше бриллиантов. Диоксид титана также действует как превосходный катализатор в некоторых органических реакциях.
Ежегодное мировое производство ТУ2 составляет около 100 млн. г. 20) чрезвычайно тугоплавкий (mp 2850°C), в расплавленном состоянии, который очень устойчив к различным химическим воздействиям, диоксид циркония в основном используется для производства огнеупорных изделий (таких как кварцевые плавильные горшки).Твердый раствор ZrO2 O2 нескольких других оксидов (например, Y203), которые проводят электрический ток через движение ионов, используется в качестве твердого электролита в конструкции высокотемпературных топливных элементов.
Введение Zr02 в эмаль придает последней большую прочность и эластичность, а также высокую устойчивость к воздействию температуры и химических веществ. Стекло, содержащее ZrO2, особенно устойчиво к щелочам. Диоксид гафния более огнестойкий, чем Zr02 (mp.2000°с). 21) для всех членов подгруппы Титана были получены сульфид, селенил и Теллурид (за исключением Ште2), которые были близки по составу к высшим оксидам (за счет взаимодействия элементов в момент нагрева).
Как правило, их цвет коричневый (за исключением желтого Тис2 и черного титана).Термическая стабильность этих веществ уменьшается вдоль ряда S-Se-Tc, и соответствующие реакции замещения происходят при 600-700°С. Эксперименты с прессованными порошками серии Ti — Zr — Hf и Tc — Se — S показали, что свойства металла снижаются, а солеподобные свойства соединений повышаются. Производные титана и ZrTe2 обладают металлической проводимостью. ZrSc2. ZrS2. HfScj-это полупроводник, а HfS2-изолятор.
22) Доловио характерно для элементов титановой подгруппы и производных состава EC3.Где X — это S. Это хорошая идея. Это также достигается непосредственным взаимодействием элементов при нагревании. Из них известны оранжевые ZrS3, HfS3 и черные TiS3, ZrSe3. Зртие3. логово. HfSe3. Давление паров серы на 100 мм рт. Искусство. TiS3 только достигает 540 и достигает ZrS3-около 815 ° С. 23) сульфиды, мхи и теллуриды элементов подгруппы tptia устойчивы по отношению к воздуху и воде.
При нагревании на воздухе они сгорают с образованием компонентов диоксида. Хлор уже мал и при 10°С переходит в соответствующий хлорид ES14 (и SC12, SeCI «или TeC1»).Устойчивость этих веществ к действию концентрированного HCl снижается в серии S-Se-Te. При использовании сильного раствора NaOH или концентрированной H2S они разлагаются при нагревании, в то время как концентрированная HNOj окисляется при взрыве. 24) среди смешанных сульфидных производных следует отметить твердый оксо-сульфид циркония и сульфо-титановый хлорид в нормальных условиях. Желтые ZrOS получены раскаленным добела ZrO2 в потоке H2S, и черный TiSCI2 получен взаимодействием с паром HJS TiCl.
25) при высоких температурах элементы подгруппы титана соединяются с углеродом с образованием карбида типа ES. Реакция протекает с выделением тепла: 46 (Ti), 48 (Zr) и 52 ккал / моль(Hf).Карбиды Ti, Zr и Hf представляют собой кристаллы металлического типа структуры типа NaCl, очень твердые и тугоплавкие(mp 3250, 3735 и 3890°C соответственно).Сплав состава HfC-4TaC является наиболее тугоплавким из всех известных веществ (mp. 3990°С).
В отличие от карборунда, рассматриваемые карбиды хорошо проводят ток(только немного хуже, чем соответствующий свободный металл).Поэтому карбид титана используется в производстве дуговых ламп. Этот карбид часто вводят в состав металлокерамики, используемой при изготовлении различных жаропрочных конструкций(лопаток газовых турбин и др.).
Из-за высокой твердости, TiC n ZrC иногда используется в качестве шлифовального материала. Благодаря достаточному нагреву Титан и его аналоги карбидов вступают в реакцию с галогеном, кислородом и азотом. 26)они тесно связаны с карбидами и сходны по свойствам с силицидами в подгруппе элементов титана. Наиболее типичной формой является 3SI и 27) подобно взаимодействию с углеродом, соединения элементов подгруппы азота и титана объединяются при высоких температурах.
Желтые нитриды Ti, Zr и Hf, образующиеся в результате появления этого металла, имеют состав, соответствующий общей формуле 3N и структуру типа NaCl. Они образуются из элементов со значительной теплотой (80, 87 и 88 ккал / моль соответственно), являются очень твердыми, огнеупорными (Мп 2930.It значительно лучше, чем соответствующий свободный металл.
Когда ZrCU нагревается до красного накала потоком аммиака, мы получаем коричневый нитрид с составом Zr $ N(промежуточными продуктами являются ZrCl4-4NHj и Zr (NH2)’].Титай образует олово в тех же условиях(энергия диссоциации газообразных молекул составляет 114 ккал / моль) из-за своей чрезвычайной твердости, нитрид титана иногда используется (вместо алмазной пыли) для полировки ювелирных изделий и т. д.
Взаимодействие с термическим раствором щелочи протекает по следующей формуле: 2TiN-f 4KOH-f 211 ^ 0 = 2KjTiOj-f 2 NHS-f-fH2.LisTiN3 двойной itrnd также известен. Производные кремния и Германия. 28) тип фосфида титана и его аналоги, аналогичные нитриду титана, характеризуются типом ЭА. Э, Э *.Они термически стабильны и представляют собой серое твердое вещество, которое не вступает в реакцию с HCl, HjSO»или HNO» (но растворимо в смеси HF-f HNO). Также известны двойные соединения в составе LijTiPs и LijTiAsv. 29) для Титана известны 2 формы диоксидизата-отношение между А и Р равно same.
As в случае олова (§B доп.36).Диоксид титана а-гидрат, который получают гидролизом солей в условиях холода, аморфен и легко растворим в кислотах. Когда стоящ (более быстро во время топления), вызревание и постепенно двигать к{3-form. It имеет микрокристаллическую структуру и растворяется только в HF или термически концентрированном lUSO.»
Явление старения также является особенностью гидратов циркония и диоксида гафния. нагрев гидроксидов типа А сопровождается внезапным самоотделением массы, которое происходит в определенный момент, за счет перехода из аморфного состояния в кристаллическое. 30) Zr (OH) ((PR = 1. Переход к бедной водой форме (10 м) и Hf (OH) 4 к 30 (0H) j составляет 140°С для Zr и Hf-pr 155°С. Когда оба гидроксида растворяются в сильном растворе сильной щелочи, ионы {3(0H) s} (пр.
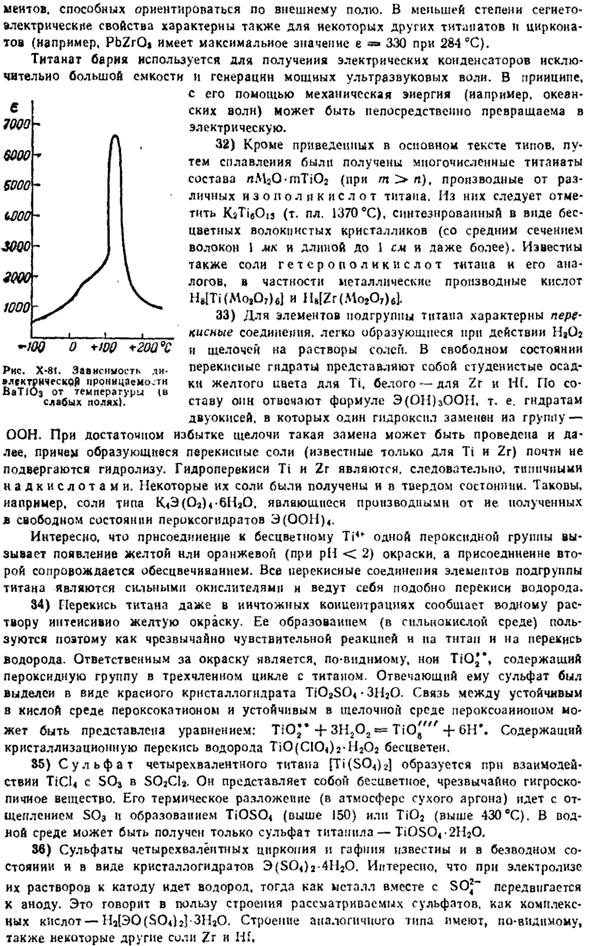
Образуются концентрации NaOH до 10 и более) или[E (OH) in] «(выше 10 и более). NaOH был отделен Haft NaJHf(011). 31) из тантаната наиболее интересны цирк, гафнат, Бату3.Эта соль является электриком Землетрясения (§ 2 add. 90).как показано на рисунке, X-8I проявляет сверхвысокий диэлектрический потенциал в широком диапазоне температур (максимум при 120°C). Сегнетоэлектрические свойства BaTi03 обусловлены возможностью перемещения ионов Ti4 *из среднего положения в кристаллической решетке (см. Рисунок X1I-3S).
Такие изменения приведут к появлению внутренних диолов Полицейский, который умеет ориентироваться во внешнем поле. Прочность не так велика, но сегнетоэлектрические свойства также являются свойствами некоторых других титанатов и цирконитов(например, максимальное значение PbZrOt составляет 284°C и e•= 330). Титанат бария используется для изготовления конденсаторов очень большой емкости и для получения мощного ультразвука waves. As правило.
С его помощью можно напрямую преобразовывать механическую энергию (например, морские волны) в электрическую. 32) методом плавления, помимо типов, приведенных в тексте, было получено большое количество титанатов (m> l) состава LM20-TUT2, которые являются производными различных титанов и диолов, k и s и L. из них следует отметить KjTieOts(mp 1370°С).он синтезируется в виде бесцветных волокнистых кристаллов(средняя площадь поперечного сечения волокна составляет 1 мкм, длина более 1 см).
Известны также соли гетерополикислоты титана и ее аналогов, в частности кислоты Н, 1Т. металлические производные (Mo, 07b) и 1С [2g (MogO)«]. 33) элементы титановой подгруппы характеризуются пероксидным соединением и легко образуются под действием Н2О2 W00 O + iu0 + 20Q9C и раствор соли из щелочи. Диаграмма свободного состояния x-et. Зависимый гидрат перекиси представляет собой студенистый осадок * Ти электрический * проницаемость К11 желтый. Белый-для ZR и HF.
Температура co-BaTiOj (v._ Слабое поле.)Я согласен, что они соответствуют Формуле E (OP) UNO, то есть гидрату 1. один гидроксил был заменен в группе IA двуокисью-UN. Если щелочь достаточно избыточна, то такой обмен может быть осуществлен further. In кроме того, полученная пероксидная соль (известная только с Ti и Zr) практически не гидролизуется. Поэтому гидропероксиды Ti и Zr характерны для обоих алкоксидов. Некоторые из солей в них были получены даже в твердом виде.
Такова, например, соль типа K «E (02)» — 6H20.Получают из свободно полученных пероксидов е (ООН).」 Интересно, что если вы добавите 1 перекисную группу к бесцветному Ti4, появится желтый или оранжевый (pH <2) цвет, а добавление 2 вызовет обесцвечивание. Все пероксидные соединения элементов подгруппы Титана являются сильными окислителями и ведут себя как перекись водорода. 34) перекиси титана придают водному раствору темно-желтый цвет даже в очень малых концентрациях.
Поэтому его образование (slnnoksloi среда) используется как очень чувствительная реакция на Титан и перекись водорода. TiOJ, содержащая перекисную группу в 3-членном кольце, содержащем Титан, явно является причиной цвета. Соответствующий сульфат выделяли в виде красного кристаллогидрата Ti02S04 * ZN20.Соотношение между кислотно-стабильным пероксокатионом и щелочно-стабильным пероксоционом может быть выражено следующей формулой: TiOJ * +ЗН202* = Tio » + 6н*.
Кристаллизованная перекись водорода TU (CU») 2Н202 бесцветна. S5) четырехвалентный сульфат титана (Ti (S04) 2]образуется при взаимодействии TiCl и SOj из » S02Cl2.It представляет собой бесцветное и очень гигроскопичное вещество. Его пиролиз (сухая атмосфера аргона) составляет 150) или Ti02 (выше 430 ° C) только титапир ti0s04-2h20 сульфат получают в водной среде. 36) четырехвалентный цирконий и сульфат гафния известны как в безводной форме, так и в виде кристаллогидрата 3 (S04) 2-4H20.
It интересно, что при электролизе раствора водород поступает в катод, а металл вместе с SOj перемещается к аноду. Этому способствует структура рассматриваемой серной кислоты-H2(30 (S04) 2) ZN20.Очевидно, некоторые другие соли Zr и Hf. И 7000-37) в комплексе, образованном из сульфатов Ti, Zr, Hf и других сульфатов, максимальное координационное число Центрального ithom увеличивается с переходом от Ti к Zr, Hf.
Таким образом, комплексы типа Mz {S04h)для всех 3 элементов имеют тип M [[[3 (S0″bl-Zr и Hf только. Оксалатный комплекс в составе K [[E (C204)«) — 5Н20.Все 3 элемента образуют комплексы типа M2 (30 (S04)2].Интересны пероксиды и комплексные сульфаты K2t3 (S04), 02] — 3Hj0. Найти «тип м2 комплекс (е ($0») с]- 38) KNCS является избыточным, но сульфат титанила медленно растворяется в жидком аммиаке. Из полученного красного раствора выделяли сложный тиоцианат состава Kj [TiO (NCS) 4] −2NHi.
Под действием KNHj получается коричневый титаниламид-TiO (NH2) j, который медленно гидролизуется во влажном воздухе. С влиянием чрезмерного КН ’ х, оранжево-коричневого Тио(.\ HK) будет преобразован в 2.Мигает при контакте с воздухом или водой. Нагрев TiO (NrH2) f предполагает удаление аммиака и образование сине-черного титанила — (TiO)«N * j. последний не взаимодействует с водой и разбавленными растворами кислот и щелочей, а при нагревании в воздух поступает Ti2.
Было также описано, что коричневый красный TiO (NCS) 2 2h20, красный Kj (Ti0 (NCS) J J-H | 0 и темно-красный K ^ T ^ NCS)^ chjcn теряют молекулы ацетонитрила при нагревании до 95°C. Для титановых аналогов был получен фиолетовый (Zr) или розовый (Hf) комплекс типа IN (C2H5)4k (3 (NCS) e].KafZr (NCS) e) также известен. 39) 4-титанат нитрата титана получали реакцией при −80 * C: TiCl4 + 4CINOj 4C12-f Ti (NO|) 4. Oi представляет собой бесцветное кристаллическое вещество(mp. It 58°C) и возгоняется в высоком вакууме при 40°C. «
В случае олова (§b, внутр.59)», а также связи Ti-NOa реализуются 2 атомами кислорода[d(TiO)= » 2.07 A]. в воздухе нитрат титана разлагается с образованием белого оксо нитрата TiO (MO|) 2.При нагревании он поступает в ТУ2.Оба соединения очень гигроскопичны и гидролизуются водой. 40) ZR (N03) 4 и Zr0 (N04) j безводные по большинству свойств сходны с соответствующими производными титана. Однако нитрат циркония в воде разлагается не очень сильно. Известны кристаллогидраты от ZrO (NOa) 2-2HtO до Zr (NOa)<5H20.Соль последнего легко режет подбородок азотной кислоты и переходит в циркокилнитрат.
Для гафния кристаллогидраты HFO(. Известны также 2 и 6 молекулы воды и летучие аддукты Hf (N03) 4-N * 0v. Также были получены нитрат циркония и комплекс гафния в составе[N (CH3) 4]’ ’(E (N03). с.]При нагревании оксиды азота примерно при 130 и 230°С удаляются и начинают разлагаться. 41) перхлорат E0(C104) a известен как кристаллический гидрат (Ti-6Н20,Zr-8 tf20).Интересно, что титаниловая соль, которая почти нерастворима в воде, бензоле, CC14 и доноксане, очень хорошо растворяется в спирте и acetone.
It хорошо растворяется в солях аскорбиновой кислоты. Найдено значение первой константы диссоциации+ C \ 0’4 K в водном растворе по схеме ZrOfClO ^ s ^ГZr0Cl0-2-10- -я не уверен. 145°С при нагревании, ЗР(C104)-8×20 кристаллизационной воды сольватный тает,°С 610 в 6Н20 отсоединить, 240°С еще 2Н20 резки и 320°С полностью Zr02 разбирать. 42) среди других производных кислот кислорода фосфат е (НР04) 2 особенно характерен для ZR и HF.
Они отличаются тем, что практически нерастворимы в кислотах (кроме HF), и поэтому могут осаждаться в кислой среде. Это позволяет отделить Zr-n-Hf от всех других металлов (кроме Ra).Они слабо растворимы в кислотах и обоих элементах. 43) для Zr и Hf очень характерны производные ионов dncnrconyl (Zr, 0j4) и jigafil (Hf2Oj * j), например Zra0a (N0s) a-5H20 и Hf20jCI2-5H20.
44) для титана и его аналогов известен алкоголят, который образуется по схеме: ES1 ″ + 4ROH +4.\ H3 = 4M14C1 + 3 (или) 4.Эти спирты растворимы в бензоле, но являются жидкими или твердыми летучими веществами, которые разлагаются гидролизом водой. При растворении в соответствующем спирте они делятся на sio-Могут образовываться комплексные кислоты типа Hj [3(0R)).Интересно, что в твердом состоянии Ti (OC2Hs) имеет tetramer.
In раствор бензола представляет собой тример. 45) некоторые характеристики галоинида титана по сравнению со следующими: TlF4 TiCt, TlBr4 Ti / 4 Тепло образования. ккал / моль. 。 353/92163 122. прибыльно…………….. БС-ССВ. Бесцветный желтый темный кран. Температура плавления. Это хорошая вещь……….— 23 +39 150 Температура кипения. С………… 283 136 231 377 При физической постоянной галогенид титана близок к соответствующему соединению Si. Ge и Sn.
Их молекулы имеют тетраэдрическую структуру с атомом Титана в центре(d(TiCI)=2.18.Rf (TiBr)= 2.31 A. x(TiCI) » 3.1:K (TiBr)= 2.51-Ti-C1 энергия связи как растворитель для неорганических соединений, TiCl4 характеризуется тем, что он лучше всего растворяет вещества с типичными молекулярными структурами. 46) перечислены 2 желтых порошка хлорида фторида титана, TiFjClj и TiF3Cl. Первые из них выше 125°C описаны в TiF4 и TiC14.Инфракрасные спектроскопические данные этого соединения свидетельствуют об этом.
Связь TiF в нем ослаблена, а связь TiCl усилена по сравнению с соответствующим симметричным тетрахарамидом. 2-й хлорид фтора легко гидролизуется в воздухе до желтого TiOF2.При нагревании последние разлагаются на Tifa и TiO.Аналогичный оксо хлорид-TiOClj-был получен в 2 различных ways. By реакция, TiCI» -t * CI2O 2Clj — + — f TiOClj и 3TiCU + Asj03 2A <iClj + 3tiocio 5.It представляет собой очень гигроскопичное желтое кристаллическое вещество, которое разлагается на TiCl4 и TiOj pr 180°С (желтый ТУВга подвергается аналогичному диспропорционированию при 14 G ° C, а коричневый тиола уже разлагается выше i05°с).
Известны и другие продукты с добавлением к Тиоцию других веществ. MJ тип соединения оксо хлорид (TiOCI » l * HjO (M-Cs. Рубидий.)47).Постепенное добавление TiCl4 к жидкому аммиаку приводит к образованию желтого осадка аммиака T / C14-6MNz. По-видимому, на самом деле этот аммиак-Ti (NTHa), Cl-f-3nh4cl представляет собой смесь композиции.
При промывке жидким аммиаком NH4C1 нагрев последнего в вакууме сопровождается расщеплением NH3 с образованием зеленовато-синего нитроглицерида NTiCl, так как красный Ti (NHjbO) остается удаленным. Продукты пиролиза аммония TiBr4 N Til4 являются ntibr 11 NTiH, соответственно. 400 ° С преобразуется в олово. Титан.(\ 05) за счет взаимодействия между 4 и KNHj в жидком аммиаке образуется коричневый Ti (Mh) 4, который легко превращается во взрывчатое вещество Tl (NH) 2. 48) сравните некоторые свойства галогенидов циркония и гафния ниже.
Они характеризуются переходом при нагревании непосредственно из твердого состояния в парообразное, поэтому температура их сублимации (давление 760 мм рт. ст.) ниже температуры плавления (определяется только под давлением). второй.) ZrF4 ZrCl4 ZrBr4 zrbr4 2r I » HfF4 HfCl4 HfBr4 Теплота образования, ккал / моль……. 457 235 182 Мб 461 237 Температура сублимации, ° С903 332 357 431 313 322
Температура плавления. 912437450499 1025 432 420 Мясной пар соответствует простой молекулярной массе. Молекула EG4 имеет тетраэдрическую структуру с атомом E в центре[d(ZrF)= » 1.94, d (ZrCl)= 2.32. д (Hfciбыл)=£ 2.33 а].Единственным цветным соединением ns, перечисленным выше, является красно-коричневый Zurl4.Молекулы hfl4 в парах (то есть 392°С) димеризуются. Монографии-фтористый цирконий и гафний 49) zrcl4 и взаимодействие жидкого аммиака(TiC!4), только 1 атом хлора замещен аминогруппой.
Продукт соответствует составу ZrCljNHj * xNHj. При нагревании до 100°C в вакууме, ZrClsNH?»NHj останется. * Больше, чем м.. Мито Д. Л. химия фтористых соединений циркония и гафния. М..»Паук.»1V7I. 112 страниц 50) для титана, для циркония Nzrt Нитрогалид является non-tail.
So в результате взаимодействия Zll4 и N’HJ при 500°C образуется желтый NZrl со слоистой структурой, образованной цепью-Zr_N_Zr_N — {d (ZrN) −2.16 A)и-Zr_I_Zr_I — [rf (zrr)= 2.95 A). ЗР (Нью-Хэмпшир)*было получено благодаря взаимодействию ZrBr4 и KNH3. Zr (NH) NK и Zr (NK)» — 2NHj. 51) гидролиз галогенидов EG4 протекает в основном по следующей схеме: ZrT + H20 ZrOr2 + 2 HG и T1G4 + 2HjO ^ zt TU2 + 4 HG.
Гидраты диоксида титана, образующиеся в результате гидролиза, начинают осаждаться даже при рН = 1,5.Исключение составляет фторид, который образует такие сложные кислоты, как вода и ЩЕОР4.Поэтому он почти не гидролизуется нагревательным раствором и может отделять Кристалл TIF4 * 2НгО и ZRF * * зн20 hydrates.
At в конце их было установлено наличие димерной молекулы с поперечной связью фтора типа F3ZrFFZrF3. 52) оксалиды циркония и гафния отделяют от раствора в виде кристаллогидрата EOS12•2H 0}.Приблизительно 150 СС, хлорид циркония обезвоживают, по меньшей мере 250 ° С, разлагают по схеме 2Zr0Cl2 = ZrCl4 + ZrOj. Безводный хлорид циркония был получен прямым синтезом при CC1 при −15°C. схема выглядит следующим образом: ZrCl4+ C1gO = 2C12 + + ZrOCl3.
It представляет собой белое кристаллическое вещество, нерастворимое в нерастворительных растворителях и сильно гидролизуемое водой. Его кристаллическая решетка состоит из по-видимому-ZR-O-Zr-O-анионов / ZrOCJ, — анионов и тех, которые полимеризуются образованием катионов fZrOJ *. 53) очень характерные свойства большинства галогенидов EH заключаются в том, что они сильно выражены и имеют тенденцию добавлять реакцию.
Общим примером всех 3 элементов в подгруппе титана является композиция ES1″ * POC13 и 3ci4-2POC1j желтого (Ti) или бесцветного (Zr, Hf) бинарного соединения. Плавление при 104 и 105°С (Ti) соответственно. 205 и 185°C (Zr) или 222 и 198°C(Hf).Композиционные добавки, такие как TiCI» * SC1«, TiCU * 2HCN, ZrCI4-2NOCI. Подобно SnCl (и в отличие от GeCl4), тетрахлорид титана образует комплексы с эфиром, желтым TiCI4•2 (С3Н) и др. ( $ ) 30.
Комплекс С S-доноламином, например TiCl4-2(C2H5) 3S, очевидно, более мощный, чем соответствующий o-донор(в отличие от кремния, возможно, а также олова).в ацетон-триэтиловом растворе TiCl4 сильно сольватирован и частично диссоциирован по схеме:2TiC; 4 (CH3CN)3 [TiCl3(CH3CN)3] ^ + [TiCU(CH3CN)] -. 54) почти все комплексные соли Zr и Hf бесцветны, но цвет производных Титана в значительной степени зависит от свойств содержащихся в них галогенов.
Композитная кислота. 。 H2lTiFel Н3(Тlcl «Я H3JTIBr» | Н3(Чудно) Флот Соленый цвет…….От бесцветного до желто-красного Стабильность солей сложных кислот, таких как H2EGS. In вообще, оно увеличивает с серией Ti — Zr — Hf и уменьшает с серией венчика F-CI-Br-I. Расстояния tifj〜, TiClJ «и ZrCl | — ионных ядер E-G составляют 1,92, 2,35 и 2,45 а соответственно.
Соответствующая свободная кислота была выделена в качестве кристаллогидратов H3ZrF» * краны закрепительных втулок H30.Интересно, что растворимость (NH4) 2ZrFe в благородной плавиковой кислоте уменьшается с увеличением концентрации HF, но KaZrFe увеличивается. 55) В дополнение к основному типу M ^ ZrFe), другой составной фторид также был получен для ZrF4.An примером может служить (NH4) 3ZrF.
Анион этой соли аналогичен по структуре Иону расстояния d (ZrF)= 2.10 A (NbF;)* ’(рисунок IX-67).При нагревании происходит последовательное разложение по схеме: (NH4) 3ZrF7 (297 ° С) (NH4) 2ZrFa(357°С) — + NH «ZrF $(4°с) -»- ZrF4.Аналогичная калиевая соль-KjZrF; плавится при −922°C без разложения. В расплаве из LIF-ZrF4 системы, 3 соединения образуются: Li2ZrFe (Мп 570°С), Li3ZrF7 (Мп 640°С), и Li4ZrFe (Мп°464 С разложением).
Структура, аналогичная соответствующим солям Sn и Pb, была установлена для синтетического фторированного титана K » HTIF «(§G add.57). 56) общий тип (C5H5) 3eg2 (G CI, Br) Кристалл «цена» (§Z ext.34) известен как Титан (Красный), так и цирконий (бесцветный).Для хлоридов Титан дается d (TiC)= 2.38, rf (TiCl)= 2.24 A, u = 6.3 (в бензоле).Аналогично * производные циркония имеют 5,9 в том же состоянии.
Бромид плавится при 314 (Ti) и 260°C (Zr) соответственно. мы получили » n Ti (CsHs)». 57) как уже говорилось в тексте, производные трехвалентных элементов более или менее характерны только для Титана. Темно-фиолетовый оксид TljO $(mp 1820°C) получают из Ti3 до 1200°C накаливания с потоком водорода. Синий Ti3Oj образуется в качестве промежуточного продукта при 700-1000 ° С.
Теплота, выделяемая из элементов Ti3Os и Tij03, составляет 587 и 363 ккал / моль соответственно. Если свечение сильное, Tij03 будет двойной предохранитель с TI *и Тио. Тиджой практически не растворяется в воде. Гидрат этого оксида образуется в буром осадке, когда щелочь воздействует на раствор солей трехвалентного титана. при рН = 4 он начинает осаждаться из кислой среды. solution.
It обладает только основными свойствами и не растворяется в избытке щелочи. Тем не менее, титанатов металлов (литий. На. Мг. Млн), полученных в сухом маршрут. Сине-черная » Титановая бронза «(VJ1I§ 5 доб.44) конфигурация * * АО. зтюг тоже известен. 88) самой большой особенностью Ti (OH) 3 является его очень легкое содержание кислорода. Если в растворе ПЭТ присутствуют другие окисляемые вещества, то » одновременно с окислением Ti (OH)»образуется перекись водорода.
В присутствии Ca (OH) 2 (связывание с H2Oa) реакция протекает по следующей формуле: 2T1(OH) H-OI-2H * 0-2Ti(OH) — f NgOg. Нитрат Ti (OH) 3 восстанавливается до аммиака. 59) фиолетовый порошок TiCl3 получают пропусканием смеси паров TiCl и избытка водорода через трубку, нагретую до 650 X. При нагревании происходит сублимация (частичное образование димерных молекул TijCU), а мутации происходят по схеме:2TiCl3 = TiCl»+ TiC | 2. Энергия связи Ti-C1 TiCI3 имеет значение 109 ккал} моль.
Интересно, что TiCl уже постепенно восстанавливается металлической медью в металлических условиях, образуя черное соединение (т. е. CuCl-TiClj) с составом CuTlCb. Аналогично прогрессируют взаимодействия с амиомами тринция. Сначала образуется TiCl4•N (CH3) 3 и избыток trnethnlamg -? Введите TiCl3•2N (CH3) 3. Трихлорид титана также образуется под действием водорода tic4 в осадке (ZN-F кислота) ml.
In в этом случае бесцветный раствор становится фиолетовым, что характерно для ионов Ti», и кристаллогидраты ticlj-GHjO могут быть отделены от него. Аналогичный кристаллогидрат CrCl3 (VII!§ 5 доп.59).Очевидно, что Формулы 1E (OH3) в] C13 и 1E (OHa)«C1|) соответствуют C2HaO. «к Ti: i по qvelode воздуха (по схеме: 4TiC!3 + 0 * -f2HaO = > 4тус1 * — F4 HC1). Ионы Ti * быстро уменьшают перхлорат (в кислой среде) до хлорида на 1 из очень немногих восстановителей agents.
In присутствие платины, Ti » окисляется водой(с образованием водорода). 60) теплота образования трехвалентных галогенидов титана из элемента составляет 335 (TiF3). 171(TiCl3), 131 (TiBr3). 80 ккал. Моль(Til3). TiF является наиболее стабильным, его синий Кристалл нерастворим в воде, он разлагается при нагревании! Только над 950°C(на TiF4 и Ti).Черные TiBr3 и Til3 имеют подобные характеристики к N * » PSC. Комплексообразование известно для всех трехвалентных галогенидов титана, победителями которого будут K3 (TiFe) (mp 840°С вакуум). 783) Н К * т! БР*] (Мп.662°с).Известны также производные типов MTiG4 и M * PG$.
Если последний тип получается из раствора Золя, то внутренняя сфера воды отделяется 1 молекулой т. То есть в виде M3 [T1G $(OH) g), легкость расщепления этой молекулы в момент нагрева зависит от природы катионов, поэтому в случае хлоридных производных цезия, рубидия и калия, соответственно, 270. 212 и| / 2°С. Из Онгевандов описан красио-коричневый Тиобр. 61) в случае жидкого аммиака TiCl3 образует белый кристаллический аммиак TiCl3-6NH3 и легко превращается в Амид TiClj ^ NH * 、
Композиция Ti (NH2h n KlTi (NH) t) с использованием производного 3-валентного титана hi также известна как продукт добавления определенных органических веществ к хлориду титана с общей формулой TiClj-ЗХ (X-пиридин, ацетонитрил).Например, Тетрагидрофуран. fTlClt ((Dipy) j) CI может быть использован в качестве примера немного другого типа аналогичной производной.
Фиолетовый C2H $ Tic2, также очень чувствительный к следовым количествам кислорода, был получен из dim 1 (CsHs) 2TiCll2″цеп». * 2) взаимодействие между TiClj и металлическим магнием и N2 в тетрандоне было самым высоким черным кристаллическим комплексом (TiNMg2Cl2 *THF)в составе, при гидролизе NH * выделяется. (IX§ 4) известны и другие химические системы, функционирующие таким образом. § 3) трехвалентный тиоцианат титана неизвестен, но ma [Tl (NCS) e] −611 * 0 (где M — K или NH») тип комплексной соли является obtained.
In была синтезирована водная среда, не содержащая растворенного кислорода, cahscm)*).При избытке цианистого калия образуется синий осадок состава К. * 4) безводный Ti2 (SO») a является зеленым. Не растворенный в воде, разбавленный раствор II2SO представляет собой » T1 * соль обыкновенного фиолетового цвета. Комплексные золи в основном относятся к типу M (TilSO » hl-12Н-0 (где M-Cs или Rb) и M ’(TU (SO«) si (в зависимости от природы катиона по содержанию воды в кристаллической воде).
Титан — это черное производное, подобное оксиду s, Se, Te с 3-валентностью (термическая стабильность в этом ряду снижается).Трехвалентный Титан фосфорнокислый 1. * * 5)теплота образования 3-валентного Галогенида циркония из элементов составляет 350 (ZrFj), 208(ZrClj). 174 (ZrBr3), 128 ккал / моль(Zllj).В зависимости от состава и способа получения (частичное восстановление EH-галогенидов) они описываются как вода, нерастворимая, и коричневое, синее или зеленое твердое вещество, которое постепенно разлагается ею.
Повышается легкость восстановления в серии P-CI-Br-I. аналогично, но несколько сложнее восстанавливать до H (T, SH галогенид). так, при нагревании смеси ZrCl «+ P (Zrci образуется с C1 » металлическим порошком циркония) ГФУ остается неизменным. Например, 4-валентный Титан восстанавливается до 2-валентного, в то время как ZrBr3 в жидком аммиаке высвобождает калиевый металл neknh2.При нагревании 3 галида более склонны к постоянству по схеме: 2EG, «= EG » + EG2.Очевидно, в норриджленде.
Известный как co-вариант циркония N-гафний сульфид, sslspidy-тип Теллурид E2Hz (за исключением желто-коричневого Hf2S») представляет собой сплошной черный цвет. Вода также не влияет на них при кипячении. tl) соединения двухвалентных элементов титановой подгруппы еще недостаточно изучены. Теплота образования TJ (mp 1750°C) составляет 124 ккал / моль. При нагревании компрессионной смеси TiOj + Ti в вакууме до 1700 г. до н. э. она получается в виде золотисто-желтого компакта mass. An интересным методом его образования является пиролиз титанила (высокий вакуум 1000 ° С).
Кристаллы похожи на Тио NaCl. In разбавляют серной кислотой, она растворяется с выделением запаха. Тис темно-коричневого цвета, представляющий собой металл аналогичного вида, был получен путем раскаления TiSj в потоке водорода (сначала образуются промежуточные сульфиды, в частности Ti2S3). Также известны Tise, tit C и силицидный состав Ti 2si. * 7) приведены следующие значения теплоты образования черного галогенного элемента из ЭГ элемента эга (ккал / моль). 193123 TlFj продукт tic2 TlBrj Тіл»ZrFj ZrCI» ZrBr2 Zllt 97 64430 l24100 68
Все они (и черное самовоспламенение в воздухе ШВг2) образуются при нагревании соответствующего EH-галогенида без контакта с воздухом за счет разложения по схеме: 2egl = eg4-F EG2. При несколько более высокой температуре сами ГАЛОГЕНИДЫ EG2 обсуждаются по схеме 2EGZ = EG4 4-E (например, инвариант Zll3 равен 310, а в Zrlj-430 SS). 68) дихлорид титана также получают восстановлением TiCl4 водородом при 700°C. энергия связи Ti — C1 оценивается в 120 ккал / моль.
При слиянии TiClj с хлоридом цезия и хлоридом рубидия образуется комплексная соль-CsTiCU (mp 932°С), RbTiClj (mp 852) и менее стабильная Cs? TiCS4 (Мп 747 в разложении) RbjTiCI4 (МП 732 в разлагаться). Дихлорид тнтана хорошо растворим в воде (и спирте), а в жидком аммиаке образует серый аммиак TiCI-4NHj. Раствор TiCl4 может быть получен путем восстановления TiCl4 натрием amalgam. As в результате окисления кислородом воздуха бесцветный раствор TiClj сразу же становится коричневым, затем превращается в фиолетовый(Ti*«) и, наконец, снова отбеливается (Ti::).
Черный осадок Ti (OI I) 2, который получают действием щелочи на раствор TiClj, очень легко окисляется. 69) в случае двухатомного титана циклопсададиенильные производные — (CsH5) 2Ti являются listed. It представляет собой темно-зеленый кристалл, образованный взаимодействием TiClj и CjHsNa в Тетрагидрофуране и разлагающийся при хранении на воздухе. Вследствие его частичного окисления соли катионов (CjHshTi *.
Например, коричневый (CsH5) 2TiCI(mp.283CC) получается. 70) 2 степени окисления титана также связаны со смесью карбонильных производных циклопентана ДНК (CsH $ hTi (CO)}.Это означает, что взаимодействие (CO при высоком давлении CO с C ^ HjJjTiClj и CsHjNa представляет собой темно-красный кристалл (mp 90°Cdecomp.), Не удалось получить аналогичное соединение циркония, самопроизвольно воспламеняющееся при контакте с воздухом.
71) возможность наличия карбонильных производных самого титана и его аналогов показана только в патентной литературе. Запатентованный метод восстановления Ti. Разделение Zr, Hf, Ce, Th (а также Zr и Hf) происходит за счет образования и последующего пиролиза карбонелей этих типов металлов E (CO) 7.Сообщается, что синтез из металлических порошков (небольших смесей углерода) и CO является хорошим при давлении 4-8 атмосфер и температуре около 400°C. В синтетических условиях карбины находятся в жидком состоянии.
Их температуры кипения и диссоциации увеличиваются с увеличением молекулярной массы. Более конкретно, свойства карбонола E (CO).Нет listed. In факт они могут быть получены и патентная заявка основана на оценке scheme. It было бы очень желательно применить эту схему для экспериментальной проверки. 72) интересным производным формального одновалентного циркония является графитоподобное вещество в составе ZrCl («цирклор»), которое получают электролизом расплавленного хлорида с использованием циркониевого анода.
При низкой плотности (4,0 г / см3) ток протекает очень хорошо. При 400-600°c он проявляет термопластичность, а до 1000 ° C является смазкой лучше, чем графит. 73) Ti и Zr имеют нулевую степень окисления с их комплексными дипиридильными производными (E01), полученными восстановлением хлорида ES14 в металлическом литии в Тетрагидрофуране в присутствии избытка дииндридила.
Оба являются фиолетовыми кристаллами, неустойчивыми на воздухе и нерастворимыми в воде(но растворимыми) их восстановление приводит к образованию анионов| 3Dipys)-соответствующих окислительному состоянию Ti n Zr-1. Черный Li [TiDipy3) был отделен в твердом теле state. It устойчив в атмосфере азота, но окисляется в воздухе(и при взаимодействии с водой).При дальнейшем восстановлении этого соединения металлическим литием был получен зеленый U2 | Ti (Dipy) s] −5,7 TGF (теряющий кристаллизованный ТГФ при 230°С), и степень окисления титана составила −2.
Смотрите также:
| Коллоиды | Третья группа периодической системы |
| Подгруппа германия | Бор |

