Оглавление:














Коллоиды
- Коллоидный. Кремниевая кислота, рассмотренная в предыдущем пункте, является типичным представителем веществ, характеризующихся склонностью к образованию коллоидных растворов. Поэтому, когда он отделен от Солона, обычно только часть полученного гидрата кремнезема является precipitated. By изменяя концентрацию раствора, можно выбрать условия, при которых осадок вообще не образуется, а вся кремниевая кислота останется в коллоидно-растворенном состоянии.1
- Как уже упоминалось(v§ 1), коллоидный раствор находится между суспензией размера дисперсных частиц. Руки, а потом. Между тем, молекулярные решения. При миллионнократном увеличении молекулы появляются в виде более или менее крупных точек, частицы тонкой суспензии приобретают большой размер яблока, а весь средний диапазон значений дает различную градацию коллоидного измельчения веществ. 2. Дисперсионная система, в которой частицы коллоидного размера диспергируются в данной среде, называется коллоидным раствором или ЗОЛЕМ.
Грубо говоря, коллоидным состоянием частицы можно считать размер частиц 1-100 мкм. Людмила Фирмаль
Наибольшее практическое значение для различных золей имеет гидрозоль, то есть коллоидная система, в которой средой является вода. Подобно молекулам истинного раствора, коллоидные частицы Золя имеют непрерывное случайное движение. Его интенсивность быстро уменьшается с увеличением размера частиц 、 Коллоидного раствора все же достаточно, чтобы противодействовать силе тяжести. Таким образом, коллоидные частицы из среды, в которой они распределены, непроизвольно незаметны.
Самопроизвольное высвобождение под действием силы тяжести, напротив, характерно для крупных частиц суспензии, которые отличают коллоидный раствор от внешнего. От молекулярных растворов коллоиды в значительной степени отличаются другими оптическими свойствами. Когда сильный луч проходит через стекло с коллоидным раствором, появляется яркий конус, который хорошо виден в темной комнате, в результате рассеяния света коллоидными частицами.
Напротив, казалось бы, что истинное решение, установленное в тех же условиях, является»оптически пустым».Это происходит потому, что частицы включенного молекулярного размера не рассеивают свет значительно. Наличие рассеяния света также связано с часто наблюдаемым молочным светом коллоидных растворов, то есть его нечетким появлением в отраженном свете. Четыре «» * Коллоидные и молекулярные растворы также существенно отличаются по многим другим свойствам.
Количество коллоидных частиц на единицу объема значительно меньше (при той же молярной концентрации распределенного вещества), поскольку коллоидные частицы настолько больше, чем отдельные молекулы в comparison. As в результате этого происходят изменения свойств раствора, связанные с количеством растворенных частиц (явления пенетрации, снижение температуры замерзания и др.) появляются в коллоидных растворах в очень малой степени.
Существенной особенностью коллоидного состояния вещества, которое непосредственно связано с малыми размерами частиц, является огромное развитие общей поверхности. Если представить себе куб с длиной ребра 1 см, то его объем составит 1 см3, а общая площадь поверхности-6 см2.Даже если вы раздавите этот кубик на мелкие кубики, общий объем последнего останется прежним, и, как видно из данных таблицы, его общая площадь поверхности очень быстро увеличится.
Длина ребра Куба* количество кубиков на 1 см * общая поверхность длина ребра Куба 1 количество кубиков в секунду mZ общая поверхность СМ. … 1 6 см * 1 МК… 10 ′ * 6 ** 1 мм…. I03 60 100 ММК. 。 。 10 ″ 60 100 мкм. 。 。 。 10е 600 10 ММК. 。 。 10, 600. В J0 МК. 。 。 。 10®6000 1 ММК. 。 。 10 ″ 6000 В области нормального размера коллоидных частиц (100 ММК-1 ММК) степень дисперсности вещества (то есть отношение поверхности к объему) очень велика.
Поэтому для коллоидов особенно характерны все процессы, протекающие на границе раздела 2 фаз, особенно адсорбция. Поскольку коллоидные частицы имеют размер между взвешенными частицами и молекулами, к ним можно подойти с двух сторон при получении веществ в коллоидном состоянии путем измельчения крупных частиц или, наоборот, путем образования агрегатов из отдельных молекул.
Метод генерации коллоида по первому пути называется дисперсионным методом, а по второму-дисперсионным методом. Самым простым методом диспергирования в теории является механическое измельчение исходного материала.
Таким образом специальная польза Коллоидные мельницы могут получать частицы диаметром до 10 ММК. Коллоидная мельница применяется в фармацевтической, пищевой и других отраслях промышленности. Кроме того, чаще всего используется восстанавливаемость на основе различных химических реакций, приводящих к образованию веществ, практически нерастворимых в выбранном растворе medium.
By регулируя процесс, эти вещества можно отделить в виде коллоидных частиц некоторого размера 11 * 12 По отношению к жидкой фазе, в которой они распределены, коллоидные частицы можно разделить на 2 большие группы. Их представители хорошо адсорбируют молекулы окружающей среды на поверхности, образуя с ними мощный сольватный комплекс. Такие коллоиды называют липофильными (в частности, гидрофильными по отношению к воде).
Каждая частица Лиофильного коллоида окружена связанной с ним жидкой оболочкой, и даже если отдельные частицы слипаются друг с другом, она не полностью collapse. As в результате при образовании более крупных агрегатов жидкая фаза также входит в его состав. Коллоидный представитель другой группы жидкофазных молекул не адсорбируется.
Такие коллоиды называются гидрофобными (в частности, гидрофобными по отношению к воде).в их золе отдельные частицы не окружены жидко-жидкостной мембраной, а последние не входят в образование более крупных агрегатов. Примерами гидрофобных коллоидов являются сульфид мышьяка, а гидрофильными-кремниевая кислота и оксид железа. 13 ″ 14 Коллоидные частицы могут адсорбировать другие молекулы, особенно важные ионы, присутствующие в жидкой фазе, в дополнение к веществу среды, в которой они распределены.
Поверхностные свойства одних и тех же коллоидных частиц одинаковы, поэтому все они заряжены одинаково. В основном адсорбирует катионы-положительные (положительные коллоиды), в основном адсорбирует анионы-отрицательные (отрицательные коллоиды).Особенно положительными при нормальных условиях приготовления являются гидрозоли оксидов металлов, гидрозоли отрицательно-сернистых соединений (и кремниевых).
Знак заряда коллоидных частиц можно установить экспериментально, поскольку под действием постоянного тока положительный коллоид перемещается к катоду, а отрицательный коллоид-к аноду. При изучении этого явления(называемого электрофорезом) исследуемый гидролизат помещают в нижнюю часть U-образной трубки с краном (рис. х-65), оба крана закрывают, верхнюю часть прибора очищают, заполняют водой и опускают в нее электроды.
Откройте оба крана и включите постоянный ток, чтобы начать электрофорез в трубке. Движение коллоидных частиц от одного полюса к другому особенно легко наблюдать в случае прямой окраски Соренса, обусловленной изменением уровня окрашенного слоя жидкости на обоих изгибах трубки.
Электрофорез имеет много технических применений. Например, при изготовлении фарфора глина не содержит примесей оксида железа. Этот метод предполагает, что при раскачивании глинистых частиц в воде они имеют отрицательный заряд, а частицы оксида железа-отрицательный.- Рисунок Х-65.Простейший прибор для изучения электрофореза. 20 В. В. ..Некрасов Будьте активны.
При подаче электрического тока на суспензию в аноде 1®-20 собирается очень чистая глина Из вышеизложенного следует, что в состав коллоидной частицы, помимо вещества, образующего ее непосредственно, могут входить также тесно связанные молекулы жидкой фазы и адсорбированные horse. In кроме того, в среде, близкой к частицам, обязательно не должно быть противоположных знаков. Коллоидные частицы, рассматриваемые в сочетании со всеми этими добавками, называются мицеллами, а последняя часть, содержащая только молекулы и ионы, непосредственно связанные с коллоидными частицами, — гранулами.
Например, в состав гидрозоля оксида железа, полученного гидролизом Феклов, помимо RegO3 входит вода, адсорбированная неколлоидными частицами Fe и CI, окружающими его в жидкой фазе. Общую формулу мицеллы этого гидрозоль х \ E203 выходят-г-Ф 3zC \и гранулы-х Fe20z — * / ХГО-з-Фе -.Аналогично, общая формула для мицелл в гидрофобном золе AS2S3 равна x As2S3-z SH ’+ z, а гранулы-x As2S3-g SH’. во многих случаях это выражается следующим образом: Fe — + 3Cr и AsjSa SH ’ + H Схематические рисунки таких мицелл и гранул выражают их и другие композиции только качественно.
То есть указывают их ингредиенты, но не знают относительного количества этих частей. Согласно закону всемирного тяготения, между частицами каждого Солнца существует взаимное притяжение, но силы, возникающие при этом, очень малы. Несравненное значение для возможности коалесценции между частицами имеет взаимодействие поверхностных слоев частиц (см. рис. VII-11).Однако это заметно только на расстоянии менее 1 микрона.
То есть при тесном контакте он возникает только в результате столкновений частиц в ходе случайного движения. В результате проявления когезии происходит затвердевание Золя. То есть его частицы прилипают друг к другу, и из них образуются более сложные агрегаты. При достижении известного размера частицы уже не могут поддерживать взвешенное состояние, и они не будут выделяться из среды, в которой они диспергированы — коллоидного осаждения occurs.
As как упоминалось ранее, затвердевание представляет собой процесс расширения частиц Золя, а унитизация является конечным результатом этого процесса. Однако термин коагуляция часто включает в себя и то, и другое. Наиболее важным фактором, препятствующим коагуляции, является наличие электрического заряда на коллоидных частицах.
Из-за их сходства частицы, движущиеся навстречу друг другу лишь в очень редких случаях, сходятся очень близко, так что тяговая сила может проявляться достаточно эффективно между частицами. particles. As в результате золь, содержащий высоко заряженные коллоидные частицы, заметно затвердевает даже при длительном хранении.
То есть он очень стабилен. Очевидно, что, забирая заряд коллоидных частиц (по крайней мере частично), они должны снижать стабильность Золя и способствовать его затвердеванию. Такого разряда в случае гидрозоля легче всего достичь путем добавления электролита к коллоидному раствору. Такое же количество положительных Fe203 H20 Однако в»ионной атмосфере», которая непосредственно окружает коллоидные частицы, противоположно заряженные ионы, которые в основном адсорбируются частицами, всегда имеют некоторое преобладание.
В связи с тем, что общая концентрация ионов в растворе значительно увеличивается при введении электролитов, условия для их адсорбции очень благоприятны, начальный заряд частиц быстро нейтрализуется, а золь затвердевает. Естественные процессы затвердевания с электролитами широко распространены в устьях рек. Там производимые ими коллоиды и суспензии осаждаются под действием морской соли.
Коагуляция гидрофобных коллоидов с электролитами обычно происходит достаточно легко для достижения осаждения при относительно низких концентрациях ионов. Напротив, агрегация гидрофильных коллоидов значительно затруднена, так как частицы покрыты слоем адсорбированных молекул воды, и их осаждение может происходить только при очень высокой концентрации электролитов.
Осаждение коллоидов (коагулюм) имеет различную структуру. Во время отстаивания гидрофобный коллоид переносит жидкую фазу и осаждается в виде тонкого порошка или хлопьев. Напротив, Прожидкий коллоид увлекает за собой значительное количество жидкой фазы, что определяет истинную природу осаждения. Золь некоторых липофильных коллоидов(например, желатина) полностью замерзает и превращается в студенистую массу (желе, кисель).
Такие коагулянты, включая захваченную жидкую фазу, обычно называют гелями (для воды жидкой фазой является соляная кислота).30-35 В зависимости от соотношения осадков, образующихся при седиментации и воды (или другой соответствующей ей жидкой фазы), коллоиды делятся на обратимые и необратимые. Первые осадки при контакте с чистой водой снова проходят естественным путем с образованием золы.
Таково, например, поведение гуммиарабика. Напротив, необратимое осаждение коллоидов, когда они просто вступают в контакт с жидкой фазой, самопроизвольно входит в связь. Примеры необратимых коллоидов включают кремниевую кислоту, оксид железа, AS2S3 и др.36, 57 Если необратимые коллоиды осаждаются при простом контакте с чистой водой, золь не образуется, но если к воде добавить небольшое количество электролита, то золь может быть получен.
Последние ионы, которые адсорбируются на частицах осадка, заряжают частицы одного и того же вещества. name. As в результате частицы отталкиваются друг от друга и распределяются по всей жидкой фазе. Процесс Золеобразования и необратимого осаждения коллоидов вследствие действия очень низких концентраций электролитов называется пептизацией.
Это один из 1 наиболее важных методов децентрализации для приобретения предприятия. Помимо вышеупомянутого гидрозоля, более практичной стала дисперсионная система в газовой среде, образованная твердыми частицами (дымом) или каплями жидкости (туманом).Если средой является воздух, то такая система называется aerosol. An примером аэрозоля является табачный дым (средний размер частиц 0,25 мкм).
Искусственный дым используется для маскировки военной техники, а туман ядохимикатов, растворенный в минеральном масле, является эффективным средством борьбы со многими вредителями сельского и лесного хозяйства. В высоковольтных электрических полях аэрозольные частицы подвергаются электрофорезу, достигая электрода, теряют заряд и осаждаются.
Аэрозольный электрофорез для нахождения числа Наиболее важное практическое применение для очистки газа от взвешенных в воздухе твердых и жидких веществ particles. In в некоторых случаях такую очистку необходимо проводить в производственном процессе (например, очистка S02 с контактным получением H2SO4).Другие случаи используются для улавливания различных ценных веществ, уносимых дымовыми газами. Электрофорез позволяет ускорить процесс всасывания пищи во много раз.
Наконец, аэрозольный электрофорез очень важен с гигиенической и гигиенической точки зрения, поскольку позволяет очистить выделяющиеся в воздух газы от вредных отходов. Бурное развитие коллоидной химии обусловлено важностью явления, которое эта наука изучает в самых разнообразных областях человеческой науки. Такие, казалось бы, совершенно разные проблемы, как жизненные процессы организмов, образование определенных минералов в природе, строение почвы, продуктивность, неразрывно связаны с коллоидным состоянием вещества.
Коллоидная химия также служит научной основой для многих промышленных производств (искусственные волокна, резина и др.). Добавь 1) замечательная способность образовывать кристаллы в первом, в частности, во втором, служит основой для разделения всех веществ на 2 класса-кристаллоиды и коллоиды (от греческого»Кара»-клей).
Этот отрыв был введен в 60-е годы прошлого века, еще при самом зарождении коллоидной доктрины. Но со временем становилось все более ясно, что»кристаллоид»и»коллоид»сами по себе не существуют, и одно и то же вещество получается как в состоянии»кристаллоида», так и в состоянии» коллоида«, в зависимости от условий. Например, мыло образует коллоидный раствор в воде, а в спирте это правда. Даже из типичных «кристаллоидов», таких как хлорид натрия, например, когда в качестве среды используется бензол, можно получить коллоидный раствор.
С другой стороны, можно получить много типичных «коллоидов», и соответствующие изменения в состоянии происходили в прозрачных кристаллических form. So говоря о Коллоидах, в настоящий момент они представляют собой не отдельный класс веществ, а особое состояние вещества. 2) в связи с развитием химии полимеров границы между коллоидами и истинными растворами, задаваемые размером частиц, были еще более»размыты».
- Дело в том, что вещества с высокой молекулярной массой, линейный размер макромолекулы в присутствии подходящего растворителя, значительно превышающего 100 ММК, могут образовывать истинный раствор, но агрегаты обычных молекул с гораздо меньшим размером частиц являются типичными colloids. As в результате состояние вещества в этой промежуточной области во многом определяется не самим размером частиц, а характером их взаимодействия друг с другом и со средой.
3) строго говоря, стабильность Золя обусловлена не собственно движением коллоидных частиц(или их движением под влиянием воздействия молекул среды), а постоянным самосмешением системы вследствие почти неизбежных небольших локальных изменений температуры. Поэтому между коллоидным раствором и суспензией существует не только отсутствие границ, но и четкая граница.
Согласно расчетам, в состоянии полного теплового равновесия Золя очень медленно в течение периода от нескольких месяцев до нескольких лет устанавливается распределение частиц аналогичной высоты, как и в случае суспензии (рис.111-2). Людмила Фирмаль
4) рассеяние света молекулами незначительно и заметно только в очень многих молекулах. Поскольку она изменяется обратно пропорционально 4-й степени длины волны, фиолетовые лучи рассеиваются примерно в 6 раз интенсивнее красных лучей. Неравномерное рассеяние отдельных лучей солнца молекулами атмосферного газа является причиной желтоватого (в Зените) или красноватого (на горизонте) цвета солнца небесно-голубого цвета.
5) калибровка коллоидных частиц может осуществляться различными способами.1 из них заключается в непосредственном вычислении среднего количества определенных очень малых количеств коллоидных растворов с помощью специально настроенного супер-микроскопа. Зная общую концентрацию распределенного вещества одновременно, можно легко вычислить средний размер коллоидных частиц.
Степень дисперсии можно приблизительно оценить по цвету пропускаемого света Золя. Например. Тонкодисперсный золь металлического золота имеет красивый красный цвет, а Низкодисперсный-фиолетовый color. As размер коллоидных частиц увеличивается, молочный свет Золя также увеличивается. Это также может быть использовано для приблизительных оценок дисперсности.
6) результаты исследования Золя оптическими методами показали, что в большинстве случаев коллоидные частицы не являются сферическими, а имеют стержневидную или пластинчатую форму. Рентгенологическое исследование его внутренней структуры позволяет предположить it. As как правило, это микрокристаллические структуры. Это касается и таких веществ, как кремниевая кислота, крахмал, Каучук.
7) коллоидные частицы и довольно много молекул. Но они все равно легко проходят через поры обычного фильтра paper. In напротив, мембраны многих животных и растений (бычий пузырь, пергамент и др.) проходят отдельные молекулы и ионы, но коллоидные частицы сохраняются. Это является основой метода диализа, который часто используется для освобождения коллоидных растворов от примесей веществ, находящихся в истинном растворном состоянии.
Если коллоидный раствор, содержащий TC или другие соли, поместить в цилиндр, затянутый снизу полупроницаемой мембраной, и поместить в контейнер, очищенный полупроницаемой мембраной(рис. Xbbb), растворенная соль будет свободно проходить через пищеварение, но коллоидные частицы не пройдут. Часто, меняя воду во внешнем контейнере, можно практически полностью освободить коллоидный раствор от соли, которая изначально содержалась.
8) размер пор обычной фильтровальной бумаги составляет 10 000-3 000 ММК, поэтому он легко пропускает не только все коллоидные растворы, но и мелкие частицы суспензии. То же самое относится и к»компактным»фильтрам с размером пор до 1000 ММК, которые иногда используются в химическом анализе. Обычно диаметр отверстия стеклянного фильтра находится в пределах 100 000-10 000 м. специальный фарфор и глина-до 100 ММК.
Последняя уже полностью суспендировала суспензию, но все же частицы коллоидного раствора могут проходить through. In помимо мембран животных и растений, эти частицы также связываются искусственными мембранами некоторых веществ, используемых в производстве так называемых Ультрафильтров (например, коллодия).
Самый плотный ультрафильтр имеет диаметр отверстия до 1 мкм и удерживает не только все коллоидные частицы, но и крупные молекулы истинного раствора. 9) при переходе от суспензии к коллоидным частицам вследствие повышенной дисперсности наблюдаются лишь постепенные количественные изменения свойств, после чего материал дополнительно дробится на отдельные молекулы, количественные различия становятся качественными.
Частицы суспензии и коллоиды состоят из более или менее крупных агрегатов (кластеров) молекул. Свойства агрегатов — это не только сумма характеристик отдельных частиц, входящих в него-вместе с ними будут происходить некоторые новые вещи (например, поверхностное натяжение), которые присущи агрегатам Р^ ——- -〜 Рисунок\ * 6>. P; x > самый быстрый номеронабиратель. Такой.
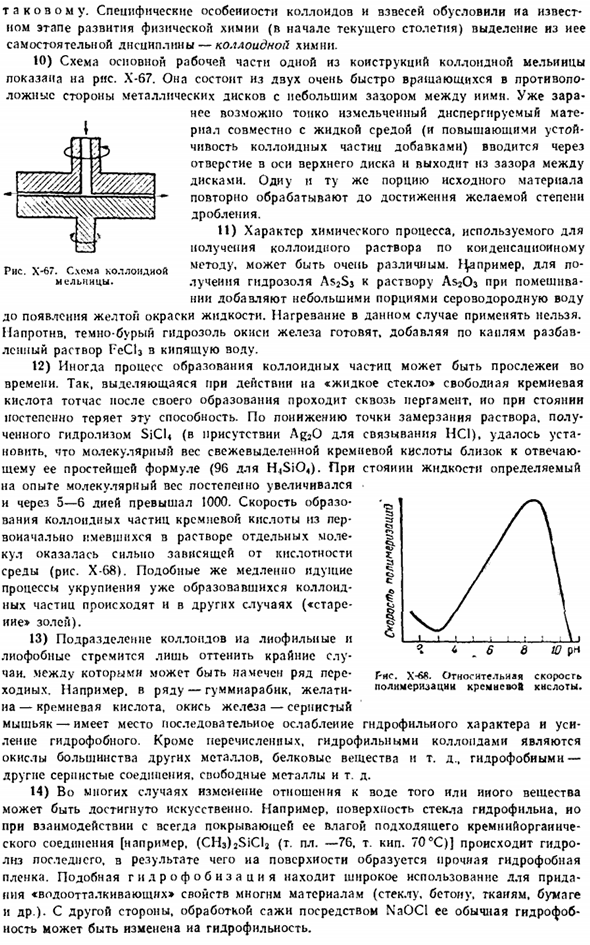
При определенных особенностях коллоидов и суспензий из определенных этапов развития физической химии(начало текущего столетия) выделилась отдельная область-коллоидная химия. 10) на рисунке показана фигура 1 основной рабочей части конструкции коллоидной мельницы. X-67.It состоит из 2-х металлических дисков, которые вращаются в совершенно противоположном направлении с небольшим зазором между images.
In предварительно, уже можно вводить мелкодисперсный материал из осевых отверстий верхнего диска вместе с жидкой средой (и добавками, повышающими стабильность коллоидных частиц) и оставлять зазор между дисками. Переработайте ту же часть исходного материала, чтобы достичь желаемой степени измельчения. И) характер химических процессов, используемых для получения коллоидных растворов методом конденсации, может быть очень разным. ^
Например, чтобы получить гидрозоли As2Sj, добавьте небольшое количество сероводорода в раствор AsjOj при перемешивании до появления жидкости yellow. In в этом случае отопление не может быть used. In напротив, темно-коричневый гидрозоль оксида железа получают путем капания разбавленного раствора FeClj в кипящую воду. 12) иногда образование коллоидных частиц можно отслеживать с течением времени. Именно поэтому свободная кремниевая кислота, выделяющаяся при действии «жидкого стекла», проходит через пергамент сразу после его образования, а оставшись необработанной, постепенно теряет эту способность.
Путем понижения температуры замерзания раствора получают SiCl и гидролиз (в присутствии AgjO для связывания HCl).Он сказал: «Это был небольшой шок. Молекулярная масса Суперсепарированной кремниевой кислоты близка к простейшей формуле, соответствующей ей (h <96 для SiO4).Когда жидкость оседала, экспериментально определенная молекулярная масса постепенно увеличивалась, и на 5-6 диадах она превышала 1000.It оказалось, что скорость образования коллоидных частиц кремниевой кислоты из отдельных молекул, которые изначально присутствовали в растворе, во многом зависит от кислотности среды (рисунок х-68).
Аналогичный медленный процесс расширения уже образовавшихся коллоидных частиц происходит и в других случаях («старение» Золя). 13) деление коллоидных и лиофитных и разреженных везикул направлено на затенение только в крайних случаях. Вы можете выделить ряд переходных процессов между ними. Например, свойства ряда-гуммиарабик, желатин-кремний, оксид железа, мышьяк-сера-гидрофильность постепенно ослабляются, а свойства гидрофобных свойств increase.
In помимо вышеперечисленных, гидрофильными коллоидами являются большинство других металлов, таких как белки, оксиды, гидрофобными-другие соединения серы, свободные металлы и др. 14) во многих случаях изменение отношения веществ к воде может быть достигнуто искусственно.
Например, когда поверхность стекла гидрофильна и взаимодействует с подходящим кремнийорганическим соединением, которое всегда покрыто влагой (например, Chshicla (mp 76, mp 70°C)), последнее приводит к гидролизу и образуется поверхностная прочная гидрофобная пленка, подобные пленки используются для»придания»свойств многим материалам (стекло, бетон, бумага, гидрофобность и т. д.).). он широко был использован для продукции высокомарочного products.
By обрабатывая сажу NaOCl, можно варьировать нормальную гидрофобность и гидрофильность. \ Вт // 5 дюймов •\ Рисунок Х-67.Схема коллоидной мельницы. Ю Р * Это хорошая вещь. X-6R. относительная скорость полимеризации кремниевой кислоты. 15) поверхность коллоидных частиц в основном адсорбирует ионы, образующие наиболее нерастворимые соединения, наряду с противоположно заряженными ионами, которые обычно входят в состав самих этих частиц (VII§ 3 add.10).
Если при образовании последних методом конденсации наблюдается избыток ионов, входящих в его состав, то такие ионы в основном адсорбируются, что придает частицам электрический заряд. Например, если гидрозоль Ag1 получен реакцией обменного разложения между AgNOj и KI, то различные ионы (Ag°. в избытке AgNOj из коллоидных частиц AG1 (NO,, K*) и Ag1 лучше всего адсорбируются. Среди различных ионов, присутствующих в растворе (q, I’, NO^, G.
It это чаще всего adsorbed. In в этом отношении АГЛ в первом случае является положительным коллоидом, а во втором-отрицательным. Обратите внимание, что » I » гораздо лучше адсорбируется на частицах Agl, чем Ag1.So, при равных концентрациях в растворе обоих ионов, Agl является отрицательным коллоидом. 16) в дополнение к адсорбции ions.
In общие термины, могут быть и другие причины, по которым заряд коллоидных частиц appears. So в некоторых случаях при выделении большого или малого количества ионов определенного заряда возможна его собственная электролитическая диссоциация, и в этом случае сами коллоидные частицы, играющие роль гигантских ионов, приобретают противоположный заряд.
Сходные свойства последних проявляются, например, с большой вероятностью у многих органических красителей. 17) причиной заряда может быть контактная электрификация. Это обычно связано с переходом пограничного слоя некоторых электронов из одной части электрона в другую, который наблюдается на границе раздела между 2 тесно контактирующими phases. As в результате фаза с меньшей диэлектрической проницаемостью заряжается отрицательно, а большая-положительно.
Например, поверхность стекла, находящаяся в контакте с водой, заряжена отрицательно. Многие коллоиды с отрицательным зарядом в воде («81»), органическом растворителе, характеризующемся малой диэлектрической проницаемостью, заряжены положительно. Подобная электрификация также происходит, когда различные твердые вещества (например, стекло на шерсти) трутся друг о друга other. In проведение некоторых производственных процессов может вызвать серьезные проблемы.
1С) фрикционная электрификация особенно связана с возникновением молний. Когда большая дождевая капля падает, она будет сплющена для сопротивления воздуха, тогда она будет разделена в малые дождевые капли и самую малую пыль воды сохраненную air. In в этом случае последний приобретает отрицательный заряд, а капля приобретает положительный charge.
As в результате дальнейшего падения капель между верхним и нижним слоями облака (а также между последними n слоями) возникает разность потенциалов и в конечном итоге достигает таких размеров, что происходит разряд (около нескольких тысяч вольт/ см).Подобная фрикционная электрификация приводит к самопроизвольному возгоранию фонтана.
Молния обладает огромной силой, но количество электричества невелико, потому что каждый разряд происходит за очень короткое время (около 1 миллиона минут 1 секунда).Видимый разряд машины обычно состоит из 5-6 отдельных разрядов, между которыми бывают очень короткие паузы, общая продолжительность которых составляет около 1,5 секунд.
Длина молнии часто достигает нескольких километров, диаметр ее канала варьируется от 1 до 20 сантиметров, преобладает высокое давление, и во время разряда оно мгновенно уменьшается, вызывая молнию. Акустический спектр молнии достаточно сложен, но ее максимальная энергия обычно сосредоточена в диапазоне частот 0,25-Т-2 Гц (ультразвуковых) и 125-250 Гц.
19) исследуя скорость движения коллоидных частиц при электрофорезе, можно оценить величину их заряда. Значения, полученные как этим, так и другими методами, в целом дают непротиворечивые результаты и, прежде всего, указывают на то, что заряд большинства коллоидных частиц значительно больше индивидуальных зарядов Ионный.
Когда размер частиц увеличивается, их заряд также обычно increases. It соответствует 2-3 единицам основного количества электричества (равного заряду электрона), поэтому для частиц диаметром 100 ММК заряд увеличивается до сотен и тысяч единиц. Несмотря на то, что это количество является объемным, по сравнению с числом атомов или молекул, образующих коллоидные частицы, оно все же очень мало. Поэтому при электрофорезе переносится гораздо больше веществ, чем соответствует законам электролиза.
20) электрофорез по своей природе близок к электрофорезу. Его суть заключается в движении жидкости, окруженной капиллярами или порами твердых тел, которые возникают под действием постоянного тока. Причиной этого явления является коконтактная электрификация жидкости, присущая ей электролитическая диссоциация поверхностного материала или неравномерная адсорбция им ионов различных знаков, в результате чего жидкость приобретает электрический заряд.
Направление движения определяется знаком этого заряда и зависит как от состава жидкости, так и от материала твердого тела, например, находящегося в контакте с водой? Поскольку он положительно заряжен стеклом, он смешивается с катодом. Электроосмос был применен на практике в нескольких технических областях. Например, с его помощью можно значительно ускорить процесс дубления кожи.
21) в эксперименте по сжатию металлического порошка можно также увидеть, насколько велика поверхностная сила: если увеличить давление (например, меди до 5000 АТМ), и отдельные частицы, вероятно, будут находиться в достаточно тесном контакте, они будут прилипать к 1 твердому куску металла. х-60.Схема коагуляции 22) частным случаем коагуляции можно считать коагуляцию Гидрофобный и гидрофильный коллоид». lescecia-слияние мелких дисперсных капель Большой. В каком-то смысле, со-активации противоположный характер.
Например, фенол-как это часто бывает в водных системах, однородная жидкость разделяется на 2 фазы (слон или капля) (от V§ 2 до 21).Существует предположение, что на ранних стадиях жизни основную роль играло клеточное голодание. 23) коагулирующий эффект электролита во многом зависит от валентности ионов, заряд которых противоположен по знаку заряду самих коллоидных частиц.
Чем выше валентность такого Ноя. Для достижения седиментации необходима более низкая концентрация. 24) изменения температуры оказывают различное влияние на стабильность Золя. Некоторые из них (например, AegBe) легко затвердевают при нагревании, в то время как другие (например, I: e2Oj) не изменяются даже после длительного кипения time.
In в целом, можно сказать, что в большинстве неорганических коллоидов нагревание значительно способствует затвердеванию.1. одной из важнейших причин этого является уменьшение адсорбции ионов коллоидными частицами при нагревании, что сопровождается уменьшением заряда. 25) для осаждения гидрофобных коллоидов, если этого достаточно для достижения в основном электрической нейтрализации частиц, слои молекул воды, окружающие их, также должны быть удалены из гидрофильных коллоидных частиц (рис. х-69).
Благодаря наличию этих слоев гидрофильные коллоиды во многих случаях очень стабильны, даже при разрядке. Осаждение такого Золя может быть осуществлено только путем более или менее полного удаления молекул воды, которые удерживаются в них из коллоидных частиц. Это достигается за счет создания значительной концентрации электролитов в растворе.
Его ионы в процессе гидратации забирают воду из частиц Золя, тем самым способствуя их затвердеванию. Подобное воздействие электролитов с ионной гидратацией на гидрофильные коллоиды (и истинный водный раствор многих органических веществ) называется солением. Последний используется во многих случаях О Получают различные органические вещества.
Наиболее известным случаем является использование соления в мыле production. In в этом случае мыло отделяют от коллоидного раствора путем добавления большого количества NaCl к коллоидному раствору. solution. As как правило, электролит действует во время засолки, тем энергичнее, чем сильнее становятся ионы. 26) Как уже упоминалось выше, валентность ионов играет наиболее важную роль в затвердевании с электролитами, но их индивидуальные химические свойства существенно зависят.
Чаще всего такая специфичность действия ионов связана с высвобождением коллоидных частиц за счет образования на их поверхности мзлодис-основы или малорастворимых соединений. Например, концентрация HCI и KS необходима для быстрого осаждения отрицательного As2s3 Золя! Связанные друг с другом. 3: 5. Более мощный коагуляционный эффект HCI обусловлен высвобождением коллоидных частиц под действием избыточных ионов водорода в результате образования недиссоциативных молекул HaS в адсорбированном слое.
Аналогично, например, более сильное коагуляционное действие на положительные гидрозоли оксидов железа, отличных от он, по сравнению с ионами SG, обусловлено образованием в адсорбированном слое малорастворимых молекул Fe (OH) j. Ионы OH расходуются на нейтрализацию ионов Fe, а не самих частиц, поэтому они только адсорбируются на них, а не на самих частицах.
При выпадении осадков выпадает гораздо больше веществ, чем соответствует равному соотношению. Железо (xFejOj-yHjO). 27) в некоторых случаях, когда электролит добавляется к Золю, коллоидные частицы перезаряжаются. То есть, знак заряда меняется. Это явление связано с тем, что после достижения состояния системы, которое вызывает разряд изоэлектрической точки, то есть коллоидных частиц, 1 из добавленных ионов селективно адсорбируется.
Например, заливка гидрозоля положительно заряженного оксида железа в раствор NaOH усилит адсорбцию ионов OH коллоидными частицами, а избыток коллоидных частиц (превышающий количество, необходимое для разряда) придаст частицам отрицательный заряд. Мицеллярный состав такого отрицательного гидрозоля оксида железа может быть представлен общей формулой jrFeaOj-yHjO-zOH ’ + * Nae.
Из-за перезарядки частиц многие коллоиды, которые затвердевают при добавлении небольшого количества электролита, не затвердевают, даже если тот же электролит присутствует в высокой концентрации. 28) разряд коллоидных частиц может осуществляться не только с помощью электролитов, но и с добавлением противоположно заряженных коллоидов.
Например, когда положительный золь оксида железа добавляется к отрицательному Золю AsjSj, частицы взаимно разбавляются и затвердевают вместе. Такое затвердевание коллоидов с помощью коллоидов имеет в некоторых случаях весьма практическое значение. 29) устойчивость гидрофобных коллоидов к действию электролитов часто значительно повышается при добавлении Золя гидрофильных коллоидов, в данном случае это называется защитой.
Сущность явления коллоидной защиты заключается в адсорбции гидрофобных коллоидов с добавлением hydrophilic. In в этом случае первоначально частицы гидрофобных коллоидов окружены тесно связанными слоями жидкой фазы. т. тип становится гидрофильным и приобретает большую устойчивость к электролитам, характерным для latter. As в результате свертывание защищенных коллоидов происходит гораздо труднее, чем незащищенных.
Защитные коллоиды также оказывают аналогичное стабилизирующее действие на суспензии.1. одним из наиболее часто используемых и фактически используемых защитных коллоидов является желатин. Коллоидная защита часто используется в промышленности (например, в фотографии) и играет большую роль в некоторых природных процессах.
Sh имеет структуру рыхлой пространственной сети, образованной силами межмолекулярного или валентного взаимодействия между коллоидными частицами. Количество Золя, захваченного при переходе в жидкую фазу геля(рисунок х-70, л) Он может быть очень большим. Например, экспериментально установлено, что вновь полученные гидрогели содержат более 300 молекул воды и каждую молекулу SiO2.
Из этого количества, очевидно, только меньшая часть прямо или косвенно связана с SiO*.С другой стороны, большинство из них заполняют пустоты гелевой структуры (рисунок х-70, пробел на рисунке 6).При длительном хранении обычно наблюдается постепенное затвердевание структуры геля(рис. х-70.Б)первая часть жидкой фазы, которая уносится, высвобождается. Это явление называется выщелачиванием.
31) искусственно полученный гель со структурой от вязкой жидкости до почти твердого желе представляет собой отожженное вещество, известное как напалм. particular. In его самая простая форма, напалм-это бензин. Отверждают смесью 4-10%солей алюминия (например, пальмитиновой кислоты) с высокомолекулярными органическими кислотами. При сжигании такого напалма возникает температура около 900°С. Введение различных добавок может существенно изменить свойства напалма.
Например, он обладает способностью самопроизвольно воспламеняться при контакте с воздухом или водой. 32) некоторые гели, если их наносить механически (например, встряхивать), легко превращаются в золь, а затем постепенно возвращаются в гель. Это явление называется thixotropy. It характерен гелеобразный гель оксида железа, который получается, например, при действии электролита на концентрацию Золя.
Примерами природных тексотропных систем являются зыбучие пески, которые разжижаются под действием приложенного к ним давления. 33) плавучесть возникает в песке, когда подстилающая вода поступает в его массив под давлением из нижнего слоя и испаряется из верхнего слоя (часто они остаются сухими).при этом песок заворачивается в водяную пленку, и сцепление между ними резко уменьшается(а объем песка увеличивается).
Если приток грунтовых вод носит сезонный характер, песок быстро перемещается только в определенное время года. year. In внешний вид зыбучих песков ничем не отличается от обычного песка. Но это работает почти так же. Как жидкость. Поэтому человек, не обремененный грузом и не совершающий резких движений, может спокойно лежать на его поверхности и даже медленно «плавать» (меньше, чем замачиваясь в воде).
34) при искусственном обезвоживании гидрогеля (например, при хранении или нагревании до эксикаторов на серной кислоте) наблюдается постепенное возвращение жидкой фазы, при котором объем геля значительно уменьшается (но только до определенного предела, после чего объем остается существенно неизменным).Последняя, наиболее прочно удерживаемая гелем часть жидкой фазы обычно может быть удалена только при высоких температурах.
35) результат обезвоживания силикатного гидрогеля (продукт-силикон(2гк.1b-это бесцветное, пористое и механически прочное вещество, образованное сферическими частицами. Размер этих частиц определяет удельную площадь поверхности и плотность ее упаковки. Пористость геля. Инфракрасная спектроскопия (в составе SiOj-НЗО) показала, что только 19% всей воды химически связано, 80% находится в адсорбированном состоянии, а 1% механически включено. Адсорбционные свойства силикагеля (VII§ 3).
Я) сильно зависит от химического состава поверхности. Обычно последняя включает в себя группу SiOH (это определяет эннлкагельскую гндрофенальность).Однако при правильной обработке водород или гидроксил этой группы могут быть заменены другими ионами или радикалами, которые придают силикагелю 1 то или иное адсорбционное свойство(в частности, гидрофобное).Для химической устойчивости, механически •• * fV2 КИЛОМЕТР Тсс. л б Рисунок х-70.Схема последовательных стадий гелеобразования.
Прочность, легкая воспроизводимость, и вероятные обширные свойства ионов Elbio широко использованы как адсорбенты (сухие газы, ловушки пара для органических соединений, etc.). ioiomeaner (разделение некоторых металлов, хроматографическое разделение смесей и др.) и носитель катализатора.
Есть обзорная статья по силикагелю 36) коллоид достаточно выражен липофильным (особенно гуммиарабик и желатин), то есть когда сцепление его частиц и молекул жидкой фазы больше, чем друг друга. Коллоиды, такие как кремниевая кислота и оксид железа, гидрофильны, но недостаточны и больше не являются reversible. In кроме того, все свободные коллоиды не являются обратимыми.
37) многие обратимые коллоиды до образования Золя, в то время как жидкофазный материал поглощает большое количество, объем значительно увеличивается. Например, подобное расширение происходит, когда желатин вступает в контакт с резиной с водой или gasoline. In в одних случаях (резина в бензине) образование Золя (резинового клея) происходит сразу после расширения, а в других (желатин в воде) нагревание необходимо для получения Золя.
38) взаимное отталкивание частиц приводит к образованию Золя только тогда, когда отдельные коллоидные частицы осадка слишком плотно связаны друг с другом. Таким образом, с помощью раствора клея можно получить золь далеко от всех substances. It часто также случается, что после вставания, вновь выделившийся коллоидный осадок легко отделяется decolorized.
As в результате более сильного прикрепления отдельных частиц раствор становится неработоспособным. С другой стороны, пептизации способствует больший заряд отдельных коллоидных частиц осадка, который приобретается ими за счет адсорбции ионов. Из-за неравномерной адсорбции различных ионов отдельными осадками природа используемого электролита имеет большое значение при пептизации.
Последнее изготовление на заказ необходимо для пептида X1 небольшое количество. Например, NaOH 1 часть по весу может диссоциировать 200 частей силикагеля. 39) при промывке осадка часто наблюдается смятие как нежелательное явление. После фильтрации раствора, богатого электролитом, в осадке остается такое же количество адсорбированных катионов и анионов. При дальнейшем контакте осадка с промытой водой несорбированные частицы частично попадают в жидкость phase.
As в результате коллоидные частицы осадка заряжаются одноименным зарядом и начинают отталкиваться друг от друга, образуя золь, который проходит через filter. To во избежание этого необходимо создать условия, способствующие свертыванию крови. То есть осадок ангидрида легко промывается чистой водой и раствором электролита.
Последние подбираются так, чтобы они не вредили дальнейшей работе, проделанной в осадке. 40) самопроизвольный аэрозоль скорость оседания во многом зависит от размера взвешенного вещества particles. So, Ия диаметром 1 мм измеряется в метрах, а диаметр составляет 10 мкм (1 мкм в секунду).Коагуляция аэрозоля происходит гораздо быстрее, чем у гидрозоля (чем он быстрее, тем меньше размер взвешенных частиц).
41) схема «электрофильтра» адаптирована для удаления пыли из выхлопных газов. Показано на фиг. Х-71.Основная рабочая часть представляет собой металлический цилиндр, ось которого отделена от стенки и натягивается грузом Кормить трофильтер. * Neymar k I. E. и достижения в области химии. I9S6,\ \ b, 748.
Провод. Последний взаимодействует с отрицательным полюсом источника питания постоянного тока, в результате чего разность потенциалов между проводом и заземляющей стенкой цилиндра составляет около 10 миллионов вольт. В этих условиях поток электронов постоянно выходит из провода, что дает отрицательный заряд частицам пыли, плавающим в Газе.
Заряженные частицы сразу же перемещаются к стенкам цилиндра, придавая ему электрический заряд. Затем частицы попадают в нижнюю камеру устройства, из которой периодически выходит пыль removed. In в дополнение к трубчатым электрическим пылеуловителям, подобным описанным выше, также применяются сетчатые фильтры. used. In в этом случае электрод представляет собой плоскую металлическую сетку, во время которой провод tensioned. In цементные, металлургические и некоторые другие заводы с электрическим пылеуловителем ежедневно улавливают десятки тонн пыли, переносимой выхлопными газами.
Смотрите также:
| Круговорот углерода | Подгруппа германия |
| Кремний | Подгруппа титана |

