Оглавление:


















Подгруппа хрома
- Подгруппа хрома. По содержаниюв коре хром (6-10 —%), молибден (3-10-4%) и вольфрам (6-10-4%) являются«довольно распространенными элементами.«Они встречаются исключительно в виде соединений. −4 Основной рудой хрома является природная хромовая руда (FeO * Cr20z).Среди молибденовых руд наиболее важным минералом является молибденит (MoS2).
- Из вольфрамовой руды-минеральный вольфрам (xFe \ V04 — / Mn \ V04) и шеелит (CaW04).Пятьдесят шесть Для получения хрома элемента удобно начинать с его оксида (Cr20z) и смеси алюминиевого порошка. Старт на отопление Реакция приравнивается к Cr203-f 2A1 = AUOj + 2 Cr + 129 ккал Молибден и вольфрам получают восстановлением оксидов углем и водородом при высоких температурах 7-8 Наиболее важные константы для них сравниваются ниже.
В компактном виде элемент подгруппы хром представляет собой блестящий металл серовато-белого цвета. Людмила Фирмаль
СГ МО ж Плотность, г / см3………….. 7.2 10.2 19.3 Температура плавления,°С……… 1875 2615 3387 Температура кипения,°С………. 2570 4830 5370 Относительная проводимость (Hg = l) 5 20 18 Очень чистый металл пригоден для механической обработки, но уже небольшое количество примесей придает ему твердость и хрупкость. Технический хром очень сложен. Молибден и вольфрам гораздо мягче.
По отношению к воздуху и воде, Cr, Mo, W очень стабилизированы в нормальных условиях. Их основными потребителями являются металлургическая промышленность, и эти металлы используются в производстве специальной стали. 9-18 В нормальных условиях все 3 металла взаимодействуют только с фтором, но при достаточном нагревании они более или менее энергично соединяются с другими типичными металлоидами.
Общей чертой их является отсутствие химического взаимодействия с hydrogen. As подгруппа 19 » 21 перемещается сверху вниз(Cr — * Mo — * W), химическая активность металла уменьшается. *Не действует на молибден, но этот металл растворяется в высокотемпературном сильном H2S04.Вольфрам устойчив ко всем обычным кислотам и их смесям (кроме HF — [- HN03).Пилы и сода по нитратной схеме Е + 3NaN03 + NaoCO.,= НС> Е04-Ф 3NaN02 +СО > | Что касается элементов подгруппы хрома, то известны соединения, соответствующие различным валентностям вплоть до VI. из них только 6 производных находят важное применение.
Более длинный элемент и трехвалентный хром, которые более важны, чем другие препараты хрома. Соединения с более низкими степенями окисления Mo и W все еще относительно слабо изучены. Производные, в которых они шестивалентный, наиболее характерны для элементов подгруппы хрома. Из триоксида (EOe), соответствующего этой валентности, при нагревании металла на воздухе образуются только бесцветный MOO3 и бледно-желтый W03.
Темно-красный CY3mo -) ket может быть получен только косвенно (на основе более сложных соединений).Все эти триоксиды являются твердыми в нормальных условиях. Cr03, который является типичным кислотным ангидридом, растворяется в воде и образует хромовую кислоту средней прочности-H2cwithw / 4.Безводная хромовая кислота является токсичным и очень сильным окислителем.
Уже при 200°С и выше они начинают разлагаться по всей схеме 4Сг03 = 2сг203 + 302 напротив, mo03 и W03 составляют около 1000°. он испаряется без разложения при температуре 24-26 Растворимость в воде Mo03 и W03 очень мала, но в щелочи она растворяется с образованием солей молибдена и вольфрамовой кислоты. Последний в свободном состоянии представляет собой почти нерастворимый порошок белого (H2Mo04) или желтого (H2 \ V04) цвета.
При нагревании обе кислоты легко разрушают воду и переходят в соответствующую триоксидную пленку 27 В серии Cr-Mo-W, прочность кислоты Н2Э04 уменьшена. Большая часть соли в них слегка растворяется в воде. Из наиболее распространенных производных металлов они легко растворяются: хром и вы-Na \ K4, Mg2 +только Атомы Ca2+, молибдата и вольфрама-только Na +и K .Хромовые соли, как правило, окрашены в ярко-желтый цвет Иона кроха; молибденовый и вольфрамовый желтый цвет бесцветны. П
Помимо кислот, таких как хром и его аналоги Н2Э04, существуют также кислоты, соответствующие общей формуле Н22Э207 и структурно сходные с пиросульфатом. Наиболее важным из них является дихромный acid-Н2СГ2О7.It сам по себе известен только в растворе, но его соли (дихроичные или дихроматные), K2SG2O-(«хромп и К«) и Na2Cr207•2H20-в частности, обычный хром o ZO W 60 ′ в NU полуфабрикатах и исходных продуктах. VHI-34.
Растворимость остальных соединений этого элемента. Способность дихроичного с 26-31 хромата-самая матовая (моль / л ч, 0).Дихромат-красно-оранжевый. Их растворимость обычно выше, чем у соответствующего хромата. Данные по натриевым и Калиевым солям приведены на рисунке. VII1-34.
Раствор дихромата представляет собой Cr. О? Реагирует с водой по схеме Н20 + КРАО / 2NSg0’4 2нв + 2SYU? Как видно из Формулы, добавление кислоты (Иона Н) в раствор смещает равновесие влево, а добавление щелочи (Иона он) должно смещаться вправо. В зависимости от этого легко получить хроматы из дихромата, например, по реакции, и наоборот. K2Sg207-f 2KOH = 2K_>СЮ4 + Н20 2K2Cr04 + H2S04 = K2S04 + K2Sg207 + H20 Соль хромовой кислоты в кислой среде является сильным окислителем (CrVI восстанавливается до Cr).
Например, есть ли они уже там? На холоде HI окисляется, а при нагревании даже реакции HBg и NSC протекают по схеме K2Sg207 + 14NG = 2KG + 2SgG3 + ZG2 + 7N20 Смесь равных количеств растворов Крсрго, которая обладает очень сильным окислительным действием и насыщается холодом? Концентрированная H2S04 («смесь xxomova») используется для мытья химической посуды в лаборатории. При взаимодействии хлора с газообразным хлористым водородом с CrO3 образуется хлористый хлор (CrO2C12), это красно-коричневая жидкость.
Соединения типа E02C12 (нормальные Твердый) также известен в МО и W. все они взаимодействуют с водой по схеме E02C12 + 2H20 ^ Е02 (о) о + 2CH1 Для Хрома равновесие смещается почти полностью вправо. То есть хлорированный хлорид (например, S02C12) является типичным хлорированным домом. Гидролиз производных Mo и W значительно меньше, что свидетельствует о наличии выраженной амфотерности в молибдате и вольфрамате acids. In в отличие от своих аналогов,
Хлорид хрома является сильным окислителем. Как уже упоминалось, из производных Cr, Mo, W с более низкой валентностью он на самом деле более важен, чем другие 3-валентные соединения хрома. Оксид хрома (Cr203) легко образуется при нагревании металлического порошка хрома на воздухе. 4Cg-f 302 = 2Cg203-f 540 ккал Это очень тугоплавкое темно-зеленое вещество, нерастворимое в воде, а также в кислотах.
Благодаря своему темному цвету и высокой стойкости к атмосферным воздействиям, оксид хрома является отличным материалом для производства масляных красок («хром-зеленый»). Как Cr203, так и его соответствующие соли обычно получают восстановлением производных шестивалентного хрома не из металлов, а из реакций, например. K2Sg207-f 3S02 + H2S04 = K2SO4 < — f Cr2 (S04)3-f H20 Среди солей оксида хрома (включая катионы Cr3) наибольший интерес представляет кристаллическое соединение темно-фиолетового цвета в составе K2SO4•Cr2 (S04) 3•24H20. Благодаря действию NH2 (S04) 3 на раствор CR4OH получается гидрат хрома[Cr (OH)
3), который несколько ниже серого, который растворяется в воде. Последние имеют ярко выраженный гермафродит features. In получают кислоты, соли оксида хрома, а под действием сильных щелочей получают соли хроматов[HC2, то есть Cr(OH) 3-H2O] и анионы Cr2, называемые хроматами. Пример: Cr (OH) 3 + ZNS1 = CrS13-f ZN20 Cr (OH) 3 + KOH = KSg02 + 2H20 Таким образом, для растворенной части гидроксида хрома одновременно происходит следующее равновесие. Cr — + von’cr (OH)3 =Н3СЮ3 ^ нсг02 + Н20 # # + Cr0i + H20
При добавлении кислоты (H) эти равновесия смещаются влево, а при добавлении щелочи (OH’) — вправо. Основные и особенно кислотные свойства гидроксида хрома довольно слабы, поэтому электролитическая диссоциация самого Cr (OH) 3 мала в обоих направлениях.
Таким образом, соли трехвалентного хрома подвергаются значительному гидролизу в растворе, и при отсутствии достаточного избытка щелочи растворимый хромит гидролизуется почти полностью completely. An примером водонерастворимого хромита является природный хромистый чугун[Fe (Cr02) 2]. В кислой среде производные шестивалентного хрома легко восстанавливаются до наиболее стабильной соли Cr3 +в этих условиях, но производные трехвалентного хрома в щелочной среде очень легко окисляются до хроматов, например, свободными галогенами, перекисью водорода и т. д. по реакции. 2KSYu2 +ЗВг2 + 8кон = 6КВГ + 2к20404+4h20cr2 (s04) 3-F 3h202 + lonaoh = 3NA2S04 + 2na2cr04 + 8h20
Однако окисление не происходит под воздействием кислорода в воздухе. Сравнивая характеристики серы и последующих элементов обеих подгрупп, основные экспериментальные данные согласуются с принципом электронного аналога: в производных с более высокой валентностью сходство серы с элементами подгруппы хрома более выражено, чем в селене и терлу. члены группы ромсубсуб теряют свое сходство с серой. Действительно, кислота Н2ЭО4 является характерной особенностью всех рассматриваемых элементов, но периодическое снижение ее прочности наблюдается только в серии S — CR — Mo — W (при этом прочность селеновой кислоты примерно такая же, как и у серной кислоты).
В селене и теллуре отсутствуют элементы сероспецифических соединений типа e02c12 и подгруппы хрома. С другой стороны, гидрид EN2, который характерен для S, Se и Te, не похож в подгруппе хрома. Аналогично, в S, Se и Te оксиды O2 и их производные H2OO3 аналогичны, но в элементах подгруппы хрома соответствующие оксиды не характерны(они обладают вполне базовыми свойствами).
Добавь 1) хром был открыт в 1797, МО-1778 и 1781.Все 3 элемента имеют монографию. • 2) природный хром, массовое число 50(4.3%)、52(83.8%、53(9.5%)、54(2.4%)、изотопы молибдена 92(15.9%)、94(9.1%)он состоит из двух изотопов. 95 (15,7%).96(16,5%).97 (9,5%).98 (23,7%).100(9,6%).А вольфрам-взвод 180(0,1%).182 (26,4%). J83(14,4%).184 (30,7%).186 (28,4%). 3) электронные структуры атомов Cr (3d * 4s) и Mo (4rfs5s) соответствуют потенциалу шестивалентного, который уже находится в основном состоянии.
Напротив, сам атом W (Sd ^ xs7) является четырехвалентным, но для возбуждения его шестивалентного состояния (5 <P65) требуется всего 8 атомов ккал / г. Ниже сравнивается энергия непрерывной ионизации (ЭА) хрома и его аналогов. Я ВТОРОЙ ЧАСТЬ IV В! 16.49 30.95 49.6 73 90.6 16.15 27.13 46.4 61.2 68 В….(14.1)(24.1)(35.4)(47.7)(60.9) Сродство атома W к электронам оценивается в 12 ккал / г атомов.
4) Наличие следовых количеств молибдена в почве явно необходимо для нормального развития растительного организма. Это особенно верно для legumes. At в то же время было установлено, что избыток молибдена в кормах крупного рогатого скота вызывает заболевания желудка, а избыток молибдена в пище человека способствует развитию подагры. * С. Л. и А. Г. .. Б е и Д з Е. А. хромовой. Эд. 2-й.
На Английском Языке. В. А. Боголюб. М..«Металлургия» 1971.360 секунды 3 е л и К А и А. Н. Бриденум. М.. Металлург 1970.440 секунд Перельман Ф. М. .. Зворыкин А. Я. Молибден и вольфрам. М..«Наука» 1968.141 секунд К. Д. см. Вольфрам. С английского, Изд. Р. Б. Котельникова и И. Д. Пакомова, М. М. Лагда, 1958.414 С. 5) ежегодная добыча хрома (руды) (без учета Советского Союза) составляет около 200 млн г, молибдена и вольфрама добывается около 5 млн тонн.
6) хром первой задачей является выбор оксидов, если вы получили элементы подгруппы. Для этого обычно используются следующие технологические схемы: хромовое железо плавится с содой в присутствии кислорода в атмосфере (4 (Fe0Cr203)- f 8NajCO » — f 70a = 2Fea03 + 8Na2Cr04 + 8C02).После этого осадок из сплава a2Cr04 превращается в Na2CraO. [По схеме 2Na2Cr04 + H2S04 = Na2S04-f — + Na2Cr207-fH20].
Последний восстанавливается до Cr203 с использованием угля [Na2Cr20; + 2C » — Cr203 + Na2COj + CO]. Реакцией[4FeW04 + 4Na2C03 + 02 = 4Na2W04 + 2Fe203 + 4C02 и 6MnW04 + 6Na2C03 + — f, полученной из вольфрама аналогичным сплавлением с содой. 02 = 6Na2W04 + 2Mn30?- F 6C02) вольфрамат натрия разлагается соляной кислотой, и освобожденный II2W04 прокаливается перед переходом в W03.Молибденит преобразуется в Mo03 путем обжига на воздухе: 2MoSa + 702 = 4S02 + 2Mo03.
7) при алюминиевом термическом производстве хрома обычно к исходному Cr2O3 добавляют исходный Cr2O3(чтобы процесс протекал более активно), в результате реакции образуются 2 слоя. Верхний слой содержит красный (следы оксида хрома) оксид алюминия, а нижний слой содержит около 99,5% хрома. Восстановление Mo03 и W03 водородом до металлов превышает 500 SS. 8) Cr, Mo и W из руд являются высокоспецифичными сплавами с железом, хотя обычно чистые металлы не плавятся.
Исходным материалом для получения феррохрома (не менее 60% Cr) является непосредственно хромистое железо. Соли молибдена были преобразованы в Mo03 раньше. Из него будет приготовлен ферромолибден (не менее 55% Mo). для получения ферротунгстена (65-80% W) помогает бедный марганец в вольфраме.
9) термический сплав рассматриваемых элементов равен 3.3 (Cg).6,6 (Mo) и 8,4 (W) атомов ккал / г, жара испарения 83 (Cg).142 (Mo) и 191 (W) ккал / г-атом, теплота распыления (25°С) −95(Cg).158 (Мо) и 204 (Вт) ккал / g-atom. At 1840°c регистрируется переход от одного аллотропа к другому (теплота перехода 0,4 ккал / г атома). 10) очень чистый хром, например, может быть получен перегонкой электроосажденного металла в высоком вакууме. Но даже если они хранятся в воздухе, следовые газы(02. N2, H2) и теряют свою пластичность.
11) введение Cr, Mo и W в состав стали значительно увеличит твердость. Такая сталь в основном используется для изготовления пушек и зазубрин. Броневые плиты, пружины, режущие инструменты. Обычно эти стали также очень устойчивы к различным химическим воздействиям. Смесь молибдена была найдена в древних японских мечах, а вольфрама — в дамасских кинжалах.
Даже малейшее добавление молибдена (около 0,25%) значительно улучшает механические свойства чугуна. 12) сталь с содержанием 15-18% W. 2-5% Cu и 0,6-0,8%C будет очень горячей без потери твердости. Если КР превышает 10%, то сталь едва ли заржавеет. Поэтому, в частности, из него изготовлены лопатки турбины и корпус морского дна. Сплав 35% Fc, 60%Cr, 5%Mo отличается своей кислотостойкостью.
Это еще более верно для сплавов Mo, содержащих W, которые во многих случаях могут служить альтернативой платине. Сплав W («Парфений»), в состав которого входит ИИ, используется в производстве автомобильных и авиационных двигателей. Сплавы на основе молибдена сохраняют свою механическую прочность при очень высоких температурах (но требуют стойкого к окислению покрытия). 13) кроме введения специальной стали, хром применяется для покрытия металлических изделий, поверхность которых должна обеспечивать большую стойкость к истиранию(например, к датчикам).
Такое хромирование выполняется электролитически, и толщина наносимой хромовой полосы обычно не превышает 0,006 мм. молибденовый металл в основном используется в электровакуумной промышленности. После этого мы обычно делаем шкентель нити Лампочка.
Наилучшую точку можно получить, поочередно опуская край тонкой молибденовой или вольфрамовой проволоки в расплавленный нитрит натрия (Xa \ 03). Вольфрам является наиболее тугоплавким из всех металлов, что делает его особенно пригодным для производства ламповых нитей, некоторых типов выпрямителей переменного тока(так называемых кенотронов) и катодов мощных рентгеновских трубок. Вольфрам также очень важен в производстве различных цементированных карбидов, используемых в качестве стружки для фрез, сверл и т. д.
14).Лампы накаливания сейчас являются основным средством искусственного освещения. lighting. To повышение КПД, температура нити накала должна быть максимально высокой(так как световой поток раскаленного тела пропорционален 4 градусам абсолютной температуры). в современных лампочках накаливания iiiiii свечение работает при температуре около 2600°С. Вольфрам возможен только благодаря своей исключительной огнестойкости и non-volatility. As это видно из рисунка VI11-35.
Отклонение определенной лампы от нормального напряжения в 1 направлении или в другом направлении(приобретенное как единица измерения) оказывает существенное влияние на ее светоотдачу и срок службы. Мировой объем производства ламп накаливания оценивается в миллиарды штук в год. 15) во время длительной работы обычной лампочки Вольфрам из нити накала будет постепенно испаряться и оседать в темном слое на стекле, а все более тонкая нить в конечном итоге сгорит.
Этот процесс «старения» может быть значительно замедлен введением в лампу следовых количеств йода. Летучий WI2, образующийся при относительно низких температурах, разлагается нагретыми нитями и возвращает в него испарившийся металл(см. VII§ 4 доп. 19).Такая «йодная лампа» может быть намного ярче обычной при очень малых размерах(из-за повышенной температуры нити накала).Они, после включения, уже работают в стационарном режиме в ’/ j секундах, передавая тепло и окружающее пространство более чем на 80% излучением.
Мощное оборудование этого типа используется в отопительных целях, и в целом йодные лампы, впервые внедренные в 1959 году, уже применяются в самых разных областях применения. Обычно они изготавливаются из кварцевого стекла и заполняются ксеноном, смешанным с парами йода (Йод в нескольких атмосферах).важно, что все внутренние металлические детали состоят только из вольфрама.
16) на практике работа широко используемого кенотронного выпрямителя основана на способности сильно нагретых металлов испускать электроны. Простейший кенотрон (рис. VII1-36) представляет собой вакуумный стеклянный цилиндр, содержащий 2 электрода.1-форма вольфрамовой спирали(/ 1).Еще один 1 выполнен в виде пластины (B).Если такие приборы с раскаленной (от отдельного источника тока) спиралью включены в цепь переменного тока, то в минусе электроны проходят через 2-й электрод, а ток протекает по внешней цепи.
Наоборот, если в спирали есть плюс, то внешняя цепь останется разомкнутой. Поэтому направление тока не меняется все время. То есть переменный ток включается непосредственно (точнее, пульсирующая постоянная).Главным преимуществом кенотрона по сравнению с другими типами выпрямителей является то, что он может быть выпрямлен с использованием очень высоких токов напряжения. Электронная функция работы составляет 4,5 ЭВ в вольфраме и 4,3 ЭВ в молибдене. Рисунок VIn-35.Относительные характеристики ламп накаливания.
17) цементированный карбид (как спобедит) обычно содержит 80-87% в, 6-15% Ко, и 5-7% К. Эти сделаны порошковой металлургией. Сущность способа заключается в предварительном спекании раскаленной порошковой смеси из порошкового сырья (в ряде случаев это сопровождается последующей механической обработкой в горячем состоянии).Поскольку спекание происходит при гораздо более низкой температуре, чем плавление данного вещества, метод порошковой металлургии часто также используется в производстве различных металлических изделий(обычно под давлением).
18) используя порошковую металлургию в частности, вы получаете материалы, которые очень важны для новейших технологий, основанных на сочетании тугоплавких материалов (обычно оксидов) и металлов. Такой материал-металлокерамика-характеризуется особой стойкостью при высоких температурах. Его состав очень разнообразен.
Например, был предложен металлокерамический материал, состоящий на 83% из CrjOj. 2% WC и 15% Ni. Никель играет роль связи между частицами 2 других substances. An важной группой кармустов является состав хрома и глинозема с высокой термостойкостью и хорошей прочностью (например, 72% Cr и 28% A1jOj). 19) электроосажденный хром содержит большое количество растворенного водорода, который прочно удерживается в металле при нормальных условиях, но может быть удален нагреванием под вакуумом.
При определенных электролитических условиях мы получаем гидриды с точным составом CrH, характеризующиеся специфической кристаллической структурой [водород координированный rf (CrH)= 1.91 A].Из газовой фазы хром начинает значительно поглощать водород только при высоких температурах. То же самое, но с гораздо меньшим объемом, относится к молибдену и вольфраму.
20) для вольфрама в то же время добавляется к reiogndrndam (VII§ 6.It получают путем восстановления \ VCI «•2L с NaBH » в метиловом спирте, белом кристаллическом веществе (разложение mp 112°C) и легко растворимом в органических растворителях. Под воздействием разбавленной соляной кислоты происходит развитие водорода с образованием исходного WCl » 2L. 21) в серии напряжений хром находится между Zn и Fe. С другой стороны, в холоде металл, введенный в HCl, не сразу начинает растворяться. Это связано с наличием на поверхности очень плотного слоя тончайшего (и потому незаметного), но химически инертного оксида (Cr20z).
- Предотвращает взаимодействие металлов и кислот. Этот оксид при нагревании растворяется в HCl и даже может быть удален простым соскабливанием с поверхности, погруженной в жидкость. Но в воздухе его пассивность возвращается к Хрому. Таким образом, хром в природе окисляется на воздухе, но на самом деле окисление незаметно, так как образующийся оксидный слой защищает металл от дальнейшего разрушения.
Образование подобной защитной пленки также связано с пассивностью хрома к азотной кислоте (и другим окислителям). Cg при раскаленной докрасна температуре. МО и W взаимодействуют с водяным паром, вытесняя водород. 22) окислительно-восстановительные потенциалы следующих кислотных (1-я колонка) и щелочных (2-я колонка) соответствуют суммарным переходам по схеме-f bg = E:+0.29 и −0.51 (Cr). 0.0 и −1.05(МО). −0.09 и −1.25 (Вт).
Пассивация под действием окислителя также очень распространена в молибдене и tungsten. Людмила Фирмаль
Изменение наиболее типичного значения хрома характеризуется следующими возможностями: Озорной…… O+2 +3 +6 Кислая среда….! −0.9 / J −0.41 / +133 J щелочная среда… −1.4! −1.1 я −0.13 | Имеется обзорная статья * об электрохимических свойствах молибдена и вольфрама. Е. Ф.. Рыболовные замеры В. Е.. Криев И. И. прорыв в химии, 1966 * ПСН: М 12. 2129. 23) все производные шестивалентного хрома являются высокотоксичными. Проникая в кожу и слизистые оболочки, он вызывает местное раздражение (может сопровождаться образованием язв), а при вдыхании в распыленном состоянии вызывает рак легких.
Предельно допустимым содержанием в воздухе производственных помещений считается 0,0001 мг / л. 24) тепло, выделяемое из элементов, увеличивается в серии CrOe (138)-MoOa (180) — WOa (201 ккал / mo1b).При нагревании триоксид молибдена (Мп.795. mp.1155 * C) желтеет, триоксид вольфрама (mp.1470°C) станет оранжевым. Первый из этих оксидов начинает заметно подниматься выше 650°С. второй-более 850°C. In пары, оба частично полуизмерены(в основном образуются молекулы E309). Для MoOz. In кроме того, для W03 известен продукт добавления фторида щелочного металла типа E03•MF (за исключением лития).Описаны также представители типа WOj•3MF(M-Cs). Rb. К.
25) в присутствии водяного пара летучесть MoO3 и W03 значительно возрастает. По-видимому, это связано с газофазной реакцией типа Е03.+ Н20 ЭО (о)*равновесие смещается вправо при высокой температуре и влево при низкой температуре. Возможно, то же самое относится и к волатильности твердого CrO3. 26) свойства промежуточного продукта термического разложения Cr03 (Мп.196°С) зависит от условий этого процесса.
Область устойчивости примерно соответствует схеме 220 2A0 370 450°C CrOj-СГ ^ ОА — > — СГ. О *- » — Cr02 — > Сг203 Отмечено наличие оксидов и более сложного состава. 27) растворимость Mo03 и W03 в воде составляет около 0,4 Р 0,02 г / л соответственно. Константа 1-й стадии кислотной n основной диссоциации H2Mo04 составляет порядка 10 3 и 10 * 1E соответственно. Вольфрамовая кислота известна в 2 формах: белая и желтая. Первая осаждается взаимодействием раствора вольфрамата с сильной кислотой, разбавленной холодом, а вторая осаждается более сильной кислотой при нагревании.
Белая форма с меньшей устойчивостью постепенно желтеет. Первый из них, по-видимому, представляет собой коллоидный осадок переменного состава (W03-xHj0), второй-специфическое соединение (H2W0 ″ — H20).Ион MoO;〜и WO; — имеют тетраэдрическую структуру с атомом E в центре(rf(MoO)= 1.77, d (WO)= 1.79 A). 28) najcr безводный более 400 х-и (Мп. Раскаление (320°C)сопровождается пиролизом по формуле. 4 > Ja > Cr207 = 4Na} CrO» — f2Cr203-F 302.Пик хрома (Мп.398 куб. см), но только при более высоких температурах. Хромат натрия и калия плавится при 790 и 968°C соответственно. Это значительно выше, чем дихромат.
Ионы CrOj, d (Croa= 1.65 A и k (CrO) 5.6 ионы Cr2Oj-OjCr-O-gGCGOCr-115e ии / C2-3-10″) намного слабее дихромата (K, -2•10″).Последний является простейшим представителем так называемой изополиевой кислоты общей формулы mH2O-LEO3 (n> m), известной в виде а salt. In кроме оранжево-красного дихромата (m = R1, l = 2), были получены темно-красный трихромат (m = 1, n «3) и красно-коричневый тетрахромат (w = I, n = 4). Из K2cg3o, 0 и Cacgях он разлагается и плавится при 243 и 210°C соответственно (переходит в K: c20?это не. Подобные, более сложные изомеры и образование солей особенно характерны для молибдена и вольфрама.
Когда состав бензойной кислоты становится более сложным, их прочность обычно возрастает. 30) бензойная кислота (100) ограничительного типа является соответствующим свободным ангидридом. Из соединений Mo03 и W03, связанных здесь, он образуется непосредственно за счет накаливания металла и воздуха. Croj игольчатые кристаллы Смесь 10% раствора KjCrjO диспергируют при стоянии с густым H * SO«(4: I по объему). 31) взаимодействие на основе схемы 4CgOe + 6HjSO «+ЗС2050Н = 2cr, (SO») 3 4. + 3CHjCOOH +9Н20 используется для обнаружения алкоголя во время выдоха.
Показателем его наличия является озеленение реагентов образованием Cr2 (S04h). 32) из индивидуальных признаков высокой окислительной активности шестивалентного хрома следует исключить взаимодействие хромовых пиков с сильной соляной кислотой по формуле: K2Cg207 + 14HC1 = 2KCI + 2CgC13 + 3C12 + 7HjO. Эта реакция протекает только при нагревании, что удобно для получения небольших количеств хлора, поскольку при прекращении нагрева прекращается образование газов.
С точки зрения методологии интересна реакция по уравнению: 2Н2СЮ4 + + 3h2soj = cr2 (s04b — f5н20.Здесь типичная соль получается из 2 кислот. Под действием очень сильных восстановителей производные Crvl могут быть восстановлены даже в нейтральной и слабощелочной среде environments. So это относится и к игрсваннанам.
Например, важная реакция аналитической химии с сульфидом аммония: 2K2Sg04 + 3 (NH4)2S + 8NgO = 2Sg(OH) 3 + 3S + 4KOH + 6N! Я » О. 33) в отличие от Хрома, шестивалентные Мо и W могут быть восстановлены только сильными восстановителями даже в кислой среде. environments. In в частности, под действием водорода в момент разделения непрерывно образуются соединения различных цветов с более низкой степенью окисления.
34) для всех элементов подгруппы хрома характерно взаимодействие персов с Н202. г. — г. р^, » к Ион s,°.» • III перекисное окисление хрома в дополнение к CrO, сам хром В кислой среде по уравнению HjCr04-f2H202=ЗНгО+ + CrO*) дает супер-нуклеотидные соли H2CrO *и h3cro§.Результаты исследования химических и магнитных свойств рассматриваемых соединений подтверждают следующие структурные формы уд: / О. <Я Х-О-СГ-О-Ч, | > КР-О — О-Ч Б 0 al4o 0 ч° — ° — н Таким образом, валентность хрома в обоих надкислот-другому.
Первая соль из них обычно синяя, а вторая соль окрашена в красный цвет. В зависимости от условий, эти или они являются formed. So если осторожно добавить 0%HgO2 к раствору KjCr207, охлажденному до 30°C, то получится сине-фиолетовый Кристалл KHgOb * H20.It разлагается медленно даже при комнатной температуре. Красно-коричневые кристаллы KjCrO *получают действием раствора k2cyo4, содержащего 30%NnO2 и большой избыток кон.
В нормальных условиях они очень стабильны и разлагаются, как только они превышают 170°C (взрывом). Structure / — структура ионов показана на рисунке. VIII-37. В водных растворах все перенаправленные соединения хрома нестабильны и быстро разрушаются за счет выделения кислорода и образования ионов CrO ^(в щелочной среде) или Cr ’(в кислой среде).
Немного стабильный перекисного окисления хрома в растворе эфира. Реакция его образования используется для обнаружения chromium. By обрабатывая аммиачный раствор хромата перекисью водорода при 0 ° С, можно получить коричневый предшественник производного состава Cr04-3NHj. Хром выглядит как квадрант. 35) производные перекисного окисления молибдена и вольфрама в основном соответствуют типу Mj30n. n варьируется от 5 до 8.
Все это получают из шестивалентного элемента, который содержит в кислой группе от 1 до 4 преоксидов-О-О-и замещает индивидуальный кислород atoms. In в частности, Красный Na2MoOe является / А> К Na2MoO получают путем воздействия 0% при 30% Н2О2 на насыщенный раствор, при нагревании он не взрывается и соединяется, но при комнатной температуре он медленно отсекает кислород и превращается в желтый Na2MoO.
В водном растворе персидские производные молибдена и вольфрама разлагаются более или менее быстро с удалением кислорода. Супер frame. In вообще, он несколько более стабилен, чем адмиолибдаты. 38) 02СгС12 молекула имеет искаженную тетраэдрическую структуру с атомом хрома вблизи центра [D (CRO) = 1.57, D(crcl) = 2.12 D. zocro =105е. ZClCrCi = 1Щ. Сцепление в нем характеризуется постоянными силами 7.2 (СУ) и 2.6 (сгс1). Хлорид хрома(Мп.97. тп.
Среди производных, подобных P6ec), хлорфторуглероды (CrOjFj) получают обработкой CrO2C12 фтором. Представляет собой коричневато-красный кристалл(Мп.30°С).При хранении самоскальзывающийся полимер превращается в беловатый полимер и растворяется только при температуре 200 ° C. бромид хрома был выделен в виде кристаллического препарата со стабильной чистотой 90% при комнатной температуре. CrO2 (ClbC00) 2. CrO2 (CuO) 2.CKMSOjFh и CrO2 (\ 03) 2.
Из других типов хромоксогалидов получается только темно-красный CrOF»(mp 5G » °C).Вышеуказанные соединения, легко разлагаются водой. 37) молибден и вольфрам образуют EOG с OXO-gald и E02G2.Среди хлоридов и бромидов, желтый Mo02C12(Мп.161°C) и\ V02C12 (mp.266°с).Зеленый Moots1 «(Мп 100°с), Красный \ Вочи»(Мп 209X. Мп.233 ″ C)и черный \ Vogr4(Мп 277°С. Кий.327 «с).Структура кристаллов „Vcl4 и“ соответствует скрученной октаэдрической цепи, соединенной кислородной сшивкой [d (wo) = 1.8 и 2.2. < / (VVCl)= 2.29. <Ф (\ВБР) −2.45 а].
Молекулы OWCI4 (пары)представляют собой тетрагональные пирамиды с 4 атомами хлора внизу, кислородом вверху и атомами вольфрама вблизи центра. Ф< / (УО)= 1.73, д(ВКТ)-2.37 А. ZClWCl = » 86е, ZOWC1 = 104 тыс.»Недавно приобрел и okgoiodiod \ V02I2.С соответствующими Галоидными солями некоторых одновалентных металлов рассматриваемые оксогальды в основном относятся к типу EO? Образует бинарные соединения г * — 2мг и EOG4-MG.
By взаимодействие S03 и Cr02C12 растворяют в хлориде сульфурила. Для всех 3 элементов подгруппы хрома MoO£C12 или WCI»был получен оксисульфат с общей формулой 30(S0″) 2.Эти соединения быстро разлагаются в воде. 38) продукт полной замены триоксида Е03 на галоген кислорода характерен только для Мо и W.
при нагревании хрома до 350°С под высоким давлением фтора (400 АГ) в качестве побочного продукта образуется очень небольшое количество лимонно-желтого crf6.Поскольку это вещество крайне неустойчиво, его свойства до сих пор не изучены. 39) фторид MoF» и WF » легко образуется при непосредственном взаимодействии металла и фтора.
Для образования пласта (жидкости) из элементов приведены значения 389 и 412 ККН / моль соответственно, а для константы прочности связи K(MoF)= * 5,0 и k(WF)= 5.1.Оба-Мофе(МП 18, Мп.35X) и WF *(mp 0, mp.17°C) бесцветен, легкоплавкий, сильно volatile. In особенно, несмотря на огромную молекулярную массу WF (почти 300).В нормальных условиях это газ. Молекула WFE представляет собой октаэдр с атомом вольфрама в центре (rf (WF)= 1.83 A).
Раствор во многих органических жидкостях имеет темный цвет color. In в отличие от SF, рассматриваемый фторид обладает высокой реакционной способностью и находится в свободном состоянии, MoOF4(mp.97, Мп.186°С) известно. WOF «(mp. PO. mp.186°C) и MoO; F2 (около 270») c возгоняет.) Как для MoF *, так и для WFe, типа EGv фторид щелочного металла(K.
Он был получен главным образом бинарными соединениями, содержащими (Rb, Cs). * 2 МФ: оба гексафторида, по-видимому, растворяются в безводном HF без химического взаимодействия. 40) для вольфрама известны соединения типа EHS, содержащие другие галогены. Темно-фиолетовый WCU (mp 281, mp 348°C) образуется из элементов при нагревании (Теплота образования составляет 163 ккал /моль) имеет октаэдрическую структуру с вольфрамом в середине 1 < / (WC1)= 2,24 л).
Легко растворим в спирте и эфире, практически нерастворим в воде при охлаждении, но легко разлагается при нагревании с образованием \ VOCl «и W02Clj. Сине-черный WBr » обладает аналогичными свойствами(теплота, получаемая от элемента, составляет 92 ккал / моль).Имеются также сообщения о формировании черных мск, которые сходны с WC1 и неустойчивы даже в присутствии следовых количеств воды.
41) для вольфрама также известен тип смешанного галогенида wfncle-B, и лучшими среди них являются красный WF и C1 (mp.-30 * С).Его молекулы имеют форму слегка искаженного октаэдра. Для константы силовой связи приведено значение k(WC1)= 2.66. РТ(ВФ) −5.46 (транс-С) или 4.62 (остальные). 42) Нсг03 Free тип Свободной кислоты неизвестен, калиевая соль описана для всех галогенов. Они образуются по общей схеме KG + Cr03 = KSYU3G(при наличии избытка соответствующей кислоты NG).
Эти галокрометры гидролизуются водой. Однако его можно перекристаллизовать из достаточно кислой среды. Наиболее часто изучаются красные флуоресцентные красители и оранжевые хлорохроматы. Для молибдена и вольфрама наиболее типичной солью является фторэлот.
Главным образом использованный для типа Mj30aF.«MjSOjFj и MjSOjFj. Здесь M-одновалентный металл. 43) сульфид Е03, соответствующий оксиду, известен только для молибдена и вольфрама. Когда сероводород переходит в раствор молибдата и вольфрамата, кислород постепенно замещает его серой, образуя ряд соединений, таких как: KjW04 K2W03S к * УО, ы, KjWOS3 KaWS4 Бесцветный желтовато-желтый желтый красный Для тетраэдрических и мусорных ионов WSJ, d (WS)= 2.17 A и ic(WS)= » 3.5 [K (MoS)= 3.2).
Подходит для всех этих типов, тиосол легко растворяется в воде. Поэтому, никакой осадок не сформирован во время передачи Хджс. Но при сильном подкислении раствора рассматриваемое соединение разрушается по схеме, например: Ka3S » — f2HC1 = HjS + 3s3-f 2kc1. MoS3 и WSa практически не растворяются в воде и выделяются в виде темно-коричневого осадка. Оба сульфида легко окисляются при нагревании на воздухе, а при нагревании, в отсутствие кислорода, сера расщепляется и превращается в сульфиды В Е $ 2.
Для молибдена были получены оба промежуточных оксосульфида (MoOjS и MoOSj).Для производства сульфохлорированного вольфрама также сообщалось-WSC1 ″ (mp.142 УК).О серных (а также селеновых и теллуровых) производных молибдена у вас есть! Обзорная статья.* 44) продукт частичного восстановления изополизола вольфрама(например, при нагревании в потоке водорода) можно считать таковым.
Вольфрамовая бронза. Простейшей схемой образования этих веществ является взаимодействие безводного вольфрама с металлическим натрием: jrNa + W03 = Na * V03 (здесь 0 <x <1).Приведенная выше формула является средней! Значение вольфрама в бронзе находится в середине между+ 6(x = 0) и+5 (x = 1).Вольфрамовая бронза-это полностью кристаллизующийся материал, близкий к металлическому блеску и металлической проводимости.
Кубические кристаллы вольфрамовой бронзы WO , образованные радикалами, имеют внутренние пустоты, а ее мелкие или крупные части (в зависимости от величины x) заполнены ионами Na. Na — + Na * — валентные электроны натрия, расщепляющиеся при переходе f, не связываются с конкретными атомами Wf <(которые перемещают их в состояние W°), а принадлежат решетке в целом (111§ 8), как это характерно для металлов.
Это является причиной известного сходства между вольфрамовой бронзой и металлом. «» В зависимости от состава, цвет вольфрамовой бронзы может быть разным. Например, сине-фиолетовый (х = 0,35).Красный (x = 0,62 дюйма) или желтый (x * Ооаловский А. А.. Федоров В. Е.. Достижения в области химии. / 96В. ст. 3. 427.、 x = 0,93), обычно очень красивая.
Такая ситуация, вкупе с высокой устойчивостью к внешним воздействиям, дает возможность использовать вольфрамовую бронзу в производстве высококачественной печати inks. In кроме натрия в состав могут быть включены и другие металлы (Li, K, Rb, Cs, Tl, Ca, Ba, Pb).Есть обзорная статья о вольфрамовой бронзе*. 45) M3M0O4 путем длительного взаимодействия молибденовой бронзы M * MoOz (m Na, K) с аналогичными блестящими цветами.
Синтезирована структура вольфрама (Rb). MoO3 и Mo, при 400-1000 ° С, под давлением 60 000 at. In часть, они были получены путем electrolysis. An примером является красный Co. MoOz и Blue Co.-Это Моуз. Было также отмечено, что бронза Li — L1O была получена в состоянии окисления от 4,3 г до 5,8 г молибдена. 46) исследуемых соединений подгруппы из пяти валентных элементов изучено относительно мало.
Вольфрамнентахлорнд получают повторной перегонкой WCIj в потоке водорода, а Мобдеинитахлорнд получают нагреванием порошка МО в потоке хлора. ДСП(mp253.Мп.288X).И MOC1 $(депутат 194, Мп.268°с) представляет собой зеленовато-черный кристалл substance. In в твердом состоянии установлена димерная структура, но в паре она имеет структуру трехходового винамила (</(MoCl) −2.27, rf (WCI)= 2.26 AJ.
Cs и другие), и для вольфрама и типа MjWCb, желтого цвета M0F5 (точка плавления 67. mp.214 ° С) и коричневый фиолетовый\ VBr $(mp.276. mp. 333 * с).Кристаллический Тетрамсрн WFS нестабилен в воздухе, около 00 * C инвариантен по схеме: 2WFs = * WF «4-WF».Как и фторид молибдена, известны нестабильные двойные соединения, содержащие метафторид щелочи. Улов (кроме лития) состав M3F пример NaMoF » [RF (MOF)= 1,74 A].
Вода WCI и MoCI разлагаются по схеме ES15 + H20 = EOS13 + 2HCl, и образуется коричневый MOOCI3 или зеленый WOCI3.Если определенный одновалентный металл присутствует одновременно в растворе хлоридной соли, то зеленое бинарное соединение, такое как \ VOCb * 2KCI и MoOCIj * 2KCI, может быть отделено от it.
In выделяли форму неустойчивых зеленых кристаллов в воздухе, свободную кислоту MoOC1e-2HC1.Производные, соответствующие тому же типу EOG3■2MG, также известны в менее изученных M0OF3, MoOBrz и Woubra. При температуре выше 200°С оксокролид черного молибдена частично разлагается и испаряется по схеме: ZMoOC13 * * MoOCU + — F MoOiClj + M0Cl3.
47) когда аммиак действует на раствор 5-валентного производного молибдена, образуется коричневый осадок MoO (OH)precipitates. By нагревая его в потоке углекислого газа, можно получить пурпурно-черные МО /с).Наличие подобных соединений в вольфраме не установлено. Производная типа M (MoO}) 1 (M = Mg. Ca. SR. Ba) получали из солей, соответствующих Mo20 $, высокотемпературным синтезом.
48) частичное восстановление высших оксидов Mo и W приводит к образованию промежуточных продуктов между eo3 и E20 $состава. Чаще всего они соответствуют формуле EpOn-x (где x = I, не очень часто 2 или 3) и имеют синий или фиолетовый цвет. Среди таких смешанных продуктов восстановления оксида EO $наиболее известным является «молибденовый синий» (благодаря специфической формуле Mo6Oi; иногда). один
49) производных 5-валентного хрома, солей типа MeSgOb*(дополнительно 34) и темно-красных солей типа MjCrOCU(где M-K. Rb. Cs. NH)) является наиболее хорошо охарактеризованным. Красно-черный CrCO313 под ними был получен взаимодействием CrO и SOjClj. It легко сублимируется в вакууме, но он стабилен только на низком уровне temperatures.
It также известно, что кулачковый тип MSgOR4 (где M-K или Ag) является сиреневым. Соответствующее в формате бинарного соединения CrOFj•0. 3C1F3 * Озеро » р. п. успех Химки. 1955 год. .V » 8, 951. Они красные OXO-fluoride. In вода, эти свойства быстро разлагаются производными Cr и Crvx. Сине-черную соль типа Ez (Cr04) 2 Ba и Sr получали сплавлением соответствующего хромата и гидроксида (реакция 1ESr04 + 2E (OH) 2 = 2E3 (CR04) g + 02-f при 800°C в потоке азота с 2HsO).Многие другие соли HjCr04(в основном зеленые) также были получены сухим методом.
Для времени CrOj приведены значения d (CrO)= 1.67 A и k (CU)= 4.9.Под действием воды или кислот эти гипокроматы разрушаются с образованием 3-и 6-валентного хрома derivatives. In оксид Cr2Os (add 20) огненно-красного цвета CrFe является основным продуктом взаимодействия элемента йода и высокого давления фтора (add 38), быстро разлагается в воде и образует желто-зеленый раствор. 50) из производного четырехвалентного хрома его черный диоксид(СУ2), по-видимому, получают не только термическим разложением cro3 (дополнительно 26), но и нагреванием CR (op) 3 на воздухе (не более 400°с).
Для синтеза чистого Кроа рекомендуется нагревать Кроакл под давлением кислорода 15-20 АТМ в течение длительного времени примерно до 400 куб. см. Высокотемпературный синтез привел к получению соответствующих зеленых солей Ba2croa, Ba5Cr05 и Sr2croa. С водой они разлагаются и становятся производными CR и CrVI. Взаимодействие CrO3 с натрием расплавленного металла привело к Na2Cr03.Зеленовато-черный CrF4 образуется при нагревании порошка хрома до 300-350 ° С с медленным фтором current.
It плавится при температуре около 200 ° С, заметно улетучивается при этой температуре(с образованием синих паров), растворяется во влажном воздухе и разъедает стекло. Также известны соответствующие двойные соединения CrF4 * 2MF и CrF4 * MF. Где M-К. Cs. Из-за взаимодействия хлора с клиренсом креатинина при 700°с, креатинина, который устойчив только в газовой фазе. При аналогичных условиях CrBr также может существовать.
51)при взаимодействии Кроэ с йодом одновалентных металлов образуются соединения MSHY.Исходя из состава, их можно считать производными Орто-кислоты четырехвалентного хрома. Однако исследования структуры показали, что на самом деле она покрыта солями М-типа (ojcroioj, то есть производным смеси йода и шестивалентного хрома).
52) хромовые аналоги диоксигена-коричневые Mo02 и W02-образуются как промежуточные продукты взаимодействия соответствующего металла с кислородом, который также получают восстановлением высоких оксидов аммиака. Они нерастворимы в воде и при нагревании воздухом легко мигрируют в триоксид. Теплота образования W02 из элементов составляет 141 ккал / моль. Почти нерастворимого в щелочи и кислоты, Mo02 проводит ток очень хорошо.
Некоторые соли соответствующих кислот были получены синтезом с высоким * — насыщением воздуха. В их состав входят формулы K2Mo03, MnMoO *(M-Ca, Sr. It представлен Ba) и MMoMo04 (где M-BA или SR). 53) основная функция диоксида соответствует четырехвалентным галогенидам молибдена и вольфрама. При нагревании в присутствии угля коричневый MoCl, образующийся в результате взаимодействия MoO2 с хлором, легко сублимируется в виде желтых паров. Его молекула имеет атомы Mo в центре и представляет собой тетраэдр С d (MoC1)=-2.23 D. mobr4 пар (</(MoBr)= 2.39 A) также имеет аналогичный structure.
In контраст, сероватый\ VCI4-это nonvolatile. It получается при нагревании VCI6 паром с сильным потоком водорода. Они очень гигроскопичны и растворяются в воде. Как хлориды, так и бромиды, соответствующие железам Cs, Kb, K-WCI4 и WBr4, гораздо более стабильны в светло-синем против темно-зеленого (\VBrC) 3 и Черного Wl4, в то время как красно-коричневый W’f4.In напротив, светло-зеленый MoF4 легко гидролизуется.2-компонентные соединения, такие как темно-коричневый MoF4•2NaF, гораздо более стабильны для воды.
Темно-зеленые двойные соединения, включая Cs, RB, K хлорид и oxocrondo MoOC12, который является коричневым стабильным против воды и соляной кислоты, известны как MoC14. «Когда мы прореагировали V02 при 500°C с HF, мы получили очень химически инертный серый оксо-фторид (VOV2). Сообщалось также о получении WOC1 *. WOBr2 и WOIj. 54) из аналогичных соединений диоксида серы в его составе MoS *присутствует в природе и является наиболее важным молибденом ore.
By реагируя с элементами нагреванием, можно получить дисульфид вольфрама (W5i).Оба сульфида нерастворимы в воде и устойчивы к воздействию воды. При нагревании на воздухе они сгорают вместе с образованием соответствующего триоксида. Дисульфид молибдена плавится только при очень высоких температурах (около 2100 ° C) и иногда используется в качестве смазки для деталей машин трения, работающих при больших нагрузках.
55) в лабораторных условиях оксид хрома (mp 2265 * 0 под давлением) получают разложением дихромата аммония. Уравнение (NHihCraO? Реакция за счет = O2O5 + N2 + 4H20 + 123 ккал) начинается при нагревании (до 280°С), но затем протекает естественным путем. 56) если некоторые оксиды металлов нерастворимы в кислотах, то они обычно превращаются в растворимые соединения путем слияния с каким-либо подходящим для этой цели веществом.1.
Последний представляет собой пиросульфат калия, который разлагается при высоких температурах с выделением SO. SO действует на оксид металла и образует соответствующий сульфат, например, по следующей реакции: Cr203+ 3KgEgO; = Cr2($ 04) 3 + 3K * S04.Оксид хрома также может быть превращен в растворимое соединение путем слияния нитрата с содой (Cr20 * + + ZKaCOe + 2Na2C03 ″ реакция 2NajCr04 + 3NaNO:+ 2CO * f) или нагреванием в растворе NaBrO(реакция 5Cg203 + 6NaBr03 +2Н * 0). = 3Na2Cr2074-2I2Cr207 + звг2).
57) соль окиси хрома главным образом использована как протрава для ткани крася и кожаного загорать Крома. Большинство из них очень растворимы в воде. water. In химические термины, эти соли-интересная тема. Цвет раствора зависит от условий (температуры, концентрации, кислотности раствора и др.): от зеленого до purple. In в частности, сине-фиолетовый цвет обычно наблюдается на морозе, а при нагревании он становится зеленым.
Такие изменения цвета связаны с различной гидратацией Io3 Cr3.In в кристаллическом состоянии большинство солей Cr3 * имеют фиолетовый цвет, но некоторые известны для обеих форм. Осаждение Cr (OH) 3 из раствора под действием щелочи начинается при рН » 5.3.Суммарная константа основной диссоциации гидроксида хрома (по схеме Cr (OH) 3 «Cr *** + ZON’) оценивается в 7-10» 3′, а константа первой стадии кислотной диссоциации (по схеме: Cr (OH),^и * + Cr02 4-H20) равна 9-10-7.
58) хромит, образующийся при растворении Cr (OH) 3 в сильной щелочи, получают только из NSg02.Но также и от более обильных форм гидроксида хрома. Некоторые соли последнего типа, например, зеленый KazCgO3•3Hi0.It был highlighted. In в растворе они могут существовать только в присутствии большого избытка щелочи (более 10), которая легко разлагается чистой водой с осаждением Cr (OH) 3.Хромиты, полученные сухим способом (сплав Cr2O *с оксидами или карбонатами металлов), получают из HCrOj в терминах химической классификации.
Наиболее известной является соль двухвалентная metal. It не растворяется в воде. Свободный HCGH представляет собой синевато-серое кристаллическое вещество, вода отделяется только около 430°C. Когда последние частицы воды теряются, при кристаллизации образующегося Cr2O3 выделяется большое тепло, которое сопровождается сильным самонагреванием массы. 59) безводный хлор хром (CrC!)3) образуется в результате взаимодействия элементов при нагревании(образуется теплота 122 ккал / моль).
OI Кристалл Corio-colistobie, который возгоняет очень легко с потоком chlorine. In вода, CrC13 (mp./ 150°C), сама по себе практически нерастворима. Однако при наличии следовых количеств CrClj или других сильных восстановителей растворение протекает быстро и сопровождается значительным нагреванием release. By выпаривая полученный раствор, можно выделить темно-зеленый кристаллогидрат CrC13-6H20, который легко растворим в воде.
Также известны фиолетовые кристаллогидраты того же состава. Томно-Зелейная » форма гидролиза гораздо мощнее фиолетовой. В хлориде Cs-d-LI Хлорид хрома, например, может образовывать кристаллическое бинарное соединение. Crc13 ″ WKO розового красного цвета (температура плавления 838°C) действует как свободное вещество. Теплота образования от исходной молекулы увеличивается непрерывно и непрерывно(ккал (моль): −0,7(Na).+ 11.0(Л), 16.0(РБ), 18.4(КС).
Зеленый цвет очень близок к CrC13 по характеристикам CrFj(mp.1200°C), черный цвет CrBr3 и Cr13.Известны также смешанные галогениды трехвалентного хрома (CriClj и Cr1Br2) и Оксо-хлориды CrOCI. 60) нитрат хрома (Cr («\’03) 3) образуется путем растворения Cr (OH) 3 в азотной кислоте. Раствор становится сине-фиолетовым в отраженном свете и красным в проходящем свете. При охлаждении исходный цвет восстанавливается очень быстро, и Cr(N03) 3 кристаллизуется в зависимости от условий, в которых количество молекул воды различно.
61) безводный c хром lCr2 (S04) 3]что-то вроде хлора, растворимого в воде только тогда, когда есть следы сильного восстановления agents. It отделяется от раствора*обычно в виде фиолетовых кристаллогидратов Cr2 (SO») 3-18Н20.Также известны зеленые кристаллогидраты, такие как Cr2 (SO») 3-6 i20, которые бедны водой. Сульфат хрома и некоторые одновалентные катионы сульфата (Na *, K .Рубидий. СЅ *, Н11 *.При одновременной кристаллизации (Tl*) образуются темно-фиолетовые кристаллы хромовых квасцов, соответствующие составу: M2S04 * Cr2 (SO») 3•241120 из них калиевые квасцы легко растворяются в воде в кожевенной промышленности (примерно 1: 4 по массе при нормальных условиях).
Кроме квасцов известно зеленое кристаллическое соединение сульфата хрома с составом Cr2 (S04) 3•H2S04-14H, 0.Также были получены некоторые аналогичные производные селеновой кислоты. 62) сульфид хрома (Cr2S3) не образуется в водных растворах, а получается путем пропускания через сухие средства, например, сероводорода, на хлор при высоких температурах.
Сульфид хрома представляет собой кристаллическое вещество черного цвета color. It практически нерастворим в течение года и только медленно разлагается. Соответствующий ему охристый натрий (Nagrs2) получают сплавлением хромовой руды с содой и серой. Многие из двухвалентных металлических тиохромитов также известны.
63) для Хрома образование специфических хроматных производных хромата очень characteristic. So за счет взаимодействия растворимого соединения Cr111 и Crvl в нейтральной среде осаждается коричневый осадок хрома хромового (Cr (0H) 2) НСг04, а при длительной промывке водой (crfohhkcro ^ Brown cr2 (СУ4) 3 (т. е. сумма crjoi2) образуется в слое воды, экстракция супероксида хрома методом экстрагирования) при нагревании смеси ангидрида хромовой кислоты с дихроматом можно получить нерастворимый в воде черный золь-щелочь металл общего состава msg4 (Cr4) 2, соответствующий структуре msg3ov.
64) образование двухкомпонентных соединений с аммиаком, фиолетовый CrC13-6. Хотя примерный в \ ’ 33, он очень характерен в производной Cr3*.Эти соединения в твердом состоянии достаточно стабильны и частично разлагаются водой с образованием осадка Cr (OH) 3 по формуле CrCb-bMNe + 6P20 ** Cr (OH) 3 + 3NH4OH + 3NI1ChS и др.
Если же, наоборот, в растворе наблюдается избыток аммиака и хлорида аммония, равновесие смещается влево, то есть к растворению Crcl3 (OD) 3 с образованием> NH3. 65) в отличие от хрома, в случае Mo и W состояние 3-валентности не является характерным и лишь немного известно из соединений, которые принадлежат здесь.
Когда moc1 $нагревается до 250°C в потоке водорода, MoC13 является formed. It представляет собой темно-красное кристаллическое вещество, которое не растворяется не только в воде, но и в соляной кислоте. Черные бромиды с аналогичным составом могут быть получены прямым синтезом из элементов, а желтоватые фториды могут быть получены взаимодействием MoP5 с молибденом при нагревании.
Путем сплавления с KF(в закрытой трубке при 800°C) был получен светло-желтый KzMoP *(mp 734 ° С).Диктор представляет собой октаэдр с tf (MoF)= 2.00 A. известна также общая формула Moog-оксогалиды молибдена. 4×20.Где G-F. C1. ВГ Трехвалентный хлорид вольфрама известен как гексамер (WCI3) e [расчетная структура (\V6Cll2) Clc) и находится в форме желто-зеленой двойной соли типа 2wci3-3MCI.、
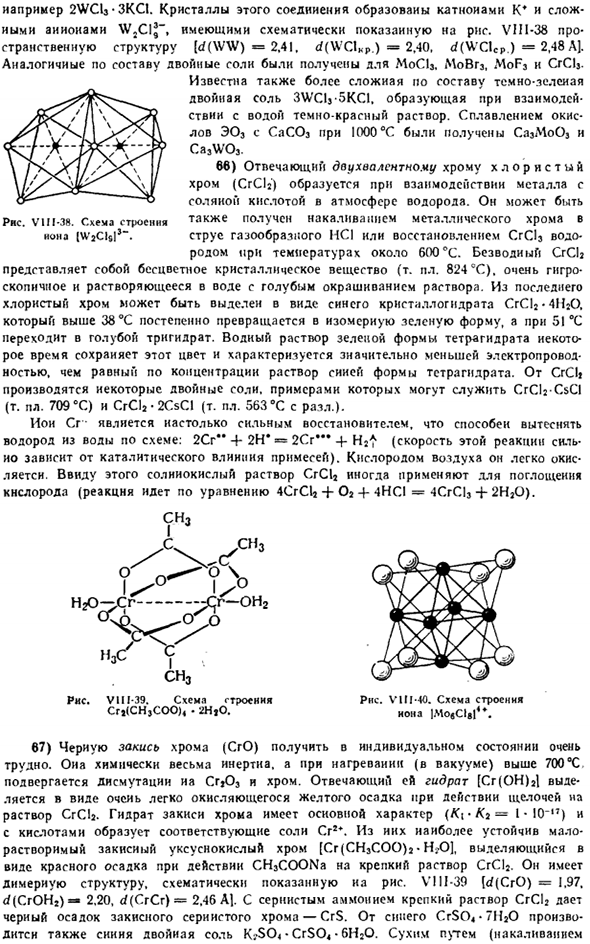
Пример: 2WCls-3KCl. Кристаллы этого соединения образованы катионами K * и WXlJ. Рисунок VIII-38 (<f (WW) 2.41.Д(WClKp.)= 2.40, d (Вклкп.2/48 ЭйДжей. Комплекс двух-компонент соли были получены для MoCls, MoBr3,MoF3 и CrClj. Более сложная, но композиционно темно-зеленая двойная соль 3WCU-5KCI также известна.
При взаимодействии с водой образуется темно-красный раствор. Путем сплавления олова оксид и CaCO3 при температуре 1000°С, CazMo03 и Ca3W03 были получены. 66) Хлорид хрома, соответствующий двухвалентному хрому (CrClj), образуется при взаимодействии металла и соляной кислоты в водороде atmosphere.
It может также быть получен путем сияния металлического хрома в газовой струе HCl или путем восстановления CrCl водородом при температуре около 600°C. безводный CrCIj представляет собой бесцветное кристаллическое вещество (mp.824°C), очень гигроскопичен и растворим в воде. От последнего можно отделить
Хлорид хрома в виде голубого кристаллогидрата CrC12-4H20.It преобразуется в зеленый изомер и, при 51°C, в синий тригидрат. Водный раствор четырех гидратов зеленого цвета сохраняет этот цвет в течение некоторого времени и характеризуется значительно меньшей электропроводностью, чем синий раствор той же концентрации. От SGS1 ″ производит некоторые двойные соли, примером которых является Crci2cci (т. пл. 709°C) и является SgS12 * 2CsCI(т. пл. C с рамкой 563°. это не так.
Ион Cr•является мощным восстановителем, который может заменить водород из воды по схеме 2Cg + 2H * * = 2Cg * * * — f H2f (скорость этой реакции сильно зависит от примесей катализатора). он легко окисляется кислородом воздуха. Из них растворы соляной кислоты CrCla иногда используют для поглощения кислорода(реакция протекает по формуле 4CrCla + 02-f 4HCl-4CgCl3 4-2H20). CH3 ХГ-СГ — — — » СГ-OH2 sn3 Рисунок VII1-39.Диаграмма VIII-40.
Структурная схема Cr *(CH, COO) 4•2H, 0. Ио, 1А / Мовс1в | 4 \ 67) очень трудно получить черный оксид хрома (CrO) у человека state. It является очень химически инертным и подвергается диспропорционированию Cr2O3 и хрома при нагревании (в вакууме) при температурах выше 700°C.
Когда щелочь действует на соответствующий гидрат [CR (OH) 2 | CrClj раствор, он осаждает желтый осадок как то, что легко окисляется. Гидраты оксида хрома обладают основными свойствами (K «-/ C2 = 1 * 10〜») и образуют кислоту и соответствующую Cr2 * соль. Наиболее стабильной из них является малорастворимая закись азота хрома[Cr (CHsCOO) 2•Н^О].она имеет димерную структуру, схематично показанную на рисунке VI12-39 в виде красного осадка, обусловленного действием CH3COONa на сильный раствор CRC (</(CrO)= 1,97.< / (CrCO2)-2.20,</(CrCr) −2.
46 а) с сульфидом аммония сильный раствор CrCl2 образует черный осадок сульфида железа хрома— CrS. Эти голубые соли к? м (лампа накаливания Ион(WsCltl9″. Металла в атмосфере Галогенида водорода), зеленый CrF2 (mp 1100°С), бесцветный CrBr2 (mp 842°C) и красновато-коричневый Cr12 (mp 796°C) были obtained. In в отличие от плохо растворимых фторидов, обе последние соли легко растворяются в воде.
Интересным является смешанный фторид Cr2F5, который содержит одновременно двухвалентные и трехвалентные атомы хрома. 68) из простого состава известны производные двухвалентных Мо и W, в основном галогеновые соединения. Желтый MoClj может стать ученым, нагревая молибден с фосгеном vapor. It практически нерастворим в воде и растворим в спирте и эфире.
Согласно рентгеноструктурному анализу, двухвалентный молибдок соответствует уравнению MobC1 / 2 со структурой [MOjC ^ JCU. In катион (Mo «С1») 4*, атом хлора находится в верхней части куба, а атом молибдена-около середины его поверхности (рис. VII1-40).Для ядерного расстояния задаются следующие значения: d (MoMo)= 2.6, d (ClCl) — = 3.6, d (MoCl)= 2.5-4-2.0 A. (OH) 4, получают специфическую кислую соль. С другой стороны, в M04CI11 известны дополнительные изделия типа Mo $ CAB-4X1.
Оранжевый бромид и черный иодид молибдена сходны по своей природе с хлоридом. Серый цвет MojSj был синтезирован путем спекать порошок молибдена с серой. Серый WCIj, который неустойчив в воздухе, получен путем нагревать WCU в потоке сухого углерода dioxide. It сильный разбавитель, и когда он взаимодействует с водой, он выпускает газообразный водород интенсивно.
Такая же характеристика характерна и для зеленовато-желтого WBr2.Коричневый \ VI2 почти не растворяется в холодной воде, но в горячей воде он разлагается. Галогенид \ UG2 также может быть получен пиролизом при 3Wr = WT2-2 \ VTe по схеме 500°C. По-видимому, они аналогичны аналогичным соединениям молибдена (рис. VIII-40), но производные neoy очень нестабильны.
69) особенно интересен двухвалентный ацетат марганца (Mo (CH3COO> 2).Это желтое кристаллическое вещество очень стабильно, поэтому оно сублимируется без разрушения при температуре около 300°C. MoO)= 2.07-g 2.12.< / (Момо)= 2,11 А).Известны и другие подобные производные органических кислот.
Смотрите также:
| Катализ | Азот |
| Подгруппа селена | Комплексообразование |

