Оглавление:











Фтор
- Фторид. На поверхности Земли, фтор содержится только в соли. Его общее содержание в земной коре 0,02% * основная масса фтора распыляется на различные породы. Среди отдельных форм природных кластеров наиболее важным минералом является флюорит-CaFj. 2.
- Фторсодержащий элемент получают электролизом фтористого соединения и выпускают в анод по схеме. 2Ф » — * 2?+ 2F — > 2 <> + F2t Электролит обычно представляет собой смесь KF-2HF (часто добавляется LiF).Свободный фтор представляет собой почти бесцветный (толстый слой зеленовато-желтого) газ с резким запахом, состоящий из двухатомных молекул.
Процесс проводят при температуре около 100°С в стальном электролизере со стальным катодом и углеродным анодом. Людмила Фирмаль
Он конденсируется до светло-желтой жидкости при −188°С и затвердевает при 220 ° С. Четыре С химической стороны фтор характеризуется как одновалентный металлоид, кроме того, он является наиболее активным из всех металлоидов. Это объясняется несколькими причинами, например, легкостью разложения молекул F2 на отдельные атомы-энергия, необходимая для этого, составляет всего 38 ккал / моль(в 02, 118 ккал / моль, в С12-58 ккал / моль).
Атомы фтора имеют большое сродство к электронам и относительно небольшой размер. Таким образом, валентная связь с атомами других элементов является более мощной, чем аналогичная связь других полуметаллов(например, энергия связи H-F составляет 135 ккал / моль, связь H-O-110 ккал / моль, связь H-C1-103 ккал / моль).От 5 до 6. Большинство металлов уже связаны с фтором в нормальных условиях.
Однако взаимодействие часто ограничивается образованием плотной поверхностной пленки фтористых соединений, которая защищает металл от дальнейшей коррозии. Например, Cu, Ni и Mg ведут себя так. Поэтому мы видим, что это практически стабильно для фтора (если нет воды). Поскольку фторидные производные металлоидного элемента обычно летучие, их образование не защищает поверхность металлоида от дальнейшего действия фтора.
Поэтому взаимодействие с металлоидами часто протекает гораздо более энергично, чем со многими металлами. Например, кремний, фосфор и сера воспламеняются с газообразным фтором. Аморфный углерод (древесный уголь) работает аналогично, но графит реагирует только при раскаленных температурах. Фтор не связывается непосредственно с азотом или кислородом. Водород удаляет фтор из водородного соединения других элементов.
Большая часть оксидов разлагается ими путем замещения oxygen. In в частности, вода будет взаимодействовать по схеме F2 + H2Q — > 2HF + O Кроме того, замещенные атомы кислорода не только связаны друг с другом, но и частично с водой и фтором molecules. So, помимо газообразного кислорода, в ходе этой реакции всегда образуются перекись водорода и оксид фтора (F20).Последний представляет собой бледно-желтый газ, похожий на озон из 7-11 Практическое применение свободного фторида было разработано относительно недавно recently.
It расходуется в основном на фторирование. * Данные о распространенности элементов выражены в атомных процентах (см. II§ 3). Органическое соединение (то есть замещение водорода фтором).Этот процесс стал очень важным, поскольку многие органические производные фтора обладают очень ценными свойствами. Фтор также необходим для производства соединений инертного газа.
В отличие от свободного фтора, фтористый водород (HF) и многие его производные использовались в течение длительного времени. Прямое соединение фтора и водорода сопровождается значительным нагревом. H2 + F2 = 2hf-f 130 ккал Реакция обычно протекает при сильном охлаждении газа и взрыве, который происходит даже в темноте. Этот прямой синтез не имеет практического значения для генерации КВ, но, как правило, его можно использовать для создания реактивной тяги.
Промышленное производство фтористого водорода основано на взаимодействии CaF2 и концентрированного H2SO4 посредством реакции. CaF2 + H2S04 = CaS04 + 2HFf Процесс проходит в сталеплавильной печи при температуре 120-300°С. части установки, используемые для поглощения HF, изготовлены из свинца. Плавиковая кислота (фтористый водород) — бесцветная, подвижная, летучая жидкость (т. При температуре + 19.50°C), смешать с водой в любом соотношении.
Появляется резкий запах, в воздухе развивается дым (за счет образования капель водяного пара и раствора), который сильно разъедает стенки дыхательных путей. Многие неорганические соединения хорошо растворимы в жидком HF, и раствор обычно является проводником тока. Химическая активность HF в значительной степени зависит от наличия или отсутствия воды. Сухой фтористый водород не влияет на большинство металлов.
Он не вступает в реакцию с оксидами металлов. Однако если реакция с оксидом начинается хотя бы в малой степени, то она продолжается некоторое время при самоускорении в результате взаимодействия по схеме МО + 2НР = МФ2 + Н20 Количество воды увеличится на 22 Аналогично фтористый водород действует на оксиды некоторых металлоидов. Практическое значение имеет взаимодействие с диоксидом кремния-диоксидом кремния (песок, кварц), входящим в состав стекла.
Реакция протекает по схеме Si02 + 4HF = SiF4 | + 2H20 Поэтому фтористый водород нельзя хранить в стеклянной таре. Использование фтористого водорода для травления стекла основано на взаимодействии между HF и SiO2.In кроме того, из-за удаления частиц SiO2 его поверхность становится тусклой и используется для маркировки стекла различными знаками, надписями и т. д. Двадцать три В водных растворах HF действует как одноосновная кислота средней прочности. Этот коммерческий раствор плавиковой (он же плавиковая) кислоты обычно содержит 40% HF. 24-27.
Плавиковая кислота (фтористая кислота) в большинстве случаев бурно реагирует с большинством металлов. Однако во многих случаях реакция протекает только на поверхности, после чего металл становится Он защищен слоем образующихся нерастворимых солей и защищен от дальнейшего действия acids. In в частности, свинец действует таким образом, поэтому свинец может быть использован при изготовлении компонентов оборудования, устойчивых к действию КВ.
Соли плавиковой кислоты называются фторид или фторид. Большинство из них слегка растворяются в воде. Из производных наиболее распространенных металлов хорошо растворимы только фториды Na, K, Ag, Al, Sn и Hg. Все соли плавиковой кислоты ядовиты. При соприкосновении с кожей образуется ожог, который сам по себе болезненный и трудно заживающий (особенно под ногтями).Поэтому плавиковую кислоту следует использовать в резиновых перчатках. Фактическое применение HF очень разнообразно.
Безводный фтористый водород главным образом использован в органическом синтезе, плавиковая кислота использована для произведения фторида, стеклянного вытравливания, удаления песка от металла лития, минерального анализа, ЕТК. Фторид, который рассматривается в соответствующем отшельнике, также широко используется. Добавь 1) фтор является «чистым элементом» — состоит только из атомов, eF. It впервые был обнаружен в плавиковой кислоте (1810).
Попытки изолировать этот элемент долгое время не увенчались успехом, но был получен только фтор. В 1886 году выходит монография по химии фтора. • 2) большая часть фтора на поверхности Земли происходит из-за его происхождения в горячей кишке Земли (где этот элемент был выпущен с водой в виде HF).Среднее содержание фтора в почве составляет 0,02%, в речной водной зоне-0,00002%, в морской зоне-0,0001%.
Организм человека содержит соединения фтора, в основном в зубах и костях. Около 0,01%фтора попадает в зубчик, и большая часть этого количества попадает на эмаль (состав близок к Savr (P04) h). в некоторых костях содержание фтора значительно отличается. Накопление фтора не является обычным явлением в растительных организмах. Растение относительно богато луком и чечевицей. Нормальное поступление фтора в организм с пищей составляет около 1 мг в 1 день.
Установлено, что содержание фтора в питьевой воде в значительной степени влияет на состояние зубов людей (и животных).Оптимальным является наличие фтора, который составляет около 1 мг на 1 литр. При содержании менее 0,5 мг (л способствует развитию кариеса зубов, более 1,2 мг / л-пятна на зубах). enamel. In в обоих случаях зубы более или менее быстро разрушаются. 3) Удобная лабораторная установка для производства фтора показана на рисунке. VI1-1.
Легкоплавкую смесь в составе KF * 3HF помещают в электролиз и помещают во внешний медный сосуд A. It действует как катод, а анод из толстой никелевой проволоки помещается в медный цилиндр B. выделившийся фтор выводится из трубы B(водород выводится из патрубка D).Все стыки отдельных частей устройства выполнены заглушками из CaF>и PBO и глицериновой замазкой. Четыре 4) критическая температура фтора −129°C, критическое давление 55 atm.
At температура кипения, плотность жидкого фтора составляет 1,5 г / см1,а теплота его испарения-1,6 ккал / моль. Жидкий фтор, и смеси с жидким кислородом * Рысс И. Г. химия фтора и его соединений. М. Госхимиздат, 1966, 718 С. В Г СМ Двадцать- Ага. Ряса. VII I. электролизер для производства фтора. («Флокс»), служит сильным окислителем реактивного топлива. Фтор не вступает в реакцию с SiO2 и стеклом.
При охлаждении ниже −252 ° С желтоватые кристаллы обесцвечиваются. 5) потенциал ионизации молекул F *составляет 15,8 Э. связи F-F характеризуются ядерным расстоянием 1,42 а и постоянной силы 4,5.Для термической диссоциации фтора расчетным путем были получены следующие данные. Температура. Это хорошая вещь……….. 300 500 700 000 1100 1300 1500 1700 Степень диссоциации. К…… 0.0005 0.3 4.2 22 60 88 97 99 6) атомы фтора основного состояния имеют структуру внешнего электронного слоя 2S, 2p5 N одновалентную.
Возбуждение 1 2-3 валентного состояния, связанного с переносом одного 2P электрона на уровень 3s, требует 293 ккал / г атомов, что практически не реализуется. Энергия непрерывной ионизации фтора имеет следующие значения (эВ): I II III IV V VI VI VI VII 17.42 34.98 63.85 87.14 114.21 157.12 185.14 Сродство нейтрального атома фтора к электронам оценивается в 81 ккал / г атомов. Окружность F характеризуется эффективным радиусом 1,33 а и энергией гидратации 116 ккал / г ions.
In за общий радиус фтора обычно берется величина 0,71 а (половина расстояния между ядрами молекул ФА). 7) оксид фтора (иначе-фторид кислорода-Офа), 0,5 и раствор NaOH. Реакция протекает по следующему уравнению: 2Fa-f 2.N’AOH = » = 2NaF-f H, 0-F FjOf. Числитель ФАО представляет собой структуру равнобедренного треугольника [//(FO)= * 1.41 A, Z. FOF =103е]и имеет малый дипольный момент (μ<= 0.30).Для средней энергии связи o-F дается 46 ккал / моль, а для константы ее прочности k = 4,0.
При охлаждении до −145°С оксид фтора конденсируется в желтую жидкость (плотность 1,5 г / см1) и затвердевает при −224°С. Критическая температура воздуха −58°C, критическое давление-49 атмосфер. Жидкая окись фтора смешивается в любых соотношениях с жидкими ОА, ФА, апельсиновый сок, большое количество воздуха? Его можно растворить в воде. Несмотря на эндотермическую природу ФАО (теплота образования-6 ккал / моль), она все еще относительно стабильна.
Например, он не разлагается при нагревании до 200°С (энергия активации пиролиза составляет 41 ккал / моль).Оксид фтора практически не разлагается в холодной воде и плохо растворим (0°С 7: 100 по объему).Напротив, в щелочной среде (nl под действием восстановителя) разложение FjO протекает довольно быстро. При нагревании происходит детонация смеси водяного пара и взрывчатого вещества (реакция протекает по уравнению 2 +Н20″= 2HF-f 02-f 78 ккал).Оксид фтора является сильным окислителем и очень токсичен.
8) как и ангидриды, фторстатическая кислота (HOF), которая официально соответствует FaO, частично образуется при взаимодействии медленных токов фтора под пониженным давлением с охлаждающей водой. Выделяют только в очень малых количествах (порядка мг) и довольно быстро при нормальных условиях бесцветное вещество с высоким давлением паров (5 мм рт. ст. уже −64°С) (МП.-117°С).
Коррупция ВЧ и ОА. Молекула HOF характеризуется следующими параметрами: rf (OH)= 0,96. rf (OF) 1.44 A. ZHOF = 97e. кислоты, содержащие фторид, очевидно сильны, но они быстро гидролизуются в воде. В основном уравнение: HOF + HOH = HF + H202.Соль не получена, но известен продукт замещения металлоидного радикала его водородом, то есть вещество, которое можно рассматривать как гипофлуоролит этих радикалов.
9) подобно самому фтору, его оксид является одним из возможных активных окислителей реактивного топлива (II§ 3 add.9).Например, если в качестве топлива используются углеводороды C * Nap, а в качестве окислителей-жидкости F2 и F20, то относительные (Оа = 1) значения удельного импульса и скорости ракеты рассчитываются при F2: 1,05 и 1,2 или 1,16 и 1. 4 для FjO. 10) под действием Тихого разряда газообразной фтор-кислородной смеси, охлажденной жидким воздухом, образуется оранжево-красный кристалл состава FaOa(mp 163 * C).
Этот оксид (дифтордоксид) стабилен только ниже-SOX, а при дальнейшем нагревании он начинает разлагаться на элементы. Изученное при очень низких температурах взаимодействие с различными другими веществами, как правило, протекает очень бурно (часто со взрывом). Молекула FaOa полярна (q = » 1.44) и аналогична по структуре молекуле перекиси водорода (рис.1В-27).Параметр d (FO) характеризуется значением 1.58 A. d(00) » 1.22 a, ZOOF » =110е, приблизительно 88°угол между связями F-O.
Поскольку< / (00) молекулы ОА составляет 1,21 а, можно предположить, что внутренняя структура значительно искажена добавлением 2 атомов фтора (то есть формула F-0″0-F, содержащая 4 атома кислорода, соответствует дифторгиоксиду), а энергия связи 00 и OF оценивается как 135 и 18 кал/ соответственно. 11) гомологи Fa0 и F / Oa являются оксидами фтора общей формулы FtO*.Где n = 3, 4, 5, 6.
Они были получены при температуре порядка −200°С, путем действия Тихого разряда на смесь сильно разгерметизированного фага и кислорода (например, синтез Fa0 составляет −210°С и около 1 мм). все эти фторидные полипеллоксиды являются стабильными и очень сильными окислителями при очень низких температурах (например, Fa0″-200°C). это жидкое или твердое красновато-коричневое вещество.
Интересно, что FaOj нерастворим в жидких Oa и Fa(в отличие от FaOa). ФАО » (Мп. Для константы силовой связи −191®С) значения k (ОО)= 10,8 и K (of) » = 1,6 являются given. It следует отметить, что рассматриваемые вещества еще недостаточно изучены, и индивидуальное существование некоторых из них (особенно FaOj) вызывает сомнения. Есть обзорная статья о фторидном кислороде. ф 12) с общей химической точки зрения производные фтора являются фторидами инертных газов(II§ 2).
Наиболее хорошо изученные соединения ксенона могут быть получены из элемента нагреванием, под воздействием разряда или ультрафиолетовых лучей. Ксенона фториды-xef * — и KRF XeF4 и xef * — и KRF-бесцветны. Легко сублимировать кристаллическое вещество. Интересно, что их средняя энергия связи Xe-F примерно одинакова (31,8-f-30,6 ккал / моль).
Они легко растворимы в жидком фтористом водороде (XeFa, XeFe) или умеренном (Xefa) и расположены в ряд в соответствии с их направленностью: XeF4 XeFa <XeF * фторид ксенона разлагается с water. In процесс гидролиза желтого цвета обычно происходит, а затем исчезает. Диоксидин образуется медленно под действием солнечного света даже в смеси Хэ и ФА при нормальных условиях (образуется тепло 42 ккал / моль).
OI имеет характерный тошнотворный запах. Его давление пара составляет около 3 mmHg. Art. In нормальные условия и 760 мм рт. ст. Теплота сублимации при 155°с (с реакцией по схеме 2XeFa — Xe■+■XeF4) составляет 12,3 ккал / моль. Кристаллическая структура xefa (mp 129°C) показана на рисунке. VII-2, молекула XeFa линейна, а ее потенциал ионизации равен 11,5 э.
По-видимому, они имеют сильно выраженные характеристики Jorah (P (XeF) по грубой оценке 0,5 J. для образования этих связей необходимо возбудить атом ксенона от его обычного нулевого валентного состояния (5 $ * 5p6) до ближайшего двухвалентного (1), требующего значительных энергозатрат (до 5 секунд* 5 p * bst), и возбудить атомы 192 ккал / г. *
Никитин И. В. В О 1 в р, В О 1 В А. В. И. ..Успехи химии, 1971, м. II. Одна тысяча девятьсот тринадцать、 Структура XeFa. 221 ккал / г атом-Max 5s5p * 6p или 228 ккал / г атом-Max bs * $ p> bd). Растворимость XeFj в воде составляет около 0 градусов при 0,15 моль / л. раствор является окислителем, а потенциал системы Xe XeF2 в кислой среде составляет 2,2 вольта.
- Саморазложение раствора по схеме 2XeF3 4-2HjO = 4HF — + * 2Xe-f-Oj происходит медленно в кислой среде, но очень быстро в щелочной среде. Тетрафторэтилен образуется из элемента с довольно большим тепловыделением (60 ккал / моль) и является наиболее стабильным из всех фторидов ксенона. Его молекула имеет квадратную структуру с атомом XE в центре, а связь Xe-F характеризуется длиной 1,95 а (в кристалле) или 1,85 а (в газообразном).
Полярность p (XeF)= 0,4 (приблизительно). Art. In нормальные условия и 760 мм рт. ст. При 146°C теплота сублимации составляет 15,3 ккал / моль. Xeiontetrafluoride сформирован с Xefaxef4, аддуктом Кристалла xefa, но не взаимодействует с KF или BF3.Фтористая ртуть(XeF4-f2hg = 2HgF * — Ф-Хе), HF растворов фторированных платины, а также(Электроионизационный»+ Пт ПТФ * -Ф-Хе).
Давление пара составляет около 3 mmHg. Людмила Фирмаль
Йодид калия(в растворе) количественно реагирует по формуле 4Kl-f-XeF4 =; = 4KF + 2b + Xe, что находит аналитическое применение. Под действием воды XeF разлагается по схеме ZXe » v = Xe0-f2Xevl («кислотная среда») или 2Xe’v = Xeo + Xevl (щелочная среда). Описан также оксо-фтор-XeOFj, который образуется (в виде небольшой смеси) при нагревании смеси Xe и Fj, сильно разбавленной кислородом или воздухом.
Приведены следующие константы: температура плавления 90°С и температура кипения-около 115 ° С. В этом же составе предполагается наличие ярко-желтого продукта гидролиза XeF, который конденсируется с водяным паром при температуре −80 ° С. C. It сообщалось, что это же вещество явно образовалось. — В результате взаимодействия Xe при i8°С с большим избытком FaOj.
Однако наличие OXeFj еще не считается детерминированно установленным. 3 различных кристаллических преобразования, бесцветный гексафторид кальцифицируется. Он плавится при температуре 49 ° C, что приводит к низкой диэлектрической проницаемости желтой жидкости (55°C = 4,1).В том числе и явно Ассоциация тетрамеров. Когда затвердеет, XeF снова станет обесцвеченным.
Давление пара (светло-желтого цвета)составляет 30 мм рт. ст. При 25°C и 760 мм рт. ст. 76 в вк. Ксеногексафлуорон обладает высокой химической активностью и может разрушаться при взрыве. Структура его молекулы еще не определена точно, но известно, что он не обладает»октаэдрической симметрией», характерной для соединений типа 3F.
Среднее расстояние rf (XeF)= 1.90 A Растворение XeFe в жидком фтористом водороде сопровождается частичной электролитической диссоциацией по схеме: XeF6-f HF XtF ^ + HF. Насыщенный в нормальных условиях раствор имеет состав примерно соответствующий формуле XeFe-6HF. In в отличие от тетрафторэтилена, XeF » образует твердые аккреционные продукты, включая как BFj, так и фторированные щелочные металлы. Бесцветный Na2XeF * разлагается при 100°C или меньше, но Cs2XeF% разлагается при 400°C или больше.
Гораздо более нестабильные соли, такие как MXeFv. Поэтому введите желтый CsXeF; кремовый CsjXeF. Уже при 50 ° С. Все эти золи очень химически активны и бурно реагируют с водой(кроме того, Xe, как и XeOa, удерживается в растворе). Под воздействием влажного воздуха ксеногексафторид частично разлагается с образованием Оксифторида Оксефа. Последняя представляет собой бесцветную жидкость (Мп.- 46, mp. At 102°C), он менее реактивен, чем XeF. It смешивается с жидким фтористым водородом и образует следующие соединения с тяжелым фторидом щелочного металла: 3KF * XeOF4,3RbF-2XeOF4, CsFXeOF4.
Молекула OXeF4 равна q = 0.65, структура четырехугольной пирамиды с атомами Xe вблизи середины основания из 4 атомов фтора[d(XeO)= 1.70, d(XeF)= 1.90 A.£92 для силовой постоянной связи приведены значения k (XeF)= 3.2 и k (XeO)= 7.1. Дальнейший медленный гидролиз XeOF4 (или гидролиз XeF в неизменной кислой среде по схеме ZXe * 4Xe°+ 2Xe * 6) приводит к образованию ксенонотов. Oxide. It может быть отделен в виде взрывоопасных бесцветных кристаллов, которые распространяются в воздухе.
Теплота образования элементов xeo » ZZ составляет −96 ккал / mol. In в сухом состоянии это мощное вспомогательное термическое соединение может разлагаться при взрыве, а при медленном нагревании выше 40°C разложение до Xe и O происходит плавно (заканчивается при J40°C). Молекула XeOj имеет форму треугольной пирамиды с атомами Xe на вершине (rf(XeO)= 1.76 A,^ OXeO =1031.Для средней энергии связи xeo приведено значение 28 ккал / моль.
Взаимодействие XeO3 и XeOF было получено с помощью XeOaFa. Этот оксо-фторид представляет собой бесцветный кристалл (mp. 31°C). во влажном воздухе oi гидролизуется до XeOj, а в сухом воздухе он медленно разлагается на XeFa и O*.Структура их молекул четко соответствует формуле M (XeO3P. фторид термически стабилен до 200°C.
Триоксид ксенона легко растворяется в воде, но лишь слабо взаимодействует: равновесие по схеме NaO + XeOz * * NaXe04 * * H — + HXeO{сильно смещено влево. при рН> 10,5 образуются соли типа mnxeo *или MH ^ XeO *(M-Na4-Cs), смещенные вправо. Кислота, соответствующая этим ксилатам, была получена в соответствии с общим уравнением: 3XeF» — f 6Ca (OH) a = «6CaFa I 4-Xe + 2H „XeO“, с 0 *за счет взаимодействия с разбавленным раствором XE hydroxide. At при низких температурах(-25 ° C или около того) он может сохраняться в течение длительного времени.
Его бархатистая соль-BaaXeO-плохо растворима в воде (25 ° C при 0,25 г / л), а пиролиз происходит только при 125°C. In в нещелочной среде гексенон нестабилен (4xe * * = Xe°+ 3Xe4 * без изменений по схеме).Напротив, кислый водный раствор XeO3 очень стабилен. Окислительный потенциал системы Xe -Xe имеет значения приблизительно+2.1 (в кислой среде) и+1.2 В (В щелочной среде). Под действием Оя на раствор XeO3 в IM NaOH образуется Na » XeO.Этот пероксидный анион имеет слегка искаженную октаэдрическую структуру со средним расстоянием d (XeO)= 1,85 А.
Тетра-Тетра-Тетра-Тетра-пероксид может быть отделен в виде бесцветных кристаллогидратов примерно при 100°С, которые бурно разлагаются только при 360 ° с, 6 или 8 НАО. Эта соль слабо растворима в воде(растворимость составляет около 0,025 АФ), гидролиз сильный, вызывая щелочную реакцию. Последнее обусловлено относительной слабостью кисаевой кислоты, что соответствует следующим значениям непрерывного, диссоциативного стоматита.
К\ 10″*, / Са = 10″ *и KR = 3-10-11. Раствор Нодия, содержащий Xe, постепенно сокращает кислород и переходит в раствор Xe’*.Скорость таких метастазов возрастает с уменьшением рН среды (даже при рН а * 7 происходит практически мгновенно). Для окислительного потенциала системы Xe **-Xe **указаны значения+ 2,3 в (в кислой среде) и+0,9 в (в щелочной среде).
Смешанное производное этих валентностей представляет собой взрывчатое молекулярное соединение желтого цвета, в котором композиция K » XeO, 2XeOz получается озонированием смеси растворов XeOj и KOH. Реакция Na4Xe04 и безводного HaS04 при низких температурах привела к образованию желтого xeoetroxnd (тепло, выделяемое из элементов— 154 ккал / моль). Молекула XeO имеет тетраэдрическую структуру с атомом ксенона в центре, а связь XeO характеризуется ядерным расстоянием 4 (XeO) 1,74 а, энергией 21 кл. / моль.
Давление пара этого оксида составляет 3 мм рт. Искусство. В твердом состоянии при −35°C он медленно разлагается до Xe и Oa уже ниже 0°C, а в газообразном состоянии при комнатной температуре-до XeO3, Xe и Oa. Образование Na Xeo *и XeF®очень летучих XeOiF *в реакции также сообщалось, и был осадок. Существует еще один признак возможности образования нестабильного соединения Xeion, содержащего хлор-XeCl или XeCl при определенных условиях. Но все такие признаки являются предварительными, и пока нельзя предположить, что есть хлорид ксенона.
Взаимодействие с радоном фтора проще, чем с ксеноном(состав фтора был установлен), а Криптона гораздо сложнее. Только Криптон-Ди-известно Fluoride.It впервые был получен под действием разряда в элементарную смесь при ~ 188CC.It представляет собой бесцветный кристалл, давление пара эквивалентно 30 мм рт. ст. выше.Искусство. pr 0°C сублимационная теплота составляет 8,8 ккал / моль.
Молекула KrFa линейна, а связь KrF характеризуется ядерным расстоянием d x 1,88 A, энергией 12 ккал / моль и постоянной силы k = 2.5.At при низких температурах KrFi сохраняется в течение нескольких недель, а prn разлагается при 20°C в час, что составляет около 10% от его первоначального объема.Его насыщенный раствор в жидком фтористом водороде примерно соответствует KrFj-3HF в composition.It пока не удается получить производное аргона (даже легкого инертного газа).
Как видно из вышесказанного, информация о соединениях инертных газов, впервые полученная в 1962 году, до сих пор достаточно фрагментарна (и отчасти недостоверна).Однако само существование этих соединений имеет большое фундаментальное значение, так как они наиболее опровергают гипотезу об уникальности электронных октетов и убедительно опровергают ее (VI§3 add.12).
Это также ставит вопрос о целесообразности отказа от названия «инертный газ», которое уже полностью соответствует его сущности(аэробика названия может служить подходящей альтернативой ему).говорить о широком практическом применении соединений инертного газа пока рано.Например, xef4, который стабилен при комнатной температуре, служит удобной реактивной формой фтора(он не загрязнен другими химически активными элементами).необходимо иметь в виду взрывной потенциал этой композиции (потому что во влажном воздухе образуется взрывчатое вещество Xe03).
Есть обзорная статья о соединениях инертных газов. • 13) в качестве реактивного топлива смесь фтора и водорода может производить удельный импульс 410 секунд.Бесцветное пламя, возникающее при взаимодействии этих газов, достигает температуры до 4500°C.In лабораторные условия, чистый фтористый водород получают, как правило, с использованием небольших установок, полностью изготовленных из платины (или меди).
Исходным материалом является тяжелый фторид калия (KF «HF»), который при нагревании разлагает и разлагает HF.Полученный продукт содержит смесь Дифторидов, которая часто механически увлекается.Для очистки его перегоняют при температуре 35-40 ° С.Безводный или близкий к этому состоянию, фтористый водород вызывает карбонизацию фильтровальной бумаги почти мгновенно.
Это расстройство иногда используется для контроля степени обезвоживания.Точнее, такой контроль осуществляется путем определения conductivity.It ничтожно мало в безводном фтористом водороде, но также резко возрастает в следовых количествах воды (многие другие примеси и др.). 14) связи I-F характеризуются ядерным расстоянием 0,92 а и постоянной силы k = 8.8.As уже упоминавшаяся в тексте, его энергия очень высока (135 ккал / моль).
Потенциал ионизации молекулы HF составляет 15,8 э. Что касается нагрева, то фтористый водород очень стабилен:его термическая диссоциация становится заметной только при температуре около 3500 ° C. 15) молекулы HF имеют очень высокую полярность (q = o 1.74).Если мы можем предположить, что весь дипольный момент обусловлен полярностью связи (добавление III§6 2), то расчет выглядит следующим образом: = +0,39 Н БР = -0.39.Теоретический расчет также приводит к близкому результату:±0.40 (III§5 add.10).
Согласно молекулярно-орбитальному методу,±0,23 или±0,48 (VI§3 add.14).Наличие значительного эффективного заряда на атоме хорошо совпадает с выраженной тенденцией фтористого водорода быть связанным с образованием водородных связей по схеме.•* * Х-Ф-Х — Ф -. e. прочнее, чем водородные связи между молекулами воды. 16) как показывает определение плотности паров, молекула фтористого водорода газа вблизи точки кипения имеет средний состав, который приблизительно представлен формулой (HF) 4.
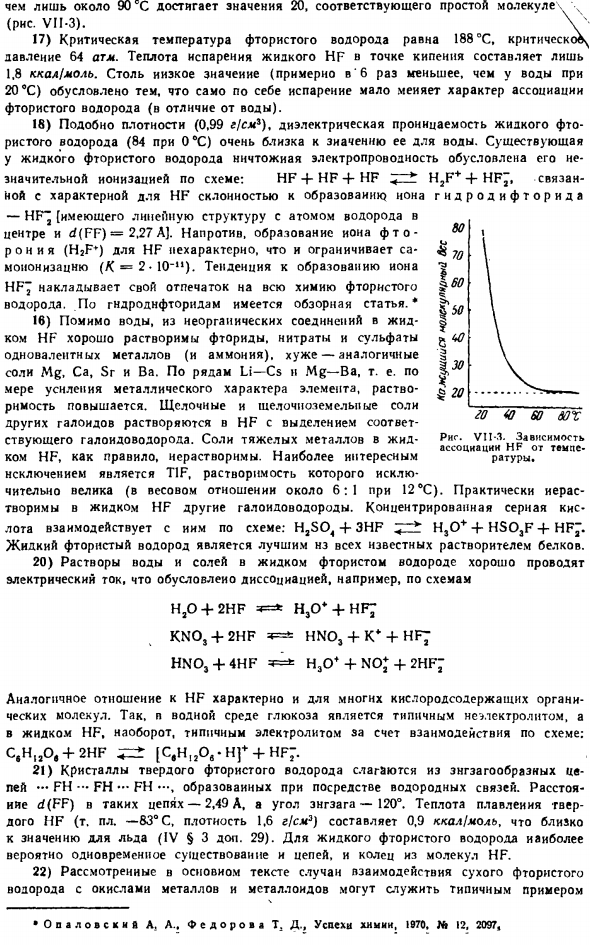
При дальнейшем нагревании связанные агрегаты постепенно распадаются, уменьшая кажущуюся (среднюю) молекулярную массу. Нейдииг А. В. успехи химии,> 963,.В » 4. 301. 1963, St 6. 969. Только около 90°С соответствует простая молекула hh, достигающая значения 20(рисунок VII-3). В 17) критическая температура фтористого водорода составляет 188°C, критическое давление-64 атмосферы. Теплота испарения жидкого HF при температуре кипения составляет всего 1,8 ккал / моль.
Потому что такая низкая величина (примерно в 20 раз больше воды при 6°С) означает не столько характер встречи фтористого водорода (в отличие от воды), сколько испарение в одиночку. 18) плотность (0,99 г / см*), а также диэлектрическая проницаемость жидкого фтористого водорода (0 ° С при 84) очень близки к значению воды. Незначительная проводимость жидкого фтористого водорода обусловлена его незначительной ионизацией по схеме.
HF+ HF 4-HF ^ * H2F * — fHFJ. Связанное с характерной тенденцией HF, HF-центра и d (FF)= 2.27 А.]напротив, образование ионов ФТОРОНИЯ (H2F*) в HF нехарактерно, что ограничивает самоионизацию(K = 2•10-11).Есть обзорная статья о влиянии ндроднфторндама на всю химию фтористого водорода. 16) кроме воды, фториды одновалентных металлов (и аммония), нитраты и сульфаты легко растворимы из неорганических соединений в жидком HF и, что еще хуже, являются аналогичными солями Mg, Ca, Sr и Ba.
В сериях Li-Cs и Mg-Ba, то есть с увеличением металлических свойств элемента, растворимость увеличивается. Другие Галоидные щелочные и щелочноземельные соли растворяются в HF при выделении соответствующего галогенированного водорода. Соли тяжелых металлов в жидком HF обычно нерастворимы. Наиболее интересным исключением является t1f. растворимость T1F очень высока (при 12°C, массовое соотношение около 6: 1).
Другой галогенированный водород практически нерастворим в жидком HF. Концентрированная серная кислота взаимодействует с им по схеме H2S04 + 3HF ^ Zt HsO * — f HSOaF + HFJ. Жидкий фтористый водород-самый известный белковый растворитель. 20) раствор воды и соли в жидком фтористом водороде проводит ток скважины для диссоциации, например, по схеме НАО-+ * 2НР Нео * * * HFJ KNO $ + 2HF HNO,+ K * + HFJ HNO,+ 4HF = » = * H304 + NOJ + 2HF7 Подобное отношение к HF характерно также для многих кислородсодержащих органических соединений molecules.
So в водной среде глюкоза является типичным неэлектролитом, а в жидкой HF, согласно схеме, C, H, 20,+ 2HF ^ [CeH12 (VH] * + HF- 21) твердые кристаллы фтористого водорода состоят из зигзагообразных цепей.••* НР• * * НР * * * FН-образуется водородная связь. Расстояние d (FF) такой цепи составляет 2,49 а, а угол зигзага-120°.Теплота плавления твердого HF (mp −83°C, плотность 1,6 г / см3) составляет 0,9 ккал / моль, что близко к значению льда(IV§ 3 add.29).
В случае жидкого фтористого водорода наиболее вероятно, что одновременно присутствуют и цепь, и кольцо молекулы HF. 22) типичным примером служит рассмотренный в тексте случай взаимодействия сухого фтористого водорода с оксидами металлов и металлоидов * Опалоа А, А. Федорова т, д., успехи химии, 1970, Nt 12, 2097、 Восемьдесят * 70?% 60%йо? » $ 20. Здесь е <0 Рига VI1-3. Температурная зависимость ассоциации HF.
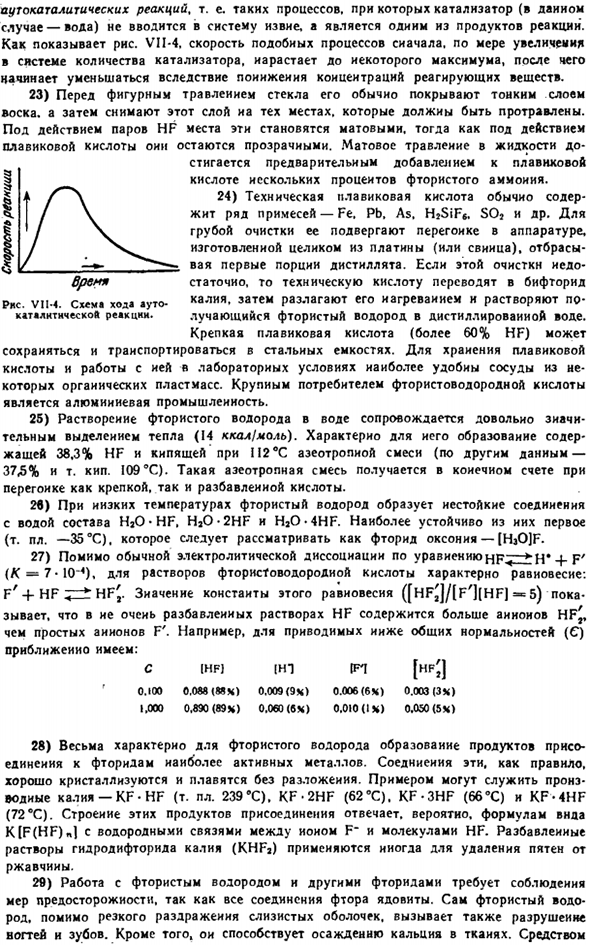
Автоматическая каталитическая реакция, т. е. процесс, в котором катализатор (в данном случае вода) не вводится в систему извне, а 1 реакции products. As фото. В. 1-4.Скорость такого процесса возрастает с увеличением количества катализаторов в системе, которое вначале увеличивается до определенного максимума, а затем начинает снижаться за счет уменьшения концентрации реагирующих веществ.
23) перед травлением в виде стекла его обычно покрывают тонким слоем воска, а затем этот слой удаляют в месте, подлежащем травлению. Под воздействием паров HF эти пятна становятся непрозрачными, но остаются прозрачными под воздействием плавиковой кислоты. Матовое травление в жидкости достигается путем предварительного добавления нескольких процентов фторида аммония к плавиковой кислоте.
24) техническая плавиковая кислота обычно содержит много примесей (Fe). как свинец. HjSiF *. Найти и соавт. Для грубой очистки он перегоняется в устройстве, изготовленном только из платины (или свинца), и первая часть дистиллята отбрасывается. Если ты почистишь эту штуку Wremp stachio, затем техническая кислота превращается в дифторфторид Рисунок VIM автоматическая схема потока калия.
После этого его нагревают и разлагают, а затем растворяют в каталитической реакции. Радиоактивный фтористый водород в дистиллированной воде. Сильная плавиковая кислота (более 60% HF) может храниться и транспортироваться в стальном резервуаре. Для хранения плавиковой кислоты и работы в лабораторных условиях наиболее удобны емкости из органического пластика.
Крупным потребителем плавиковой кислоты является алюминиевая промышленность. 25) растворение фтористого водорода в воде сопровождается значительным выделением тепла (14 ккал / моль).Отличительной особенностью его является образование азеотропной смеси, которая содержит 38,3% HF и кипит при P2°C (по другим данным-37,5% и др.).109°с).
Такая азеотропная смесь в конечном итоге получается путем перегонки как сильных, так и разбавленных кислот. 26) при низких температурах фтористый водород образует нестабильные соединения с водой в составе h20-hf, hao-2hf и hao-4hf. Наиболее устойчивым из них является первый (Мп.-35°С).Это следует считать фторид-оксоний [hjo] F. 27) в дополнение к обычной электролитической диссоциации по уравнению 4, F7 (/С= 7 * 10 «4), раствор плавиковой кислоты характеризуется равновесием: f’ + HF ^ zt HF ^.
Величина константы этого равновесия([HFj] / [f’] (HFJ = «= 5) указывает на то, что в очень разбавленном растворе HF анионов HFJ больше, чем простых анионов f’.Например, в общей нормальности © ниже C IHFJ(NT P [HFJ] 0.100 0.088(88 *)0.009(9М)0.006(64)0.003(3 *)1.000 0.890(89 *)0.060(б *)0.010(1 л) 0.050(5М) 28) образование продукта присоединения наиболее активного металла к фториду очень характерно для водорода fluoride.
As как правило, эти соединения хорошо кристаллизуются и растворяются, не разрушаясь. Производные калия-KF-HF(mp.239’c) является примером. Кф 2НР(62eC). KF3HF (66°C) и KF-4HF(72°C).Структура этих аддуктов, вероятно, соответствует формуле K [F(HF)* 1.Существует водородная связь между Ионом F и молекулой HF. 29) все фторированные соединения токсичны, поэтому необходимо соблюдать меры предосторожности при обращении с фтористым водородом и другими фторидами.
Плавиковая кислота сама по себе вызывает, помимо интенсивного раздражения слизистой оболочки, также вызывает разрушение ногтей и teeth. In кроме того, он способствует отложению кальция в тканях. Значение Первая помощь при остром отравлении фтором — это 2% раствор CaClf.
In в случае ожога плавиковой кислотой пораженный участок следует долго (в течение нескольких часов) промывать в струе холодной воды, после чего следует наложить компресс из 20% — ной суспензии МГО во вновь приготовленном глицерине. Хроническое отравление фтором может быть вызвано как увеличением содержания питьевой воды, так и вдыханием воздуха в виде dust.
As в результате такого отравления наблюдается разрушение зубной эмали. Хрупкость костей также значительно возрастает, создаются предпосылки для переломов. При повышенном содержании фтора в воде и воздухе появляются признаки, которые могут вызвать goiter.
In помимо фтористой промышленности, необходимо учитывать возможность хронического отравления фтористыми соединениями, особенно при производстве алюминия и суперфосфата. Предельно допустимой концентрацией связанного фтора в воздухе производственных помещений считается 0,0005 мг/л.
Смотрите также:
| Структура периодической системы | Хлор |
| Электронные аналоги | Адсорбция |

