Оглавление:











Молекулярные растворы
- Молекулярный solutions. As уже упоминавшийся в предыдущем пункте числитель (в других случаях истинный) раствора состоит из молекул распределенных веществ и среды, смешанных между собой. Поэтому они являются однородными системами. Несмотря на то, что эквивалентное соотношение распределенного (в данном случае растворенного) вещества и среды (растворителя) при растворении не наблюдается, раствор нельзя просто считать механическим mixture.
- By некоторые признаки, они близки к compound. In в частности, при растворении энергия (теплота растворения) постоянно поглощается или выделяется, что приводит к изменению объема. Как правило, и тот и другой эффект невелик, но в некоторых случаях он становится заметным. Теплота растворения может быть очень важна. Поэтому при растворении аммиачной селитры происходит сильное охлаждение, а при растворении гидроксида калия жидкость сильно нагревается.
Например, если смешать спирт с водой, он немного уменьшится в объеме. Людмила Фирмаль
Оба процесса могут быть представлены следующими уравнениями: Отель NH <бортовым номером 03-Ф р-р + 6 ккал = NH4N03•ая ко + Ак = ко•Ак-Ф 13 ккал aq (латинское Aqua-сокращенно вода) означает большой. Точнее, необнаруживаемое количество воды 1 Изучение растворов различными методами позволило выявить многие сольваты, представляющие собой более или менее хрупкие соединения молекул растворителя и растворимых частиц(в конкретном случае водного раствора-гидратов).
Вследствие образования сольватов свойства растворимых веществ сильно варьируют и могут быть обнаружены при непосредственном наблюдении. Например, безводный сульфат меди бесцветен, но его водный раствор имеет синий цвет. Вообще говоря, сольваты должны образовываться легче, иметь большую стабильность и образовывать больше полярных частиц растворенных веществ и растворителей.
Поскольку вода является самой полярной молекулой из всех распространенных растворителей, часто приходится иметь дело с гидратами. Вода в гидратах может очень жестко связывать растворенные вещества, и когда последние отделяются от раствора, она становится частью его кристаллов. Такие кристаллические структуры с водой в их составе называются кристаллогидратами (в общем случае они используются в качестве кристаллов).
Вода, которая входит в кристаллическую структуру других веществ, называется кристаллизацией. Состав кристаллогидратов обычно выражается формулой вещества, которая показывает количество молекул кристаллической воды на 1 молекулу. Например, формула кристаллогидрата сульфата меди-сульфат меди-Cu $ 0; — 5Ng0.Подобно водному раствору медного купороса, этот кристаллогидрат имеет синий цвет.
Состав сольватов в растворе, вероятно, таков variable. In кроме них, есть, безусловно, свободные молекулы растворителя. Именно поэтому во всем растворе не наблюдается эквивалентности пропорций растворенного вещества и количества растворителя, что характерно для соединения. Поэтому решение не может быть назначено соединению. Но с другой стороны, их нельзя причислить к простым механическим смесям.
Занимают промежуточное положение. «Раствор представляет собой жидкую диссоциационную систему, которая образуется частицами растворителя, растворенными телами и частицами экзотермических соединений, которые неустойчивы, но возникают между ними, и составляет более 1, в зависимости от природы составляющего принципа.»В вышеприведенном Д. I. In по словам Менделеева (1887), заключена основная суть разработанной им химической теории растворов.
Последняя принципиально отличается от»физической» теории, которая рассматривает растворители только как инертную среду и отвергает наличие сольватов в растворе(то есть по существу приравнивает их к простым механическим смесям).В настоящее время взгляд Менделеева на природу решения широко признан. Растворенное вещество действует несколькими способами, так же как и в газах.
Одно вещество растворяется в разбавленных растворах других веществ почти так же легко, как в чистом растворителе, так что один газ свободно переходит в другой. Подобно газам, но очень медленно, в растворе происходит диффузионный процесс, который создает и поддерживает концентрацию одного и того же растворенного вещества по всему объему. Сам процесс растворения тесно связан с диффузией.
Например, при введении в воду твердого вещества молекулы его поверхностного слоя растворяются и в результате диффузии распределяются по всему объему растворителя. Затем с поверхности удаляется новый слой молекул, который распределяется по всему объему и т.
Растворение следует продолжать таким образом до полного перехода в раствор любого количества твердого вещества, и если при этом обратный процесс не произошел, то молекулы высвобождаются из раствора. Твердое тело, которое непрерывно движется во время столкновения с поверхностью раствора, может оставаться на поверхности раствора и образовывать новый слой.
Очевидно, что такое обратное высвобождение происходит более интенсивно, чем выше концентрация раствора. Но по мере растворения вещества оно увеличивается все больше и больше, в конце концов достигая такой величины, что растворяется столько молекул, сколько высвобождается за единицу времени. Решение, соответствующее этому равновесному состоянию, называется насыщением.
Большее количество веществ не сможет раствориться при определенных внешних условиях. Из вышесказанного можно сделать вывод, что равновесие системы растворимых веществ-насыщенного раствора-является динамическим равновесием, и такая система при определенных условиях может существовать произвольно длительное время без явных изменений.
Раствор, концентрация которого ниже насыщенной концентрации, является unsaturated. In в отличие от насыщения, такой раствор при определенных внешних условиях может растворить определенное количество substances. In в дополнение к этим обозначениям на практике можно использовать следующее: раствор, содержащий много растворенных веществ, называется сильным и разбавляется-м, который почти не содержит растворенных веществ.
Концентрацию раствора можно выразить различными способами, например, указав количество граммов молекул растворенного вещества, содержащихся в 1 литре раствора. Концентрация, определенная этим методом, называется моль (м). ПХ-это, как правило, указываются следующим образом: 1 м-unimol раствора (1 моль на lntr)、 2 м-биполярный раствор(1 2 моль на литр)、 0,1 м-10 молярный раствор(0,1 ммоль / л) и др.
Молярный раствор удобен тем, что prn одинаковой концентрации, равной объему nx, содержит одинаковое количество молекул растворенного вещества. Поэтому, если 1 молекула вещества а вступает в реакцию с 1 молекулой вещества в, то для получения полного взаимодействия необходимо взять равное количество раствора.
Если 1 молекула а вступает в реакцию с 2 молекулами раствора в, то необходимо взять в 2 раза больше раствора А. Концентрация насыщенного раствора определяет численно растворимость вещества в этих условиях. К сожалению, до сих пор нет теорий, которые могли бы объединить результаты отдельных исследований с общим законом растворимости.
Такая ситуация обусловлена главным образом тем, что растворимость различных веществ очень по-разному зависит от температуры. Единственное, что может привести к определенной степени, — это старые правила, которые находятся в опыте. Его смысл с современной точки зрения на строение молекул заключается в том, что если сам растворитель имеет неполярные или слабополярные молекулы (например, бензол, эфир), то он хорошо растворяет вещества, содержащие неполярные или низкополярные molecules.
It не растворяет вещества, которые являются полярными и фактически построены в соответствии с типом Иона. Напротив, растворитель (например, вода) с сильными полярными характеристиками молекул, как правило, растворяет вещества, образованные полярными и частично ионными молекулами, а вещества, содержащие неполярные молекулы, практически не растворяются.
Агрегатное состояние растворенных веществ и растворителей может быть различным (§ 1), но необходимо обрабатывать растворы жидкостей, главным образом в воде, почти исключительно. Поэтому в дальнейшем учитываются преимущественно водные растворы. Растворимость газов в жидкостях очень различна. Например, в нормальных условиях 1 объем воды может растворить 0,02 объема водорода или 400 объемов хлористого водорода.
Большинство газов хорошо растворяются в растворителях, которые менее полярны, чем в воде. При нагревании, как правило, повышается растворимость газов в жидкостях decreases. By вскипятив жидкость, обычно можно освободить жидкость от растворенного газа (то есть выполнить дегазацию). Зависимость растворимости газа от давления представляет собой закон растворимости газа (Генри, 1803): растворимость газа в жидкости прямо пропорциональна его парциальному давлению.
Таким образом, снижение парциального давления приводит к снижению solubility. An примером может служить обычная газированная вода, представляющая собой насыщенный водный раствор, приготовленный под высоким давлением углекислого газа: когда он вступает в контакт с воздухом(парциальное давление винтика составляет всего 0,2 мм рт. ст.), растворенный углекислый газ начинает бурно выделяться.
Данные о растворимости газов обычно относят к 760 мм рт. ст. Их парциальное давление(то есть насыщение жидкости под атмосферным давлением соответствующим газом). Восемнадцать Существуют различные случаи растворения жидкости в жидкости. Например, спирт и вода смешиваются в произвольном соотношении, а вода и бензол почти не растворяют друг друга.
Наиболее распространенной является ограниченная взаимная растворимость, которая характерна, например, для водных эфиров. При нагревании растворимость жидкости в жидкости меняется: время от времени она увеличивается, а иногда и уменьшается. Растворимость твердого вещества в жидкости в значительной степени зависит от различных растворимых веществ и solvents. As температура повышается, ИА обычно increases.
It полезно построить график температурной зависимости растворимости в виде кривой растворимости. Его типичные 3 формы показаны на рисунке. V-1.As как видно из рисунка, растворимость NaCl увеличивается очень медленно с увеличением температуры, а KN03 увеличивается очень быстро. Более сложной формой является кривая растворимости сульфата натрия. При 32,4°C его кристаллогидрат разрушился、
Водная соль, что соответствует нарушению растворимости раствора, представляющего собой по существу комбинацию 2 отдельных кривых: до 32,4 ° С насыщенный раствор находится в равновесии с осадком, состоящим из Na2S (V UN20, выше этой температуры-najsot безводный, резкое изменение кривой указывает на то, что растворимость обоих веществ заметно отличается. — Дано для различных кристаллогидратов Содержание воды: каждый из них.
Имеет свои особенности Рома 23-26 Довольно многие (но не все) твердые вещества характеризуются относительно легким образованием пересыщенных растворов. Последние характеризуются содержанием в них растворенных веществ, превышающим их нормальную растворимость при определенных условиях.
- Например, в результате тщательного охлаждения насыщенного раствора при высоких температурах может образоваться пересыщенный раствор. Когда «семя» вводится в него в виде кристаллического раствора, весь избыток последнего (превышающий содержание, соответствующее обычной растворимости) кристаллизуется.
Это свидетельствует о том, что, в отличие от насыщенных растворов, пересыщенные растворы являются неустойчивыми системами и могут существовать только при отсутствии твердой фазы растворенных веществ, контактирующих с ними.
Добавь 1) дробление растворимых веществ и отдельных частиц, возникающих при растворении и требующих индивидуального energy. Людмила Фирмаль
In эти частицы необходимо освободить место в растворителе. Это связано с преодолением взаимного притяжения молекул, которым тоже нужна энергия. Напротив, взаимодействие растворенных частиц и молекул растворителя сопровождается выделением энергии. Если это распределение преобладает над затратами, то наблюдаемая теплота растворения положительна, в противном случае она отрицательна.
2) из вышеизложенного видно, что положительная теплота растворения обусловлена образованием сольватов. Это становится очевидным время от времени. Например, растворение безводной соды и ее кристаллогидрата протекает по формуле NajCOj-Ф р-р- » NajCOj•Ак-Ф 6 ккал на сотрудничество,•10H2O + р-р-на, СО. aq-16 ккал Согласно закону Гесса.
Различия в теплоте обоих процессов соответствуют теплоте образования кристаллогидратов соды. NajCOj + UN20 = * NajCOj * UN, O + 22 ккал iO I) 60 60 foq’c Рисунок V-1.Кривая растворимости (г на 100 г НАО). 3) Несколько особое место среди кристаллогидратов занимает т. газовый гидрат. Они образуются при кристаллизации воды в присутствии достаточного количества определенного газа (или жидкости).
Известны 2 характерные для них модифицированные структуры льда, рыхлые в кубе (плотность 0,79 г / см’), чем обычно. В НАО 46 молекул содержат 1, 6 пустот в диаметре 5.9 а и 5.2 а 2 пустоты с диаметром. Когда все пустоты заполнены молекулами газа (х), состав х•5,75 Нго. И заполнить только более крупную-вплоть до композиции X-7,67 HjO.
Другая (менее распространенная) структура для каждой из 136 молекул H20 содержит 6,9 пустот диаметром 8 А и 4,8 л 16 пустот диаметром. Каждая частица X, содержащаяся в своей плохой другой структуре, окружена очень большим числом (20-28) молекул H»0.То есть в»клетке», образованной этими молекулами.
Дисперсия enl аддитивность (III§ 7 add.8) из-за того, что взаимодействие между соответствующим объемом х и окружающими молекулами IljO очень велико(порядка G-10 ккал / моль Х), может появиться рыхлая кубическая структура льда. Оба они нестабильны. Обычно газогидрат представлен округленной формулой-х-6Н»0″ и X-8H20.As как правило, они относятся к первому типу 5. 75HjO).
Эти гидраты очень нестабильны, что видно из температуры, ниже которой давление диссоциации достигает 1 атм. Х АГ кг Хе-СН4 РНЗ с 20СО、 Температура, СС……. −43 −28 −3 −29 -б-19-24 Недавно было установлено, что гидраты природного газа (в основном SN) образуют огромные залежи в районе вечной мерзлоты. Соединения типа Х-17Н * 0 характеризуются молекулами жидкости, содержащейся в ice.
An примером может служить кристаллический хлороформ гидрат-CHCU * 17NgO. Существуют также «двойные гидраты», в которых большие пустоты заполнены большими молекулами, а маленькие пустоты заполнены маленькими молекулами, например CHCU•2H7S * 17NgO. Дополнительное заполнение таких пустот приводит к увеличению суммарной энергии дисперсионного взаимодействия.
Таким образом, это способствует укреплению рассматриваемой структуры. существует обзорная статья о гидратах gzza (и жидкости). • 4) кристаллический гидрат инертного газа действует как самый простой пример аддукта (в противном случае это соединение включения).Отличительной особенностью такого аддитивного продукта является решающая роль структурных возможностей»принимающего вещества»(например, льда), в то время как» гостевое вещество » (например, инертный газ) входит только в диапазон этих возможностей.
В приложении имеется монография М. В структуре «хозяина», главным образом 3 типа полостей. Ячейки представляют собой слои (например, графит), открытые со всех сторон (например, кубический лед), lpio-открытые кайал (например, крахмал или обычный лед) и плоские. Аддукты клеточного типа часто называют классовыми соединениями (или просто клатратами). Состав adducts.
As как правило, это не имеет ничего общего с химическими свойствами «хозяина» и «гостя». в общем случае это переменная величина, так как она определяется степенью заполнения полости»хозяина «»гостем»molecule. As эта степень увеличивается, состав стремится к определенному пределу, который соответствует заполнению всех имеющихся полостей.
Например, для газовых гидратов таким ограничением (которое, по сути, редко достигается) является состав х » 5. 75 Н20. Хотя межмолекулярные силы играют более или менее важную роль в образовании аддуктов. Однако, как правило, геометрический фактор является наиболее важным. Возможный размер полости структуры хозяина и размеры гостевой молекулы.
Заполнение улья стеклянными шариками послужит моделью для образования аддуктов. Возникновение дисперсионного взаимодействия между стеклом и воском еще не дало никаких оснований полагать, что заполненные сотами шарики являются связующим звеном между стеклом и воском. Поэтому термин «соединение» не соответствует по своей природе природе большинства аддуктов.
б) из-за медленной скорости диффузии в растворе жидкий слой непосредственно рядом с растворимым материалом быстро насыщается, и только когда растворенные молекулы диффундируют, то есть очень медленно растворяются дальше. Для более быстрого растворения раствор смешивают, чтобы искусственно ускорить диффузию.
6) нормально, плотность решения выше чем это из чистого растворителя, поэтому она может растворить быстро без шевелить жидкость. Для этого необходимо только поместить растворимое вещество не на дно емкости, а в верхний слой растворителя. После этого полученный раствор сразу же отвалится, и процесс растворения пойдет гораздо быстрее, потому что поверхность растворенного вещества всегда будет очищаться чистым растворителем.
7) наличие динамического равновесия в насыщенном растворе может быть подтверждено простыми экспериментами. Если опустить фрагменты крупных кристаллов предварительно взвешенной каменной соли в закрытую емкость с насыщенным раствором NaCl и держать всю систему при постоянной температуре, то несмотря на это ее масса не изменится.
8) концентрация раствора часто выражается числом граммов молекул растворенного вещества на 1000 г растворителя. Аналогично выраженное сосредоточение называется молитвой (l).Основные преимущества: они не зависят от температуры (чисто потому, что они взвешены). в смысле обозначения все, что сказано в тексте о молярном растворе, может быть применено к морарному раствору.
9) по существу, наиболее правильным способом выражения концентрации является указание молярной доли (L’) соответствующего вещества. Последняя состоит из числа молекул конкретного компонента системы (l) и общего числа молекул всех ее компонентов(A. B. V …Относится к соотношению).Например, формула для молярной доли вещества а имеет следующий вид: NA= 1A: (1A + 1B ’4-lv4 -••).Очевидно, что сумма молей всех компонентов любой системы будет равна 1.
Другая молярная фракция часто указывается в процентах от этого количества. Приведенные выше способы выражения концентрации веществ в растворах (и других системах) в основном используются в научных исследованиях. 10) концентрация раствора также может быть выражена числом граммов растворенных веществ на конкретный объем раствора или конкретный объем растворителя.
Обычно он указывает весовой процент растворенного вещества(в растворе 100 г). в производстве концентрация раствора часто характеризуется его плотностью. Существует справочник по растворимости различных веществ. 1!
Если необходимо приготовить более разбавленный или более крепкий из раствора определенной пропорции, то, используя так называемые правила смешивания, можно легко узнать количество исходной жидкости требуемого веса. Последняя представляет собой вычислительную схему, что видно из следующего примера: 1) готовят 65% раствор и воду (0%) до 25% раствора, 2) готовят 49% и 8% раствор до 20% раствора. 65 25 49 12 ш / 25, 20. С ^ / н 0 40 8 29 по схеме жужио:1) 25 вес. ч. 65%раствора приходится на 40 мас.
Включая воду; 2)12 случаев веса. h. раствор 49% должен иметь массу 29. В том числе 8% раствор. 12) полярность растворителя характеризуется величиной его электропередачи (е).Последний показывает, во сколько раз меньше притяжение или отталкивание между 2 зарядами в данной среде по сравнению с вакуумом (e = 1).Такое ослабление взаимодействия, setellis paribus, тем больше, чем Полярнее молекулы среды.
Диэлектрическая проницаемость жидкости уменьшается с увеличением температуры. Например, для воды следующие значения e:: О10-это 20 25 30 40 50 60 70 80 90100°- да. 3 84.3 82.3 80.4 78.5 76.7 73.1 69.8 66.5 63.5 60.5 57.8 55.1 При повышении давления диэлектрическая проницаемость воды несколько повышается (при 1000 атм-около 5%).
Интересно, что диэлектрическая проницаемость пероксида водорода (е = 0°С при 84,2) и водной смеси несколько превышает диэлектрическую проницаемость каждой из этих жидкостей. То же самое относится и к электропроводности водного раствора HfOj. 13) наличие растворенных солей в воде, как правило, снижает растворимость gases.
So например. Морская вода плавит воздух чуть больше, чем Rivers. In в случае более или менее значительной концентрации растворенных солей их свойства приобретают существенное значение. И)при работе с газами часто возникает вопрос о том, какая жидкость является наиболее»блокирующей»arises. In во многих газах такая жидкость представляет собой сильный водный раствор смеси 2NatS04 + HjSO.
15) как правило, газ лучше растворяется в различных органических жидкостях, чем в воде. Например, керосин растворяет (по объему) в 10 раз больше воздуха, чем вода. Ниже приведены приблизительные данные, показывающие, что растворимость бензольного газа*больше, чем воды (за счет эквивалента растворителя). Не H / Ar NjOaCOCOj SOJ NHJ 2 3.5 4 7 10 7 2.5 2 0.005 Аммиак является исключением из общего правила-его растворимость в аноде намного больше, чем в органической жидкости.
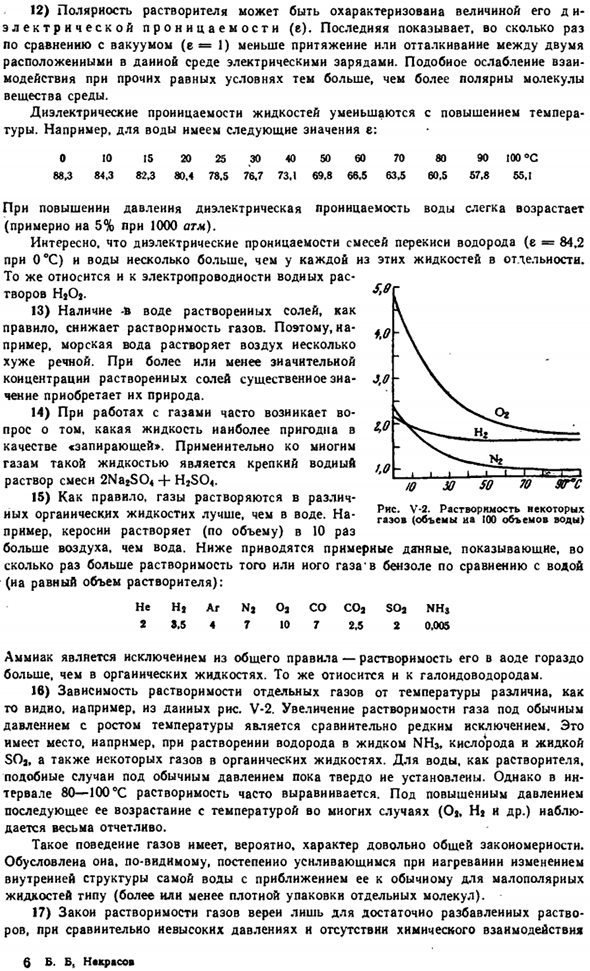
То же самое относится и к Галогеноводороду. 16) температурная зависимость растворимости отдельных газов различна, например, как видно из данных на рисунке 5. В-2.Увеличение растворимости газа при нормальном давлении с увеличением температуры является относительно редким исключением.
Это происходит, например, при растворении водорода в жидком NH1, кислороде, жидком SO1 и некоторых газах в органическом liquids. As для воды в качестве растворителя такие случаи при нормальном давлении еще не установлены окончательно. Однако в диапазоне 80-100°с растворимость часто бывает однородной.
Когда давление повышается, последующий рост обусловлен температурой во многих случаях (Ot, Hi и др.) наблюдается очень четко. Газ (объем воды 100 мл) Такое поведение газа, вероятно, довольно распространено rule. It это естественно. По-видимому, по мере приближения к обычному типу низкополярной жидкости она постепенно увеличивается при нагревании за счет изменения внутренней структуры самой воды (большей или меньшей плотности отдельных молекул).
17) закон растворимости газа веры только для хорошо разбавленного раствора, при относительно низком давлении и отсутствии химического взаимодействия 6 В. Б, Некрасов Растворимые молекулы газа, содержащие растворитель (или друг друга).Типичные отклонения от растворимости газа при высоком давлении показаны на рисунке. В-3.
При дальнейшем увеличении давления кривая достигает определенного максимума, после чего растворимость LNBO практически не изменяется или начинает уменьшаться. 18) в случае растворения смешанного газа каждый газ поглощается пропорционально его парциальному давлению. Используя закон растворимости газа, например, можно рассчитать состав воздуха, растворенного в воде.
Растворимость азота и кислорода, его основного газа, равна 100 объемам на 1,5 и 3 объема соответственно при нормальных условиях, а парциальное давление в воздухе составляет (приблизительно) Vs и V » rel, поэтому раствор азота будет составлять 1,5 * 4 / b = 1,2.И кислород-3- / таким образом, количество растворенного азота и кислорода называется 2:1, а соотношение в воздухе-4: 1.
19) взаимная растворимость жидкости обычно больше, чем ближе Внутреннее давление (§ 3 доп. IV. 22). в следующей серии жидкостей, чем труднее перемешать, тем больше они расположены друг от друга. Ч, 0С, Ч & О(CHECO (с, х) АО CHC1, с » Н9 CC14 КС2 СВН、» Интересно, что можно выбрать стабильную систему из 8 и более несмешивающихся жидкостей с различной плотностью. 60 90/20 60180 UO рисунок V-4.Никотин-вода.
20) хороший пример различных изменений взаимной растворимости жидкостей по температуре дает система вода-эфир(г на 100 г раствора): Температура, ° С0 10 20 30 40 50 60 70 80 Вода и эфир (эфирный слой). •1.0 1.1 1.2 1.3 1.5 1.7 1.8 2.0 2.2 Эфир в воде (слой воды)… 12 8.7 6.5 с.! 4.5 4.1 3.7 3.2 2-я
Представленные данные свидетельствуют о том, что с повышением температуры растворимость воды в эфире увеличивается, а растворимость эфира в воде уменьшается. 21) изучены наиболее распространенные случаи взаимной растворимости двух жидкостей в никотин-воде systems. As как видно из рисунка V-4, менее+ 60 ° С и более+210°С обе жидкости смешиваются между собой в любом соотношении, и при промежуточных температурах смесь разделяется на 2 слоя.
То есть вода содержит только около 10% никотина, а никотин содержит около 20% воды. То есть растворимость каждой жидкости ограничена. Температура, при которой слои тщательно перемешиваются, называется нижней и верхней критической температурой смешивания соответственно. Для различных пар жидкостей, оба могут быть очень разными.
Если температура, при которой происходит перемешивание, соответствует области расслоения, характерной для конкретной пары, то ограниченная растворимость является displayed. In большинство систем, критическая температура смешивания не может быть достигнута на практике, и растворимость При любых условиях опыта он остается ограниченным или неограниченным.
Хороший пример в случае, когда достигается любая из этих температур, дает система фенол-вода: ниже+66°с оба вещества несколько менее растворимы друг в друге, а выше-неограниченно. Точно так же, если он превышает 270°C(под давлением), вода и бензол будут растворяться бесконечно друг от друга. 22) в нормальных условиях, как вы знаете, все газы полностью смешиваются друг с другом.
Но при очень высоком давлении, когда плотность газа приближается к плотности соответствующей жидкости, в некоторых случаях смесь разделяется на 2 фазы различного состава. Существование такой ограниченной взаимной растворимости взаимного газа было впервые обнаружено в системе Nj-iNHj при 140°C и 8000 атмосферах. 23) изменение растворимости из-за температуры часто используется для очистки вещества путем перекристаллизации.
Например, если имеется соль, загрязненная примесями, то при охлаждении этого горячего насыщенного раствора значительная часть очищаемой соли выпадает в осадок. С другой стороны, загрязняющие вещества остаются в растворе. Последнее связано с насыщением загрязнителями даже в холодное время года.
Аналогичным образом можно удалить твердые вещества, растворимость которых сильно зависит от температуры. Если растворимость вещества мало изменяется с температурой, то его очистка путем перекристаллизации становится невозможной. Очистка таких веществ осуществляется путем выпаривания насыщенного раствора, то есть, путем удаления части воды из последнего.
В то же время, определенная часть вещества, которая должна быть очищена кристаллизуется, в то время как примеси остаются в растворе. 24) при высоких температурах (выше 100°C) растворимость в твердой воде изменяется widely. So из того, что показано на рисунке V-1 соли, растворимость Найсо < примерно до 240°С практически не изменяется, затем начинает снижаться, около 360°С будет близка к нулю.
Напротив, растворимость NaCl и KNO непрерывно возрастает с повышением температуры, а в NaCl это происходит относительно медленно. И кн ’ 03-очень быстро. Фактически, в системе NgO-KCO3 между температурой плавления льда (0 ° С) и KN03 (334 ° С) появляется непрерывная жидкая фаза с промежуточным составом. Такое поведение характерно и для других солей, растворимость которых увеличивается при нагревании, а температура плавления ниже критической температуры воды (374°с).
25) небольшое изменение давления фактически не влияет на растворимость твердого вещества в воде, но под давлением в несколько тысяч атмосфер иногда сильно изменяется. Например, растворимость NH noj составляет 25°C и 10 000.О 2x, Cdl? — В 3 раза меньше, чем обычно. 26) подобно жидкости, сжатый газ может растворять некоторые вещества.
Например, при давлении 300 АТМ растворимость воды в метане составляет 0,12 (при 40°С). 1.2 (при 100°C) и 12.9 (при 200°C) кг / м>. 400 кг водяного пара, нагретого до 1°C, растворяют при температуре 1,1 (500 Ат). 1.7 (1000 ar) n 2.2 (at 2000) грамма диоксида кремния. Растворимость твердого вещества в перегретом паре (то есть пара, нагретого выше точки кипения воды при заданном давлении) может привести к неприятным последствиям.
Современные тепловые электростанции могут быть 550°C или 200at. Когда такой пар проходит через турбину, давление и температура резко падают, а сырая вода содержит пары (SiOt, CaSO и др.) осаждается на турбине blades. To во избежание этого, вода, поступающая в паропривод, должна быть тщательно удалена из растворенного вещества.
27) были сделаны выводы о причинах возможности существования пересыщенного раствора. Очевидно, с трудностью центра кристаллизации, а именно с первым появлением мельчайших зародышевых кристаллов. Каждый кристалл характеризуется строго определенным расположением образующих его частиц, поэтому для возникновения центра кристаллизации хаотично движущиеся частицы растворенного вещества должны быть сгруппированы в определенных точках раствора точно так же, как это характерно для конкретного кристалла.
Подобная регулярная группировка различных веществ возможна при различных уровнях яркости, и в некоторых случаях это может занять очень много времени, чтобы произойти естественным образом. Когда растворенное вещество (или другое кристаллизационное вещество, подобное ему) вводится в пересыщенный раствор, оно становится центром, из которого кристаллизация распространяется по всему раствору.
Помимо введения»семян», кристаллизация пересыщенных растворов часто вызывается трением стеклянных стержней о стенки содержащих их емкостей. Действие трения явно сводится к тому, что 1 из мельчайших частиц стекла, которые образуются в этом случае и форма которых подходит для данного кристалла, становится первым центром кристаллизации.
Вероятно, с этим связаны и случаи, когда под воздействием частиц пыли, осаждающихся из воздуха, очень часто наблюдается кристаллизация пересыщенных растворов. 2S) состояние пересыщения газового раствора является довольно типичным. Из-за этого, когда температура насыщенного раствора быстро меняется на более высокий уровень, избыточное выделение растворенных газов обычно не наблюдается или происходит очень медленно(в основном на твердых поверхностях).Причиной пересыщения, как и в случае твердых тел, является трудность возникновения новой фазы.
Смотрите также:
| Перекись водорода | Свойства растворов |
| Дисперсные системы | Гипотеза ионизации |

