Оглавление:







Межмолекулярные силы
- Межмолекулярная сила. Как и в любом другом месте в природе, гравитация действует между молекулами и прямо пропорциональна произведению массы взаимодействующего тела, обратно пропорциональна 2 степени расстояния между центрами (закон всемирного тяготения).Однако эти силы очень малы, так как масса отдельных молекул на практике незначительна.
- С другой стороны, уже из существования твердого и жидкого агрегатного состояния материи ясно, что взаимное притяжение молекул существует бесспорно. It было установлено, что они являются силами электрического происхождения и, кроме того, проявляют себя в различных формах.
Выяснение свойств межмолекулярных сил в настоящее время возможно только на основе принципа внутренней структуры молекул. matter. Людмила Фирмаль
Простейшая их форма определяется основным законом статического электричества (кулона, 1785): сила взаимодействия 2 заряженных частиц прямо пропорциональна произведению заряда и обратно пропорциональна 2 мощности расстояния между центрами. Эти кулоновские силы играют главную роль во взаимодействии ионов. Однако ясно, что он не может действовать между нейтральными молекулами без избытка charge.
To чтобы понять суть взаимодействия последних друг с другом, необходимо сначала прояснить проблему взаимосвязи между молекулой и внешним электрическим полем. Сначала рассмотрим простейший случай неполярных молекул (а, рис. III-47).Если во время нерегулярного движения находится достаточно близко к источнику электрического поля, то электрическое поле начинает существенно влиять на атомную молекулу Ядра и электроны; все с тем же именем, что и источник поля, заряженные частицы отталкивают их, и все противоположные заряженные частицы являются attracted.
As в результате электрические центроиды положительных и отрицательных зарядов отклоняются друг от друга + __Совершенно другой, и диполь появляется в молекуле (B、 США-II1-47).Его наличие определяет дальнейшее притяжение молекулы к источнику электрического поля, и диполь все равно увеличивается(Б, рисунок II1-47).
Появление дипольного поля в неполярной молекуле связано с ее деформацией, то есть с отклонениями от привычной внутренней структуры, которые наиболее устойчивы при отсутствии внешней influences. So, диполь, вызванный действием внешнего электрического поля, сохраняется до тех пор, пока действует электрическое поле.
Величина таких диполей индукции больше, поскольку электрическое поле становится сильнее, и молекулы с большей вероятностью деформируются. То есть его деформируемость увеличивается. Чем больше последнее, тем более вероятно взаимное смещение электронов, образующих атомное ядро и молекулу. Большинство внешних электронов наиболее слабо прикреплены к атомному ядру, поэтому именно их смещение под действием внешнего поля играет главную роль в деформации.
Для полярных молекул с постоянным диполем действие электрического поля несколько отличается от действия неполярных молекул. Случайно расположенная Полярная молекула (а, рис. 111-48)под действием магнитного поля вращается в направлении противоположно заряженного конца диполя. То есть она направлена в определенном направлении относительно электрического поля (5, Рис. 111-48).в то же время деформация молекулы больше или меньше, в результате чего диполь increases.
So, общие следствия поляризации полярных молекул, а именно их воздействие электрическим полем, состоят из 2 эффектов: ориентации молекулы и ее деформации. Вариант поляризации-направления-f Если другие условия те же, то ориентация молекул проста, и диполь становится больше important. So в относительно слабом электрическом поле молекулы более полярны, поэтому они притягиваются к источнику электрического поля, изменяя ориентацию самой молекулы.
По мере увеличения напряженности поля значение деформируемости молекулы начинает возрастать. Индуцированные диполи, возникающие во время деформации, когда они достигают определенной суммы, первоначально имеют более низкую полярность, но более легкие, деформируемые молекулы в результате становятся более полярными и могут создавать более крупные результирующие диполи, которые сильнее притягиваются.
При достаточно сильных полях и легкой деформируемости то же самое может происходить и с неполярными молекулами, поляризация которых сводится только к деформации. Исходя из вышесказанного, можно перейти к проблеме межмолекулярного взаимодействия. Допустим, у нас достаточно 2 Рисунок 111-47.Поляризация неполярных молекул. 0 ^ — 0 Цифра больных-48.
Поляризация полярных молекул. Полярная молекула, которая плотно расположена. поскольку концы одноименных (полюсов) NX-диполей отталкиваются друг от друга и притягивают противоположно заряженные концы, обе молекулы стремятся ориентироваться таким образом, что в них появляются противоположные полюса. neighborhood.
In аналогичное расположение{а, рис. III-49) взаимное притяжение противоположных полюсов компенсируется лишь частично взаимным отталкиванием одних и тех же полюсов друг от друга other. As в результате постоянное дипольное взаимодействие вызывает притяжение между молекулами, называемое ориентирующей силой.
Благодаря наличию последнего обе молекулы становятся вместе (б, рисунок II1-49), более или менее прочно закрепленными. При этом определенные варианты каждого из них возникают под действием более близких полюсов соседних молекул. Индуцированные диполи, возникающие в результате этой деформации, взаимодействуют так же, как и постоянные диполи, создавая так называемую дипольпроводящую силу, проявляющуюся также во взаимном притяжении молекул.
Суперпозиция этих сил относительно сил ориентации связана с увеличением длины диполя (I, рисунок II1-49), что приводит к увеличению межмолекулярного взаимодействия. Случай взаимодействия полярных и неполярных молекул (а, рис.111-50) отличается от описанного выше только тем, что индуцированный диполь (Б, рис. 111-50) сначала возникает в неполярной молекуле, а затем взаимодействует с диполем полярной молекулы.
Напротив, в случае взаимодействия двух неполярных молекул требуется принципиально иная интерпретация. Действительно, казалось бы, если в обеих молекулах нет постоянного диполя, то сила взаимного притяжения между ними не возникает. Но известно, что, например, инертные газы, когда температура достаточно падает, становятся жидкими, и тогда solid.
As в результате между этими неполярными одноатомными молекулами все еще существует определенное напряжение. Генерация этих сил рассеяния тесно связана с непрерывным движением, в котором находятся атомное ядро и электроны, являющиеся составными частями молекулы. Некоторые модельные представления о них можно получить на основе рис. 111-51.
Представьте себе 2 ближайших атома инертного газа (а, рис. II1-51).Благодаря непрерывному вращению электронов и колебательному движению ядер в каждом из этих атомов всегда происходит временное смещение орбиты электрона вблизи ядра, и в результате может временно появиться диполь. Но каждый из этих диполей неизбежно влияет на свою ориентацию и полностью влияет на ориентацию диполей в аналогичное время, которое происходит в соседних атомах Диаграмма II1-49.
Схема взаимодействия 2-х полярных молекул. Диаграмма III-50.Схема взаимодействия полярных и неполярных молекул. И Идите в ОО 6 ВПЕРЕД, ВПЕРЕД! Один И Диаграмма II1-51.Схема модельной интерпретации распределенных взаимодействий. Несомненно, значение предпочтительной окрестности противоположного полюса(B, рисунок III-51) не совпадает с названием (£, рисунок III-51).
- Диполи, возникающие таким образом, могут существовать очень мало времени, но с каждым последующим появлением сохраняется определенное направление регулировки(D, рисунок II1-51).Соседство противоположных полюсов возобновляется почти непрерывно. Это и есть причина постоянного притяжения между частицами, называемого дисперсионной силой.
Все взаимодействия вышеуказанных типов молекул зависят от межмолекулярных сил(или » Ван-дер Vaalsa>*).Относительная значимость каждого вида Al в любом случае зависит прежде всего от полярности и деформируемости-2 свойств взаимодействующих молекул. Сила индукции зависит от обоих факторов, но сами они играют лишь небольшую роль.
Чем выше полярность, тем больше роль силы ориентации, тем больше деформируемость и роль силы рассеивания. Людмила Фирмаль
По общему характеру выражения межмолекулярные силы радикально отличаются кулоновской силой и ее единственностью. Если кулоновское взаимодействие может быть выражено как силой притяжения (противоположный заряд частицы), так и силой отталкивания (аналогичный заряд), то межмолекулярная сила возникает только с силой притяжения.
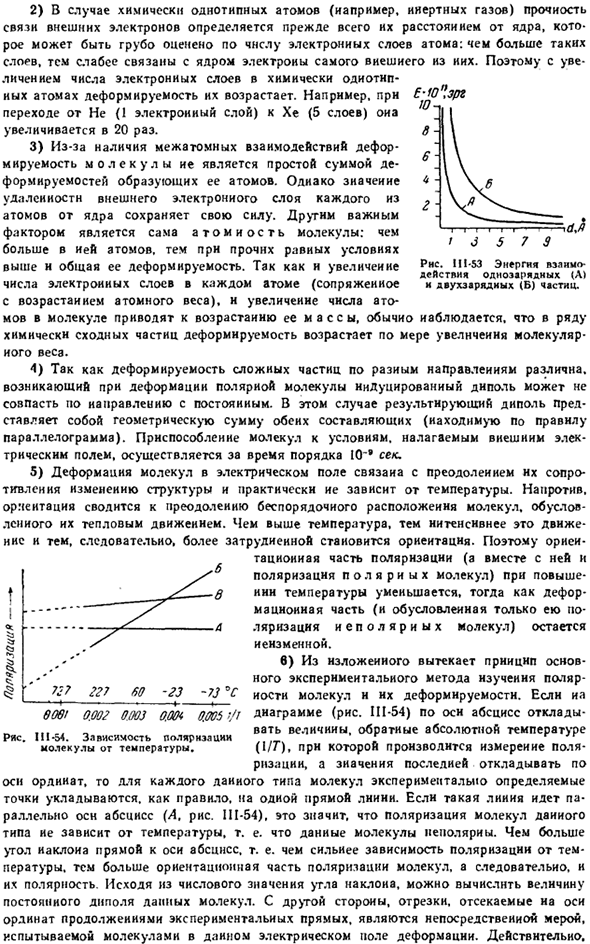
Однако если частицы находятся очень близко, то взаимное отталкивание внешнего электронного слоя начинает резко сказываться. Сила отталкивания, возникающая таким образом, очень важна в ситуациях, когда частицы вступают в непосредственный контакт и в то же время ослабевают по мере увеличения расстояния гораздо быстрее, чем сила притяжения (рис. Ш-52).
В результате общее взаимодействие при сближении частиц сначала выражается взаимным притяжением, которое всегда продолжает увеличиваться, затем ослабевает и, наконец, превращается в отталкивание. Расстояние между центрами частиц, где сила притяжения уравновешивается силой отталкивания (d), соответствует устойчивому равновесию и характерно для пространственной структуры соответствующей материи.
Добавь 1) при характеристике взаимодействия частиц нам часто приходится говорить не о силах, а об энергии их взаимодействия(то есть той работе, которую нам нужно проделать, чтобы полностью отделить частицы друг от друга). в этом случае в знаменатель уравнений Основного Закона электростатики уже входят Квадрат и первое расстояние.
Для 2 / 1d-это заряд 2 частиц (е единиц), а для d-расстояние между центрами (Ангстрем).Энергия кулоновского взаимодействия этих частиц (и вакуума) составляет 332 Z ^ Z ^ Jd ккал / моль. На рисунке показано изменение этой энергии в зависимости от расстояния. II1-53 (для точечных частиц). \Сила * \Притяжения Т ЛЧ \ д rtrg / ВР>*, т»г、 ■ ■ …_ 1 / отряд ! / Отталкивающий 1 я / ♦ / Общие сведения 1 J взаимодействие Р * С Ш-52.
Схема притяжения и отталкивания. * Вай-дер-Ваальс впервые дал уравнение состояния газа (1873), учитывающее взаимное притяжение молекул. 2) для химически подобных атомов(например, инертных газов) прочность связи внешнего электрона определяется прежде всего его расстоянием от ядра.
Это можно аппроксимировать числом электронных слоев атомов: чем больше таких слоев, тем слабее самые внешние электроны в них. Например, в b-10 переход от He (1 электронный слой) к Xe (5 слой) увеличивается в 20 раз. 3) из-за наличия межатомных взаимодействий деформируемость молекулы представляет собой простую сумму деформируемости образующих ее атомов. Однако значение удаленности электронного слоя вне каждого атома от ядра остается в силе.
Другим важным фактором 1 является атомарность самой молекулы. Чем больше атомов содержится, тем выше общая деформируемость материала. cecum. It обычно наблюдается, что в ряду химически подобных частиц деформируемость возрастает с увеличением молекулярной массы, поскольку как увеличение числа электронных слоев каждого атома(с увеличением атомного веса), так и увеличение числа атомов в молекуле увеличивают ее массу.
4) поскольку деформируемость сложных частиц в разных направлениях различна, индуцированные диполи, возникающие в результате деформации поляризационных молекул, могут не совпадать с определенным direction. In в этом случае результирующий диполь является геометрической суммой обеих компонент (это то же самое, что правило параллелограмма).
Адаптация молекулы к условиям, накладываемым внешним электрическим полем, осуществляется примерно за 10 секунд. 5) деформация молекул в электрическом поле связана с преодолением сопротивления структурным изменениям, которое, по сути, зависит от температуры. Напротив, для преодоления неупорядоченного расположения молекул вследствие теплового движения ориентация уменьшается.
Чем выше температура, тем интенсивнее это движение, а следовательно, тем труднее ориентироваться. Поэтому Ориентируйтесь Эта часть поляризации (и поляризация полярных молекул) уменьшается с увеличением температуры, но деформационная часть(и поляризация полярных молекул, возникающая только из нее) остается неизменной.
в) из вышеизложенного следует принцип основного экспериментального метода полярной поляризации Рис. 111-53 энергия действия однозарядных (А) и двухзарядных (Б) частиц. Ряса. 111-54.Температурная зависимость поляризации молекул. о’.ОО $ F из вау вставить. oo2 оооз Молекулы и их deformability. In на диаграмме (рис. Sh-54).
Ось абсцисс изображена как обратная абсолютной температуре, при которой измеряется поляризация(1/7″), и если последняя изображена вдоль оси абсцисс, то экспериментально определенные точки для каждого конкретного типа молекулы укладываются, как правило, в 1 прямую линию. Если такие линии проходят параллельно главной абсциссе (а, рис. Ш-54), то это означает, что поляризация молекул этого типа зависит от температуры, то есть эти молекулы неполярны.
Чем больше угол наклона линии относительно абсциссы, то есть зависимость поляризации от температуры, тем больше ориентационная часть поляризации молекулы, а следовательно, и полярность. На основании численных значений угла наклона можно рассчитать постоянные диполи этих молекул.
Непосредственность измерений, испытываемых молекулами в определенном напряженном поле. Положение продольной оси соответствует бесконечно высокой температуре, при которой декоративная часть поляризованного света равна нулю, и все это вызвано только деформирующим эффектом. Таким образом, можно вывести электрические свойства молекул.
Таким образом, линия в соответствует молекулам с большими постоянными диполями и низкой деформируемостью, а линия в-молекулам с малыми постоянными диполями и высокой деформируемостью. 7) внутримолекулярные силы, показанные в тексте, могут быть объяснены сравнительными данными, представленными ниже для нескольких простых молекул, характеризующихся различной полярностью и деформируемостью.
Относительная значимость отдельных компонентов межмолекулярных сил Относительная полярность молекулы вещества (N. o-1) относительная деформация молекулярной массы молекулы<H, 0-1) сила Орненга-Шунни s индуктивная сила H дисперсионная сила h Хжо……. 1.00 1.00 76.9 4.1 19.0 NHj ……. 0.80 1.49 45.0 S. 1, 497. Хси……. 0.56 п. 14.4 4.2 81.4 ИВГ……. 0.44 2.42 З. Е. 2.2 94 Л ПРИВЕТ…….. 0.21 3.65 0.1 0.4 99.5 Эта таблица показывает, что ориентирующая сила играет важную роль только в случае молекул HjO, которые полярны и относительно трудно поддаются deform.
It следует подчеркнуть, что вода занимает исключительное место position. As как правило, деформируемость полярных молекул enlyio значительно выше, чем у Hjos. Главную роль в их взаимодействии играет сила dispersal. In кроме того, это относится к низкополярным и неполярным молекулам.
8) важной особенностью рассеивающей силы является то, что диапазон ее действия ограничен. Если энергия кулоновского взаимодействия ослаблена пропорционально мощности 1 расстояния, то энергия дисперсионного взаимодействия ослаблена пропорционально его мощности 6.То есть, когда расстояние между частицами составляет 2 раза, кулоновское взаимодействие-2 раза, а дисперсионное взаимодействие-64 раза.
Таким образом, выраженное выражение дисперсионной силы требует достаточной аппроксимации взаимодействующих частиц. Второй важной особенностью дисперсионной силы является приближенная добавка. Каждая частица может одновременно рассеиваться и взаимодействовать с любым количеством близких частиц enough. At в то же время каждый атом одной и той же молекулы другой молекулы может более или менее независимо вступать в дисперсионное взаимодействие с атомами других молекул.
Таким образом, приблизительно понятно, что общая дисперсия, обусловленная взаимодействием сложных молекул, состоит из взаимодействия отдельных атомов. 3-я важная особенность силы рассеивания является ее versatility. To санировать возможность проявления кулоновских сил необходимо тем, что во взаимодействующих частицах имеется электрический заряд.
Кроме того, для всех постоянных диполей необходимо проявление силы поворота. Дисперсионная сила намного слабее силы Кулои, но все же играет хорошо известную роль во взаимодействии ионов. 9) уже отмечалось, что степень выраженности дисперсионного взаимодействия зависит главным образом от деформируемости соответствующей молекулы, которая обычно возрастает с увеличением молекулярной массы и числа химически сходных compounds.
At при этом, как правило, именно дисперсионное взаимодействие определяет общее напряжение, действующее между молекулами. Но чем больше эти силы, то есть, чем выше температура, тем, соответственно, происходит переход. (II§ 2) твердого вещества из твердого в жидкое и в газообразное состояние. Именно поэтому было замечено, что в ряде химически сходных веществ, которые обычно образуются неполярными или полярными молекулами, температура плавления и кипения увеличивается с увеличением молекулярной массы. Хорошим примером объяснения этой общей закономерности служит прохождение изменений в обоих чудовищных инертных газах.
Смотрите также:
| Валентная связь | Структура твердых тел |
| Типы простейших молекул | Водород |

