Оглавление:




Начало современной химии.
- Начало современной химии. Химия как точная наука началась в эпоху полного господства теории флогистона. Середину XVIII века, когда Ломоносов сформулировал закон сохранения веса, можно было считать более определенным временем возникновения, чем в прошлом. Суть основных законов этой экспериментальной химии состоит в том, что масса всех веществ, входящих в реакцию, равна массе всех продуктов реакции.
- Закон сохранения массы был научно обоснован количественным анализом, который открывает возможность точного изучения состава веществ и характера протекания химических процессов. Ломоносов экспериментально подтвердил правильность этой идеи (и самого закона сохранения веса) в 1756 году.
Вместе с формулировкой закона сохранения веса (1748) М. В. Ломоносов высказал следующие очень важные идеи: Людмила Фирмаль
Таким образом, была отвергнута не только идея теории флогистона, но и намечен принцип новой интерпретации процесса окисления. Последовательное применение количественных методов исследования, характерных для работы М. В. Ломоносова, было характерно для работы Лавуазье, предпринявшего окончательное опровержение теории флогистона и заслугу ее замены новыми ideas. It проводился в период 1772-1777 годов.
Экспериментами он доказал, что горение-это не реакция разложения, в которой выделяется флогистон, а реакция сочетания горячих веществ с кислородом воздуха. Поэтому таинственного и неуловимого «флогистона» больше нет needed. At в то же время все основные понятия претерпели радикальные изменения changes. It получается, что то, что ранее считалось элементом (оксидом), является сложным веществом, и наоборот, в предыдущей идее сложное вещество (металл) является элементом.
Изменив систему фрогенста»с головы до ног», лабоази заложил основы современной химической систематики. Наиболее полно его взгляды нашли отражение в написанном им»курсе элементарной химии». 1-8.Рисунок La Lauldron титульная страница книги 1-8.In на самом деле, это новые идеи. Чале, который не разделяют многие современники, поселился около 1800 года и получил широкое распространение.
Поднять этот вопрос можно было только на основании закона Ломоносова и нового химического system. It стал предметом полемики между Бертолетом и Прустом в начале 19 века. Суть вопроса заключалась в том, соединяются ли вещества в определенном количественном соотношении в зависимости от их свойств, или же эти соотношения неопределенны и изменчивы и зависят только от количества вводимых в организм веществ. reaction.
In в первом случае образование нескольких 2-х элементов небольшого соединения, резко отличающихся по составу, является expected. In в последнем случае следует получить набор таких соединений, состав которых постепенно меняется. Поэтому в первом случае состав конкретного вещества предполагается очень четким и независимым от способа его получения, а во втором случае состав не является clear.
So в целом это был спор о том, изменяется ли состав вещества нерегулярно и непрерывно. Потому что этот вопрос является фундаментальным для химии, jarff » chem Т Р А И Т Е £Л£М Ф. N7AIK! ДЕ ШИМИ、 rtbCMTt да.4J OA MX MOUVSA0 ″ p’tnta W — — — — — — n niTBMU-、 * 14NUIII, 4 * D M А у лучших»с ЖБ * Р -. * В » ♦ / Ом. М У Ин. &M + * 1schfsch * rt + mt m Париж См * Кцг комплект. В чем же разница? DCC IUIII. • — *«’»- fcr 4, Ф.1л».- £4 В * «’ А ** Лейтенант Л.. *-
- Ее можно назвать наукой о качественных изменениях в организме, происходящих под влиянием изменений количественного состава » (Энгельс). Сторонниками теории непрерывных изменений состава вещества были Бертоле, сторонниками прерывистого one-Proust. As в результате дебатов, продолжавшихся несколько лет (1801-1807), взгляды Пруста получили признание химиков.
Таким образом, закон постоянства состава-2-й Основной закон химии-был established. It состоит в том, что каждое соединение имеет определенную и постоянную величину composition. As в результате следует, что состав соединения не зависит от способа его получения. Только на основе этого закона стало возможным установить количественное соотношение,
в котором различные химические элементы взаимосвязаны. Людмила Фирмаль
Эти отношения изучались и систематизировались, главным образом Дальтоном, в течение нескольких лет, начиная с 1803 года. Он ввел в науку понятие объединения Весов элементов, позже названных «эквивалентами». эквивалент-это вес элемента, который соединяется с 1 (точнее, 1,0079) частью водорода по весу или замещается соединением.
Важность этого понятия для химии определяется тем, что элементы всегда связаны между собой в определенном весовом соотношении, которое соответствует их эквивалентам(закон единиц).таким образом, состав сложного вещества может быть представлен целым числом эквивалентов составляющих его элементов.
Если доля соединения рассматриваемого элемента уже известна другому лицу, эквиваленты которого установлены, то найти эквивалентную цифру не составит труда. Образцы. Рассчитайте эквивалентную массу кислорода, исходя из состава процентов воды: водород 11,2%. 88,8% кислорода. Если вес предмета 2.Масса с водородом составила 88,8.Включая кислород, затем взвесьте. Существует масса, которая включает в себя водород.
В том числе и кислород. I 008 * 88 8 Очевидно, что » > » — >-2 2 равно 8,0 и будет эквивалентной массой кислорода. Пример 2.Медь образует соединения с кислородом, анализ которых установлен. Он состоит из меди 79,9% и 20,1% oxygen. To рассчитайте эквивалентное количество меди, настройте соотношение: 79,9 в весе. Вес с медью был 20,1.В том числе кислорода И^ Н И я 8 мм м Откуда 8-79. 9 20.1 31.8
В дополнение к комбинации меди и кислорода, рассмотренной в Примере 2, в дополнение к тому, что называется оксидом меди, оксид меди отличается по составу, то есть медь составляет 88,8%, кислород-11,2%.Исходя из этих данных, если вычислить эквивалентное количество меди в нитрите, то оно будет равно 63,6.То есть он в 2 раза больше оксида.
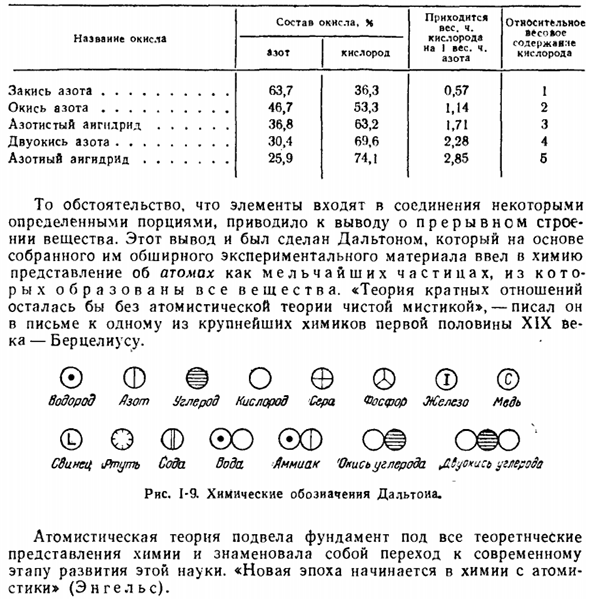
Учитывая такие случаи, Далтон установил закон множественных отношений. Если 2 элемента образуют между собой несколько соединений, то вес 1 элемента объединяется с другим, таким же весом, рассматриваемым как малое целое число. Этот закон хорошо иллюстрируется на примере оксидов азота. В связи с тем, что элементы входят в состав соединения в определенных специфических частях, мы пришли к выводу о разрывной структуре вещества.
Этот вывод был сделан Дальтоном, который на основе собранного им обширного экспериментального материала ввел в химию идею атома как мельчайшей частицы, в которой образуется вся материя. «Теория множественных отношений осталась бы чистым мистицизмом без атомизма», — писал он в письме к бертелсу, одному из величайших химиков первой половины XIX века. © FFoe®©
Водород бункер углерод кислород сера Рослер железо медь Вопрос о Ф©О©Ф ОС ой Свинец\ртуть содовая вода аммиак ’ окись углерода£tyc * u: b углерод Rns. 1-9. Химическое обозначение Dalyoiia. Атомизм заложил основу всех теоретических представлений о химии и показал переход к современному этапу развития этой науки. «Начинается новая эра химии с атомизмом» (Энгель).
Название оксида Закись азота. 。 。 。Оксид е.•. 。 。Закись азота безводная двуокись азота. 。 Безводная азотная кислота Состав оксидов. N рассмотрим вес. 1. содержание кислорода в весе. В том числе азота а * > Т кислорода 63.7 36.3 0.57 46.7 53.3 1.М 36.8 63.2 1.7! 30.4 60.6 2.28 25.9 74.1 2.85
Смотрите также:
| Фундаментальные теории и законы химии | Атомы и молекулы |
| Фундаментальные теории и законы химии | Молекулярные веса |

