Оглавление:

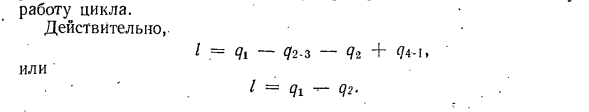






Принцип возрастания энтропии и физический смысл второго закона термодинамики
- Генерализованный (регенеративный) цикл Карно Более высокая тепловая эффективность, чем реверсивный цикл Карно, не достигается в определенном температурном диапазоне. Однако возможно выполнение и других обратимых циклов в присутствии 2-х источников тепла постоянной температуры, отличающихся по составу от цикла Карно, но при дополнительных условиях получается та же тепловая эффективность, что и у цикла Карно. Такие
циклы являются генерализованными или регенеративными. Рисунок 8-8 представляет собой цикл, состоящий из 2 Изотерм 1-2 и 3-4, и любых 2 произвольных обратимых процессов 2 и 4-1, которые равноудалены в горизонтальном направлении: 1-2-3-4 shows. In изотермический процесс 1-2 от теплопередатчика при температуре T1, теплотворной способности ql = 7 (s2-st) fluid. In процесс 2-3, состояние рабочей жидкости изменяется, измеряется в квадрате и постоянной теплоте йй / Т、 / — dQ
подается на рабочую Людмила Фирмаль
= 0, поэтому для изолированной теплоизоляционной системы ДС> 0, (8-16) То есть уравнения (8-15) и (8-16) показывают, что энтропия изолированной системы (dQ = 0) остается постоянной при обратимых изменениях и возрастает при необратимых изменениях, но никакое условие не может быть выполнено. reduced. It необходимо отметить следующие моменты: энтропия отдельных объектов в изолированной системе может не только оставаться увеличенной или изменяться,
но и уменьшаться, например, когда объект излучает тепло. Обобщая результаты, полученные при обратимых и необратимых процессах, протекающих в изолированных системах, можно выразить формулы (8-15) и (8-16) в следующем виде: ДС ^0.(8-17) Знак равенства относится к обратимым, а знак» больше » — к необратимым процессам. Весь реальный процесс необратим, поэтому энтропия изолированной системы всегда возрастает. Сам факт увеличения энтропии, по-
- видимому, не имеет особого значения, но увеличение энтропии в ходе необратимого процесса связано с уменьшением работоспособности изолированной системы. Рассмотрим идеальную машину для работы в соответствии с Карно cycle. In в этом случае тепло Qj передается рабочему телу при температуре 7, а тепло Q2 перемещается в теплоприемник при температуре 7%. Положительная работа L-Qi-Q2. К. п. н. L / =(Qi-Q2VQ1 = L / Qlt Или L = lA = Qi(1-TJTJ.(B ’ 18) между теплообменным устройством температуры
T1 и рабочим телом вводят промежуточный источник тепла температуры T2 <T [<< 7.(с конечной разницей температур) и оттуда к рабочему телу, которое выполняет обратимый цикл Карно. Когда тепло Qx поступает в машину при низкой температуре T < C 7\, разница температур, при которой выполняется обратимый цикл Карно, невелика, поэтому очевидно,
Во-первых, тепло от теплообменника необратимо переходит к промежуточному источнику Людмила Фирмаль
что положительная работа должна быть уменьшена. И затем… V — = Qx(1-TJT’I). Снижение рабочей емкости рабочего тела за счет введения дополнительного необратимого процесса теплообмена от теплообменника к промежуточному источнику тепла определяется по формуле П0 = Л-Л ’ — КЖ 1(1-7U7) — (1-тур)] — = Ци(тят [-ТГ / 7 \)、 Или u = r2(QJT [- QJTJ = G2D5sist.(8-19) Это уравнение называется
уравнением Гая-Стодолы. Снижение работоспособности изолированной системы, в которой происходят необратимые процессы, равно приращению энтропии системы и произведению абсолютной температуры теплоотвода. Эта потеря производительности-это тепло, потраченное впустую на окружающую среду. Все необратимые процессы в изолированной
системе сопровождаются обесцениванием энергии. Это переходит от более полезной формы к менее полезной. Происходит рассеивание энергии и ее деградация. Энтропия системы возрастает. Все спонтанные, то есть необратимые процессы, всегда протекают с увеличением энтропии. Таким образом, принцип увеличения энтропии изолированной системы является общим выражением второго закона термодинамики.
Смотрите также:
Решение задач по термодинамике
| Теорема Карно. | Максимальная работа. Эксергия |
| Изменения энтропии в обратимых и необратимых процессах | Энтропия и статистический характер второго закона термодинамики |

