Оглавление:




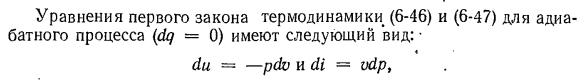



Изотермный процесс.
- Изотермический процесс Четыре Процесс, протекающий при постоянной температуре, называется изотермическим (T = const, или dT = 0).Процесс кривые называются изотермами (рис. 7-4). Идеальный газ для изотермического процесса рv = RТ = F(Т) = const и Или Pfli = П& — 2 и ПХ / П2-П2 / в (7-10) При постоянной температуре объем газа
изменяется обратно пропорционально давлению (закон Бойля-Мариотта). в pv-Ваграме изотермический процесс представляет собой Изозидную гиперболу. при T = const приведены в простом виде. = дл= / 4-2. 4 ^человек в теплоте, подводимой к рабочему телу, численно равен работе изменения объема. Если мы знаем уравнение
Основные уравнения первого закона термодинамики Людмила Фирмаль
изотермического процесса идеального газа, мы можем вычислить поведение этого процесса. Конкретная задача изменения объема Но из изотермы ПВ = Д-ви Д /и Р-pxvjvy Для этого П2. Я-РХ в ^ ДВ / в (Миллилитр) Если мы интегрируем последнее уравнение、 I-pYvY в v2 / vt = q. 7-4. Формулы (7-11) определяет работу идеального газа и внешнего тепла. Если вы идете к основанию 10 логарифм、 г = / = 2,3
фута футов журнал vjxb = 2.3 ПМ журнала ПГ / Р2•= 2.3 РТ \ г П2 / вл = = 2.3 \ РТ ГПЛ / Р2. (7-12) ♦ Удельная доступная внешняя работа G определяется по формуле Пирог В = — й ВДП = Пи футов Дж ДП / п = футы футы в РХ / Р2•(7-13) Пи П、 То есть в изотермическом процессе идеального газа, V-I-q, или работа более искусна, и количество доступной (полезной) работы и количество тепла, получаемого телом, будут равны друг другу. 1 изотермический корпус G! Семьдесят КТ =
- dqldt = йд / 0 = ’ ±ОО. — Энтальпия и внутренняя энергия идеального газа не меняются. То есть, di = 0 ″ и du = 0. На диаграмме изотермического процесса-Ts показана линия, параллельная оси. Абсцисса (см. рис. 7-2).для определения изменения энтропии используйте формулу(6-42). С2-с = СV -!нт2/TxR в v2 / ОБТ Откуда s2 — / = R Jn v2 / vl и s2-st = R в pjp2. (7-14). Теплота, участвующая в изотермическом процессе, равна произведению изменения
энтропии (SJ на s2-абсолютная температура T: М = Т(С2-СЗ. Способ теплоизоляции Процесс, протекающий без подвода и отвода тепла, то есть при отсутствии теплообмена рабочего тела с окружающей средой, называется теплоизоляцией, а кривая этого процесса называется теплоизоляцией. dq = 0, а следовательно, и q-0. Обратимый процесс термоизоляции может осуществляться
Необходимым условием для получения процесса теплоизоляции является Людмила Фирмаль
в цилиндрах с полностью теплопроводными стенками, в которых поршень движется бесконечно медленно. Выведем уравнение термоизоляции. из уравнения первого закона термодинамики при dq = 0、 C}, dT-vdp = 0 и cvdT + pdv = 0. Если мы разделим первое уравнение на 2-е уравнение、 Если мы разделим первое уравнение на 2-е уравнение、 。 {>ДТ ВДП у. ДВ ДП ’■ ■ ; ■ — — — г или к -= — — -. cvdT * pdv’V .п если мы интегрируем последнее уравнение с условиями k =
const(cp = const и co = const)、 В пи к ^ ДВ {в = — ^ dplp и•K в v2lvv = ^ в pjp2.Пирог. После увеличения, есть: (ФЖ / ЖТ) к = pjp%, или pxv \ = преобразования P2V \ Т-.Где находится адиабатическое уравнение ПВК-константный (7-15) В адиабатическом процессе произведение давления на объем газа до степени k является постоянной величиной. значение k называется адиабатическим индексом. Рассмотрим
взаимосвязь между основными параметрами процесса теплоизоляции. Из уравнения адиабаты、 Я PJP2 =и vJVi = [pjpif. Если эти соотношения параметров тела задаются уравнением состояния экстремумов процесса (pjp) * tpjvd — (^UL), то после соответствующего преобразования、 к-1 ’TJTt-Mvtf — ^ ipJrt k. конкретная работа по изменению объема / = J pdv, исполнитель С. Экологические отходы в равновесном адиабатическом процессе могут быть рассчитаны
по адиабатическому уравнению Р = P & тлв * НЖК Я = пр О * (ДВЛ и*)= [ЛП и{/(1-К)) (\В〜 * — В Дж-)- Cx _ Pioj I 1__ _ 1 \ 1 / Pi v’t P’ZV-1 \ Откуда / =(1 ИК-1) (пипи-п2в2). (7-16) Из выражения (7-16) можно получить следующее выражение: I-(pLL-1) (1-7U7); I = (//Λ-1) (Λ^γ 2).Соотношение температуры заменяется соотношением объема и давления / =(P, 1) [l-(Л/Р») -] =(ЛЛ / л — «ой!- (я / ОИ) «часть все зависимости между p, v, T и уравнением работы получены при условии k = const.
Использование переменной A обычно принимает среднее значение/ g в calculation. It соответствует изменению температуры процесса по формуле Мне. к-КПЯ / резюме | = ’ / Aw. By время Первый закон термодинамики в Азии (6-46) и (6-47) уравнения Форма процесса купания (dq-0) выглядит следующим образом:- 」 отель Du = — PDV и Ди = vdpt уравнения первого закона термодинамики в Азии (6-46)и(6-47) Форма процесса купания (dq-0) выглядит следующим образом:- 」
отель Du = — PDV и Ди = vdpt Откуда (Ди / Ди)$—P и (Ди / ДП) х = в Из этих отношений вы можете получить (Ди / ДУ)с… (в / п) (ДП / ДВ) С. Полученное уравнение является дифференциальным уравнением изоэнтропического процесса. В этом уравнении (di! ДУ)с = К. Согласно первому закону термодинамики, работа изменения объема в адиабатном процессе получается за счет уменьшения внутренней энергии тела. СР = const и / = уй-У ’ 2 = С9(/ Т-Т2)\ cvφconst I-Cvm I 11 » Cvm / 0 U Цифры: 7-5 По мере расширения газа его внутренняя энергия
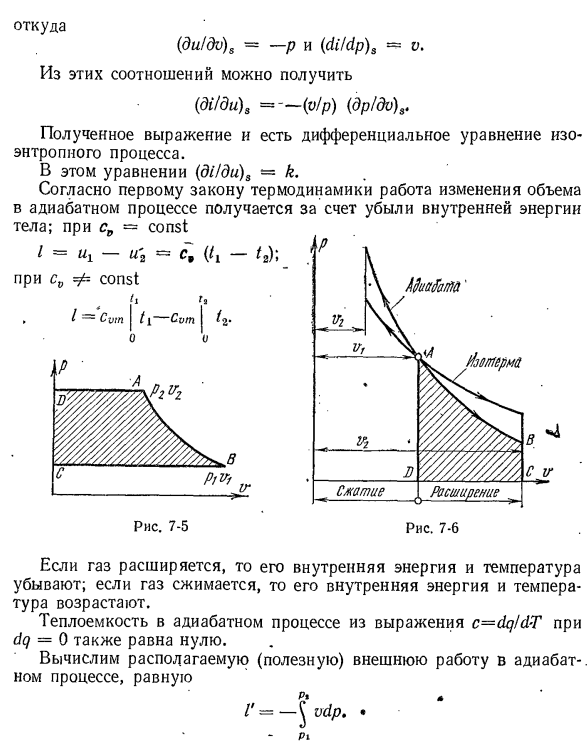
и температура уменьшаются. Когда газ сжимается, внутренняя энергия и температура увеличиваются. Теплоемкость процесса теплоизоляции по формуле c = dq / d-T = dq = 0 также будет равна нулю. Рассчитайте доступные (полезные) внешние работы в процессе теплоизоляции п * * / ’=- й ВДП. * пи Расширение сжатия рис. 7-6 В реверсивном процессе термоизоляции идеального газа, доступная внешняя работа в два раза больше, чем объемная работа изменения,
и знак обращен. Фактически, из адиабатического уравнения (7-15) видно, что это kdv / v = r = — dp / P il и ’- vdp = kpdv, то есть dl’〜kdl. So … Ф ’=(К / К-1) (пл-p2v2). ’(7-17)) И затем / ’=кл. Графически организованы внешние работы изображены на схеме ЛП ФВ. BCD (рис. 7-5), или область, ограниченная технологическими линиями, крайней абсциссой и осью ординат. Из рисунка 7-6 видно, что уравнение
термоизоляции K> 1, поэтому на диаграмме ru оно круче, чем изотермическое. Для обратимого адиабатического процесса dq = 0; таким образом、 ds = dq / T-0 и s2—const, (7-18) То есть обратимый адиабатический процесс одновременно является пустым (или постоянной энтропией) и изображен на диаграмме rs вертикальной линией σ-L, параллельной оси ординат(см. рис.7-2).
Смотрите также:
Решение задач по термодинамике
| Тепловая Ts-диаграмма. | Политропные процессы. |
| Изохорный процесс. | Основные положения второго закона термодинамики. |

