Оглавление:





Изохорный процесс.
- Общие проблемы исследования процессов| Первый закон термодинамики устанавливает зависимость между количеством теплоты, изменением внутренней энергии, внешней работой газов и количеством теплоты, подводимой к телу или отводимой от него, в зависимости от характера процесса. К основным процессам,
которые очень важны как для теоретической, так и для практической работы техники, относятся: Изобарный, протекающий при постоянном давлении; изотермический, ; теплоизоляционный, возникающий при отсутствии теплообмена с окружающей средой. Кроме того, существует группа процессов, которые при определенных условиях
протекающий при постоянной температуре Людмила Фирмаль
обобщаются на основной процесс. Эти процессы называются политропами и характеризуются постоянством теплоемкости в процессе;. Для всех процессов, установлены следующие общие методы исследования: получены уравнения для технологических кривых диаграмм pv и Ts. Установлена зависимость между основными параметрами рабочего тела в начале и в конце процесса. •
Изменение внутренней энергии определяется формулой, которая справедлива для всех процессов идеального газа. Г. -У <1-уй-я ЧВ(он-с см-с ВТН тт. Или в определенной теплоемкости: 1 «Р-= if2 заключен ОПС-м *.Работа по изменению количества газа рассчитывается по основной формуле ЖЖ ^ pdvJ ^ Ф (в) ДВ \ Ви ЧХ Количество тепла, участвующего в процессе, определяется по формуле ’Р И4′ 01 — * —
- $ Cxdt = СХ | т% — мне \ ты \ < х 0,0 Изменение энтальпии процесса определяется формулой, которая справедлива для всех процессов идеального газа. Или в случае постоянной теплоемкости: — =ы? В » — / Ф); Изменение энтропии идеального газа определяется по формуле:/ \ tГ-S! = cv в TjTx + I в С?•Р’s2-ЗХ = СР Iny2/ 7 \ — Р2 / ПГ.^^Рассматриваемый процесс считается обратимым. I£ — / равный процесс принятия
Процесс, происходящий в постоянном объеме, называется равенством (dv = 0, или v = const).Кривые процесса называются iso-P 1 o r и T choir. На рисунке 7-1 показан график процесса. И1 1 pv = i = RT для t> = const получаем: ПЛТ = Р / в = Ф(в) = const и — При постоянном объеме давление газа измеряется p2 v2^. в прямой пропорции к абсолютной температуре: Рис-7л pjp% » 777V
.Из уравнения идеального газа Людмила Фирмаль
4(7-1) так как d = 0, то внешняя работа газа при v = const будет равна пуле. И так оно и есть.、 / = й ПДВ = 0. Wi. Одноразовая (полезная) внешняя работа, которая может быть перенесена на внешний рабочий объект/’ И = —] ВДП = — в (П2-п).Пирог. Из полученной формулы видно, что полезная внешняя работа равнобедренного
процесса / равна работе толчка?= * Pxv-p2v. например, вы нажимаете несжимаемую жидкость вдоль канала от одной секции к другой. основные уравнения первого закона термодинамики (5-9) при dl = 0 принимают вид: dqv = Гуф = Cudt. Количество тепла, участвующего в процессе с определенной теплоемкостью 。 Qvj я-2=) (ду / ДТ) ВДТ =
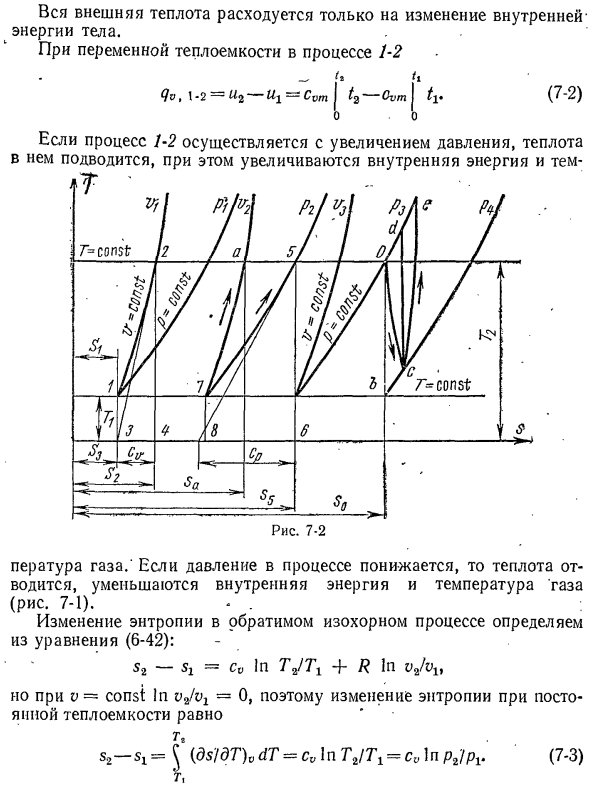
й ЧВ ДТ = с, (/8-у = ма-ти ТТ Все внешнее тепло расходуется только на изменение внутренней энергии организма. Процесс 1-2 переменная теплоемкость Ути. Запустите процесс 1-2 с увеличением давления, энергии внутри и Рисунок 7-2 Температура газа. Когда давление в процессе понижается, тепло удаляется, что уменьшает внутреннюю энергию и температуру газа(рис. 7-1). —. Изменение
энтропии в обратимом процессе определяется из уравнения (6-42). С2-ЗХ = CV в TJTX + Р 1″vjvlt Однако, если v = const, если vjvx = 0, то изменение энтропии при постоянной теплоемкости равно т. С2—(ДС / ДТ ^ ДТ ^ CvlnTjT ^ CvlnPt / ФВ(7-3) Как вы можете видеть, это уравнение является pz. 7>изолинии на рисунке обозначены кривые 1-
2 (рис. 7-2).Касательная кривой 1-2 в любой точке указывает на значение истинной теплоемкости cv. Действительно, согласно правилу, значение касательной в точке 2 Анализ изометрический,’ %• 3-4 ^ т(<isidt)= dqJdT = ЧВ «
Смотрите также:
Решение задач по термодинамике
| Приближенные значения теплоемкостей. | Изотермный процесс. |
| Тепловая Ts-диаграмма. | Политропные процессы. |

