Оглавление:



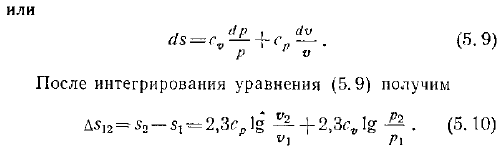

Изменение энтропии идеального газа при изменении состояния
- Поскольку каждому состоянию соответствует определенное значение энтропии, энтропия является функцией состояния, даже если состояние системы изменяется, изменение энтропии не зависит от изменения состояния. Изменение энтропии будет равно разнице энтропии системы во 2-м и 1-м состояниях A5 52-5.как и в случае энергии и энтальпии, при термодинамическом расчете не нужно знать значения энтропии 2 и 1 в состояниях I и 2, но достаточно знать значение D.
Так как согласно уравнению (15-3) предел насыщения зависит от общего давления, то найденная кривая и, следовательно, весь график справедливы только для данного давления. Людмила Фирмаль
Если мы знаем изменение 2 независимых параметров состояния, мы ранее показали, что мы можем вычислить изменение любой функции состояния 2.3.Используйте уравнение первого закона термодинамики 3.5, чтобы найти уравнение, связывающее изменение энтропии с изменением параметра состояния. s1ts-Т- Откуда. 1 и-B P замена c1 формулой 4.2 — IV. Т. Замена из уравнения состояния Соотношение R p T дает уравнение, которое коррелирует бесконечно малые изменения энтропии с бесконечно малыми изменениями температуры и объема. 5.4 Чтобы найти изменение энтропии при конечных изменениях T и V, необходимо вычислить значение интеграла ха-Х2-Д5 2.
- О Во время интеграции, он считается независимым от температуры, поэтому значение, а также значение 7. Возьмем знак интеграла как постоянную величину 2 Л Замените концевой 1-АПН -, Р Или да12 2. 3gv1 2. 3 18- 5.5 г В формулах 5.4 и 5.5 энтропия выражается как функция температуры и объема. Если вы используете уравнение Клапейрона, чтобы исключить объем из уравнения 5.4, вы можете выразить энтропию как функцию температуры и pressure. To для этого мы дифференцируем уравнение Клапейрона pp LT. п 1р в ИС-к s1T. Разделив левую часть на произведение po, а правую — на Г, получим уравнение состояния идеального газа в дифференциальной форме.
Такой график имеет то преимущество, что процессы смешения двух или нескольких потоков воздуха или процессы подмешивания к воздуху воды в жидкой или газообразной фазе можно с точностью решать простыми геометрическими построениями, которые на психрометрических -графиках дают лишь приближенные результаты. Людмила Фирмаль
Значение c a in 5.6 и присвоение 7 выражению 5.4 будет выглядеть следующим образом. Формула Майера 4.4 И затем… 5.7 После интегрирования уравнения 5.7 D5 2 e2- 2.3 18-7— ZA 1N 5.8 Один Сумма Формулы 5.4 LT Заменить T значением, полученным из выражения 5.6. Мы получаем В Или После интегрирования уравнения 5.9 Д5 2. −51 2, Зав1 5.9.
Смотрите также:
| Изменение внутренней энергии идеального газа | Изохорный процесс |
| Изменение энтальпии идеального газа | Изобарный процесс |

