Оглавление:




Равновесные (обратимые) и неравновесные (необратимые) процессы
- Когда температура и давление одинаковы во всех точках термодинамической системы, говорят, что система находится в равновесном состоянии. Кроме того, в системе энергия не обменивается между отдельными частями. Только системы, находящиеся в равновесии, характеризуются определенными значениями состояния parameters.
Дело в том, что если система не находится в равновесии, то давление и температура, а значит и удельный объем вещества в разных точках системы различны, нельзя говорить о конкретных значениях этих параметров в системе. Поэтому вы не можете использовать уравнение состояния для описания взаимосвязи между параметрами. Если нет взаимодействия, то есть система будет оставаться в равновесии до тех пор, пока не произойдет обмен энергией между системой и окружающей средой в виде работы или тепла. Поэтому нарушение равновесного состояния системы непременно связано с наличием работы или heat.
Когда температура газа и черного тела одинакова, линии исчезают, так как в этом случае 526 пламя поглощает как раз столько излучения фона, сколько оно излучает (закон Кирхгофа). Людмила Фирмаль
Наблюдения показывают, что причиной появления работы и тепла является разница в давлении и температуре между системой и окружающей средой. Однако наличие перепадов температуры и давления является необходимым, но недостаточным условием для возможности передачи энергии в должном объеме. form. In для того чтобы фактическое взаимодействие происходило при наличии разницы в температуре и давлении, необходимо также, чтобы поверхность, отделяющая систему от окружающей среды, допускала такую форму взаимодействия.
Например, если газ помещен в емкость с жесткими стенками, которые не могут реально изменить его форму, давление газа может отличаться от окружающего давления, но невозможно изменить его объем в виде механической работы и заменить energy. In в этом случае можно сказать, что система механически изолирована от окружающей среды. То есть, энергия не может быть обменена в виде механической работы из-за характеристик поверхности.
Поэтому для того, чтобы система каким-то образом обменивалась энергией с окружающей средой, во-первых, система должна обладать своими физическими свойствами, то есть физическими свойствами составляющих ее веществ во-вторых, поверхность, отделяющая систему от окружающей среды, позволяет системе иметь надлежащее взаимодействие. В-третьих, существует разница в температуре или давлении между термодинамической системой и окружающей средой. Интенсивность процесса энергообмена зависит от величины разницы между температурой и давлением. Чем больше эти различия, тем быстрее будет происходить энергетический обмен.
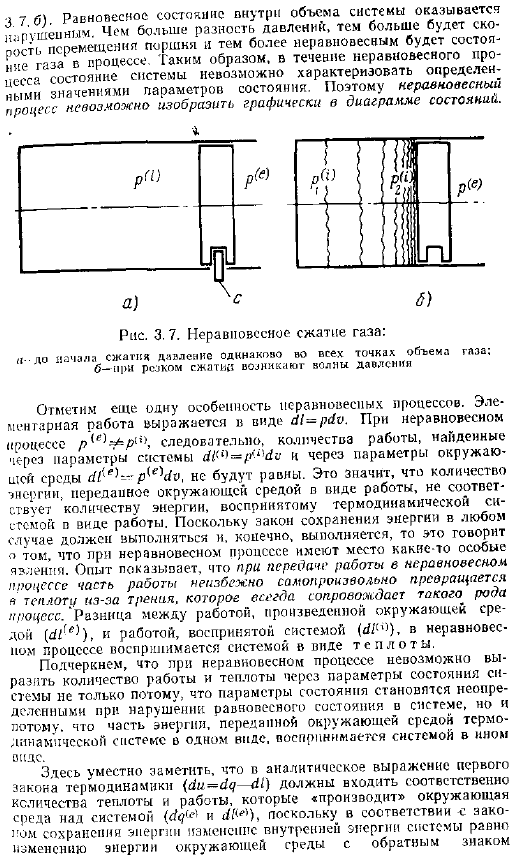
Если мы внимательно проследим за ходом термодинамического процесса, то увидим, что поведение термодинамической системы во многом зависит от того, велики или малы эти различия. Процесс, который происходит под влиянием небольшой разницы в температуре и давлении, называется равновесным или обратимым. Процессы, происходящие под влиянием больших перепадов температуры и давления, называются неравновесными или необратимыми. Рассмотрим на примере разницу между равновесными и неравновесными процессами. Предположим, что в цилиндре под неподвижным стопорным поршнем находится газ, находящийся в равновесии под давлением Р рис.3.7, а.
Предположим, что давление окружающей среды p намного больше давления газа, то есть существует большая разница давлений. Д — п б. Окружающая среда не может обработать газ, потому что поршень заблокирован. Если убрать здесь стопор с, то поршень начнет двигаться влево под воздействием перепада давления, и окружающая среда начнет работать. Во время движения поршня давление ke остается неизменным во всем объеме газа. Область повышенного давления на остальные газы p 1 p рисунок x 7 6 мы видим, что равновесное состояние в объеме системы равно p шее. Чем больше разница в давлении, тем больше SCT. Смещение поршня и газа в более неравновесное состояние будет происходить во время processing.
- В неравновесном состоянии состояние системы не может быть охарактеризовано определением параметров состояния. Поэтому неравновесный процесс не может быть графически представлен на диаграмме состояния. Рисунок 3.7.Неравновесное сжатие газа — Давление перед началом сжатия одинаково во всех точках объема газа. b-волна давления возникает при внезапном сжатии Отметим еще 1 особенность неравновесного процесса. Работа начальной школы представлена следующим образом в случае неравновесности объем работы, найденный в параметрах системы и параметрах среды Ch — p e 1c , не будет равен.
Это означает, что количество энергии, передаваемой окружающей средой в виде работы, не соответствует количеству энергии, воспринимаемой термодинамической системой в виде work. In в любом случае, закон сохранения энергии, так что ловкач будет удовлетворен. Конечно, она заполнена, и это смешно, и тем, что в неравновесном процессе есть какие-то особые явления. Опыт показывает, что если перенести работу в неравновесный процесс, то часть работы неизбежно самопроизвольно превратится в тепло из-за трения, которое всегда этому сопутствует. Своего рода процесс.
На фоне этого спектра в случае, когда температура пламени выше температуры черного тела, линия натрия в спектре будет более светлой, чем фон и, наоборот, более темной, чем фон, если температура черного тела выше. Людмила Фирмаль
Разница между работой L-e , производимой средой в неравновесном процессе, и работой LH , признаваемой системой, признается системой в виде тепла. В неравновесном процессе невозможно выразить величину работы и теплоты в параметрах состояния системы, так как параметры состояния становятся неопределенными при нарушении равновесного состояния системы, а также при восприятии некоторой части энергии, передаваемой термодинамической системе окружающей средой.
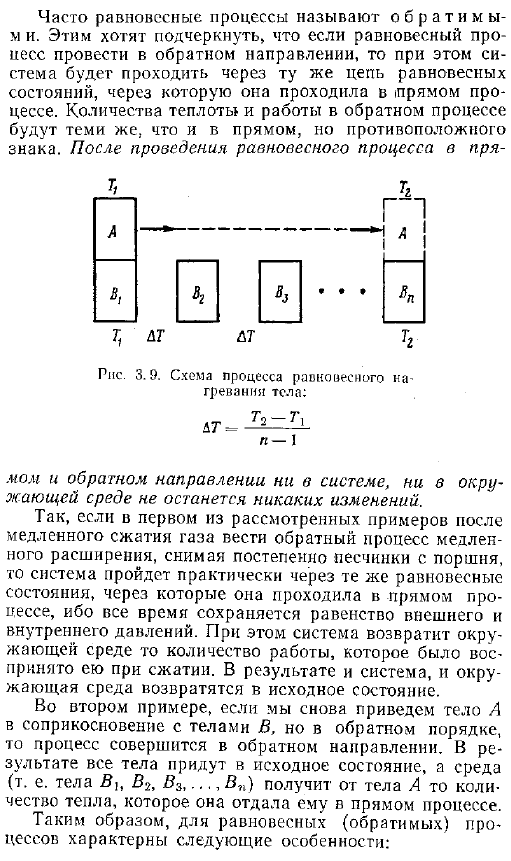
Еще 3 1 с первого анализа — 0, соответственно, количество теплоты и окружающей среды захлестывает систему, и согласно закону сохранения энергии, изменение внутренней энергии системы равно изменению энергии окружающей среды с противоположным знаком, часто называемому равновесным процессом обратимым, это означает, что если равновесный процесс выполняется в противоположном направлении, то он проходит по цепи в том же равновесном состоянии, что и ток. Количество тепла и работы в обратном процессе такое же, как и в прямом процессе, но противоположного ожного знака. После выполнения процесса балансировки непосредственно РПС.
Схема процесса равновесного нагрева тела Н-1 В противоположном направлении ни система, ни окружающая среда не меняются. Так, в первом рассмотренном примере, если после медленного сжатия газа осуществляется обратный процесс медленного расширения, а песчинки постепенно удаляются из поршня, то система претерпевает примерно такое же равновесное состояние, пройденное прямыми процессами, благодаря равенству внешних и внутренних процессов, pressure. In в этом случае система возвращает воспринимаемый объем работы в окружающую среду во время compression. As в результате и система, и окружающая среда возвращаются в исходное состояние.
Во 2-м примере мы заставляем тело а снова войти в контакт с телом В, но в обратном порядке, процесс идет в обратном направлении direction. As в результате все тела возвращаются в исходное состояние, а среда то есть тело B , B2, B3,… Получает количество тепла, отдаваемого в процессе непосредственно от тела А. Таким образом, для равновесного обратимого процесса характерны следующие особенности.1.Термодинамика давление и температуру системы всегда можно считать равными давлению и температуре окружающей среды. 2.At в любой точке процесса систему можно считать находящейся в равновесии.
Количество энергии, отдаваемой системе в виде работы окружающей средой, всегда равно количеству энергии, воспринимаемой системой той же формы. 4.Процесс равновесия бесконечно медленный. Эти особенности очень важны для термодинамики. Это связано с тем, что анализ процесса позволяет манипулировать параметрами состояния системы и определять объем работы и количество тепла через параметры состояния системы. Таким образом, полученные ранее формулы 3.1 7Y PTO и 3.3 T dz являются единственно правильными. Ко в случае равновесного процесса.
Смотрите также:

