Оглавление:


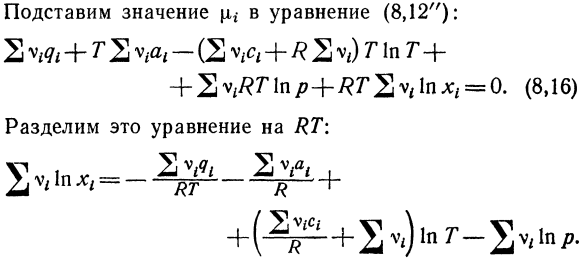






Закон действующих масс.
- Закон Божий masses. To делай См для определения равновесного состояния идеального газа «- вычислите si, его термодинамический потенциал F. Даны значения U и S из формул (8.13) и (8.14)、 Мы получаем: В дальнейшем Или Таким образом, ОАК-на основе уравнения состояния Клапейрона Менделеева Подставляя этот результат в Формулу термоди* Потенциал Ф: это хорошая вещь. (8.15))
Чтобы получить состояние равновесия в виде (8.12») вам нужно найти fxf= -^ -. 2 ^и умножается на сумму, не зависящую от u. следовательно, в результате、 Получен результат дифференциации этих работ Остальное Количество n не зависит от U. исключение члена RT bn в Xu(потому что X также зависит от u) три пьесы 1 + В,- В Т ТЛТ-Привет
Примечание во всех случаях Член выражения (8.15), u, входит в сумму Людмила Фирмаль
Привет р =-= в Щ-в НТ = в//. результат дифференцирования Φ относительно n выглядит следующим образом: Кроме того, мы представляем объем V из уравнения Клапейрона — Менделеев и прогуризм, получаем равенство: 1Н> = 1Н /?Ч-1нг-в/? Присвойте этот результат выражению / l*.、 Для краткости, Ci + R-hi-R в R = A.
Тогда формула / lg принимает следующий вид: Присвойте значение [xg-выражению (89l2ff). ^ О. (8.16) Разделите это уравнение на RT. В / в XI = ^ г Яш; + 13 В. Ф. Ноздрев 193 Вводится следующая нотация. Тогда равенство(8.16) принимает вид: — эйнп. (8,160 После аугментации получается следующее. Да:^ = аг ^ Т * + Вэ. (8.17)) Или Як= * ( / > , 7).
- Где f ((p, r) — константа химического равновесия. Это закон действующих масс. Он- Установите зависимость между концентрацией х \газа в смеси. Химия, необходимая для существования между ними Равновесие при заданной температуре и давлении. Изменяя значения, содержащиеся в этом соотношении、 Влияет на ход реакции. Массовый способ получения смеси
Идеальный газ, эффективный с некоторыми ограничениями Ограничение системы включая газ низкого давления; Диссоциация молекул, разбавление растворов, и даже Более сложная система. В качестве примера применения действующего закона Масса учитывает диссоциацию йодистого водорода.
Его можно также приложить к процессам полимеризации и диссоциации. Людмила Фирмаль
В этой реакции количество молей до и после реакции равно Я тебя так люблю.: 2HJ±?H2 + J2.Эта реакция может идти вперед и назад. Направление. При каких условиях следует определиться Равновесие этих 3 газовых смесей. Обычно мы рассматриваем стехиометрические коэффициенты Реагенты; отрицательные и В результате реакции, положительная. В Случай vi = −2, v2 = 1, V3-I, следовательно В= Но так как все 3
Газа являются двумя атомами, то моль Теплоемкость cv равна друг другу. Поэтому, что касается b、 Мы получаем: 0. Закон массы данной реакции Похоже: г-Ж 2 У П ХL Уравнение (8.12) для всех реакций、 6 = 2Вт = 0, то есть числитель Баланс до и после изменения реакции В газовой смеси это не имеет ничего общего с внешним давлением, но、 Зависит только от температуры. Количество родинок и После изменения реакции.
После этого степень диссоциации равна Зависит от давления. Такие реакции включают в себя: О2 ″ ±2О; и J2?±2J; N2O4±2NO2; ПС15 <±PC13 + С12. Где VI = −1, П2 = 2.Так… Например, для J2 б И затем… ’0- Для специфической реакции химического состояния、 Равновесная концентрация реакционного газа зависит от внешней среды Внешнее давление и температура. Если вы увеличите давление Давления, то концентрация х%уменьшается, а Xi увеличивается
Увеличение: реакция идет в противоположном направлении. Поэтому, изменяя давление, можно влиять на ход Реакция. Вот еще один пример Применение закона масс. 13 * 195 Процесс очень важен в технологии Синтез аммиака из водорода и азота в воздухе.
В соответствии с Уравнение реакции N2 + 3H2 — > 2NH3 в,=-1; П2 =-3; В3 = = 2; с =-1-3 + 2 =-2 это-ВУ2-3С о р Закон массы в рассматриваемом деле Форма дела выглядит следующим образом: ХL вопрос-gN2 ″ стереомикрофон gh2 по отзывам + 2gNH、 3_ar » ш т 3 Р2 В этой реакции концентрация NH3 увеличивается С увеличением давления: чем выше давление、 Низкая концентрация N2 и H2.
Смотрите также:
Решение задач по термодинамике

