Оглавление:







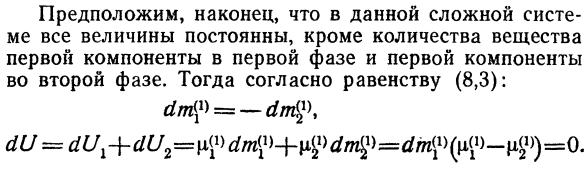




Учение о термодинамическом равновесии в сложных системах.
- Я уже говорил об этом в предыдущей главе. В принципе, данное Количество вещества. Мы приступим к установлению условий Равновесие сложных систем. Эти системы являются、 Однородная и гетерогенная термодинамика. Однородные системы называются однородными системами. Система, в которой каждой точке равновесного состояния соответствует Соответствует одинаковым значениям давления Р, температуры
Температуры Т и концентрации с Все индивидуальные однородные вещества (вода、 Спирт, кристаллы соли и др.)- смесь различных газов、 Гетерогенные системы называются сложными системами. Система, состоящая из нескольких однородных или однородных систем Система.
Последний смешивается в любой пропорции, а жидкость и Твердый раствор при полном взаимном перемешивании Их составная часть. Людмила Фирмаль
Такие, например, системы ледяной воды, растворы Частично растворимые вещества(например, водно-бутиловые)- Бутиловый спирт), система водяного пара льда, ЕТК. Гетерогенные системы также включают суспензию. И эмульсия. Суспензия жидкая、 Это твердая взвешенная частица. Мехпримеси. Такая система может быть получена, если: Смешайте нерастворенный мелкий порошок в воде Нерастворимые вещества, такие как глина. Эмульсия называется жидкостью、
Другие мельчайшие капли Другая жидкость. Например, молоко Эмульсия из мелких капелек жира, взвешенных в воде. Обратите внимание, что многие системы выглядят так на первый взгляд На первый взгляд она выглядит однородной, но по своей природе это не так. Это коллоидные растворы, или золи, которые занимают Среднее положение истинного решения (Однородная система) и смесь. Одна частица в них
- Материалы, которые распределяются в различных материалах Поскольку он очень мал, его можно обнаружить только с помощью ultra-microscope. To коллоидная система Например, человеческая кровь-поступающая В его составе диаметр эритроцитов составляет 7,5 мкм. Рассчитывать Коллоидные растворы играют важную роль в химической и биологической инженерии. Поэтому, биология, медицина, сельское хозяйство, технологии
Поэтому их изучение очень важно. Однородная часть гетерогенных систем. Он имеет интерфейс и может быть механическим Он отделен от общей системы a phase. So …Компонент-это физически независимая часть Физические системы, которые можно различать без помех Условия существования системы. Например、 Или 5 газов состоят из 5 components. In решение проблемы
Например, неравномерная система ледяной воды-водяной пар Есть 3 фазы встроены. Людмила Фирмаль
Вода — 2 компонента этилового спирта. Пароводяная смесь Вода, водород, кислород в нормальных условиях Есть 3 компонента: H2O, H2 и O2. Если эта система нагрета до 400°C、 В его компонентах происходит химическая реакция: 2Х2Х^ при h = ^ 2H2 4-O число компонентов уменьшается до 2. В общем, в химических случаях Реакция, компонентов будет столько, сколько было Перед реакцией, минус количество реакций.
Например, сжигание извести сопровождается химическими веществами Химическая деградация оксида кальция и углекислого газа ГАС.: CaCO3- Такими системами являются、 Любые 2 компонента, но не 3 из них.Общие условия термодинамики Равновесие гетерогенной системы Чтобы найти равные условия Равновесие сложных термодинамических систем, мы используем В случае равновесия вся термодинамика Функция проходит при определенных условиях
Экстремальные значения (минимальные или максимальные)… (8.1) В Знать функциональную зависимость термодинамики Термодинамическую функцию параметров системы можно найти Общее равновесное состояние гетерогенных систем. Вывести состояние равновесия в наиболее распространенных случаях При использовании внутренней энергии U Замкнутые разнородные системы он состоит из фазы r и компонента n.
Внутренние перемены Энергия каждой фазы системы всех компонентов Компонент может быть описан следующим образом: Дукс = ТХ dsх-ПЛ DVX по dU2 = T2 dS2-p2 dV2 (8.2) — ф п> ДМФА + … + * х («) ДМ [Н \ Где индекс соответствует спецификации фазы. Верхний-обозначение компонента. Добавление равенства (8.2) дает общее изменение Равна внутренней энергии системы dUt при равных условиях новезия-ноль. Поскольку речь идет о системе Закрыто, есть дополнительные условия
Условия, описывающие инвариантность энтропии, объема и массы Вся система: 25 = Ср 2В = С2; СМР = С3. (8.3) В рассматриваемой системе Все величины остаются постоянными, за исключением первой энтропии Второй этап. Затем следуйте требованиям (8.3) ДСЛ = — DS2 у. (8.4) Энергетические изменения в системе: дю = Дукс + dU2 = ТХ ДС {+Т2 DS2 у = 0(8.5) Или в соответствии с равенством(8.4): Сто восемьдесят два И так далее И затем…
Как? летнее время = Т2. Предполагая, что система будет только меняться Энтропия 2-й и 3-й фаз, а также сумма остальных Остаются неизменными, и в результате аналогичного Вывод, получаем условие T ^ Tz, тогда Γ3=Γ4 л и др. Так… При равновесии в неоднородной системе температура Температура всех фаз будет равна: Т ^ Т2 = Т3 = … = Тг(8.6) Кроме того, только объем* Объем фазы 1 и фазы 2 V1 и K2.
Перейти к следующему Энергия Но по условию(8.3) И затем… Но с тех пор И затем… А-> 2 = 0 или РХ = Р2. Равенство p2 = P3 доказывается аналогичным образом И так далее Наконец:/?4 -/?2 =/?С.*- == / В-(8.7) Так… Равновесное состояние неоднородной системы давления Он эквивалентен во всех фазах. Наконец, в этой сложной системе Система постоянна во всех значениях, за исключением количества вещества Первый компонент и первый компонент первой фазы На втором этапе.
Тогда, согласно равенству(8.3): = д^ Сто восемьдесят три Но с тех пор И затем… Предполагая только количество Количество вещества 2 — го и 3-го первого компонента Фаза, получи уравнение. / Джей?) =(10>и т. д. Подобный этому В случае равновесия в гетерогенной системе Получаем его первую составляющую, уравнение Компоненты химического потенциала для всех фаз
Система Аналогично для всех остальных компонентов、 Справедливость следующего уравнения: (8.8) Отношения(8.6)-(8.8) Эффект равновесия в любой неоднородной системе T = * const и p = число фаз и компонентов в const. Давайте напишем их вместе: Р, Р2 = … = тангенс Р \ — Пи = … — р. (8.9) Равенство температуры Т означает равенство движения- Кинетическая энергия в фазах сложных систем.
Изобарная р для гетерогенных систем Указывает на наличие механического равновесия. Равенство химических потенциалов、 Условия равновесия, удельная энергия каждого компонента Компоненты всех фаз эквивалентны. 184. В качестве примера запишем следующие условия равновесия: Трехфазный
однокомпонентный лед-вода-па- Водяной пар: г = 3; л = 1 Аналогично, 2-фазные компоненты 2(r = 2 i = 2) система, например ненасыщенный раствор NaCl Вода с учетом пара и равновесного состояния раствора Есть такой формат: Сорок два Проблема заключается в количестве фаз и компонентов на разных машинах Гетерогенные системы могут быть приравнены одновременно Равновесие? Ответ на этот вопрос был впервые дан Гиббсом.
Смотрите также:
Решение задач по термодинамике
| Тепловая функция. Эффект Джоуля Томсона. | Правило фаз Гиббса. |
| Сопло Лаваля. | Общие условия равновесия в гомогенной системе. |

