Оглавление:








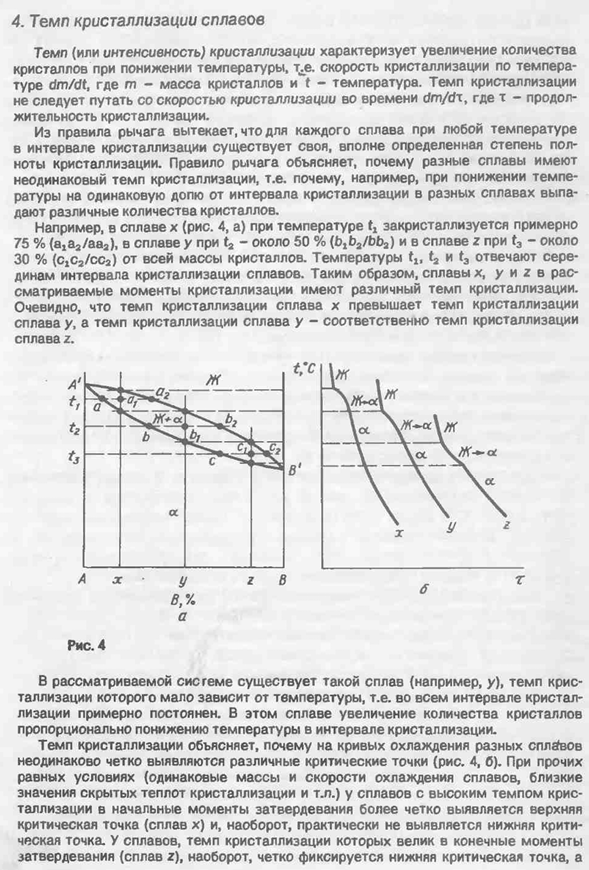


Диаграмма состояния системы с непрерывными рядами жидких и твердых растворов
- Фазовая диаграмма системы непрерывных серий жидкости и твердого раствора 1. Условия непрерывного образования твердого раствора. Только твердое вытесняющее решение может быть непрерывным (от А до В). При переходе от металла A к металлу B (или наоборот) один атом металла постепенно замещает другой атом металла в узле кристаллической решетки. В этом случае число атомов разных сортов в элементарной ячейке остается постоянным. Необходимой, но недостаточной предпосылкой для образования непрерывного твердого раствора является полная (т. е. непрерывная) растворимость металла в жидком состоянии.
Однородность кристаллической решетки металла, небольшая разница в атомных радиусах (менее 10-12%), похожая электронная структура атомов, т. е. близость химии металла. Металлы, которые образуют непрерывный ряд твердых растворов, обычно находятся в одной (редко смежной) подгруппе периодической таблицы элементов Д. И. Менделеева (например,
Си-Ау, Мо-W, Pd-Pt и т. Д.). Непрерывный твердый раствор может образовывать много однотипных (изоструктурных) модификаций. Людмила Фирмаль
Полиморфные металлы (o-L и ce-Zr, p-Zruž-Hf и т. Д. (А также отдельные модификации полиморфных металлов с неполиморфными металлами, такими как фи-Zrn Nbn)). Эти условия образования сплошных твердых растворов носят качественный характер и часто не выполняются. Посредством статистической обработки фазовой диаграммы двойной системы В. М. Воздвиженский смог предложить количественный критерий образования такого решения: L5 <1,10 и 4); PU = [(dA / dg f + UD / Vg-2 + bj-объемный (или размерный) коэффициент (dA и dg, VA и Vg — поправка на различия в атомном диаметре и объеме компонентов, b-валентность, соответственно).
Первый критерий характеризует степень однородности химических связей в компонентах и близость второго по физико-химическим свойствам. Оба критерия указывают на то, что условия образования непрерывного твердого раствора являются факторами однородности химических связей в компонентах и предпочтительных температуры и размера. 2. Диаграмма показывает фазовую диаграмму системы a-B с непрерывной последовательностью жидкости и твердого раствора, составленной из координат температуры композиции. 2, A. Горизонтальная ось используется для подсчета концентрации компонентов не только в сплавах, но и в различных фазах, в которых эти сплавы могут быть составлены.
- Длина сегмента AB эквивалентна общему содержанию содержимого компонента (100% или 100%). В первом случае концентрация компонента измеряется в долях единицы (обычно атомы, редко — вес) и в секундах — процент (атомы или вес). См. Миграция из другого устройства. В приложении. Два риса 19 ¢ 135b кривая, называемая «кривая жидкого» (от широты. Ликвидус-жидкость) или начало кристаллизации жидкого раствора. При температуре на этой кривой все сплавы находятся в однофазном жидком состоянии. Нижняя кривая A’246B ’называется сплошной кривой (от широты). solidus-solid) или «кристаллизация твердого тела» — растворы.
При температурах ниже этой кривой все сплавы также являются однофазными, но находятся в твердом состоянии. Кривые ликвидуса и солидуса показывают, что температура в начале и в конце кристаллизации (или плавления) сплава изменяется в зависимости от их состава и интервала кристаллизации (или плавления). Интервал кристаллизации (или плавления) понимается как температурный интервал между ликвидусом и солидусом.
На этом интервале сплав переходит из жидкого в твердое состояние (или наоборот) и в этом процессе переходит в жидкость и «кристаллы». Людмила Фирмаль
Как. «+ В интервале кристаллизации (или плавления) кривые ликвидуса и солидуса насыщаются друг относительно друга, поэтому кривые ликвидуса и солидуса просто насыщают состав жидких и твердых α-растворов относительно друг друга. В фазовой области растворы W и «жидкость и твердое тело» являются ненасыщенными, поэтому кривые жидкой фазы и твердой фазы могут различать различные фазовые области на фазовой диаграмме. Из диаграммы состояния (рис. 2, а) видно, что кривые ликвидуса и солидуса сходятся в вертикальном положении компонентов в точках A ’и B’, соответствующих их температуре плавления (или кристаллизации). Следовательно, интервалы кристаллизации компонента A и компонента B равны нулю (b = 0, K = 1 и f = 2).
Раствор сплава имеет разные интервалы кристаллизации (6 = K 1 = 2 и f = 2). Обычно это больше всего подходит для сплавов, расположенных в середине системы А-В. Из термодинамической теории решения свойства (кривизна) кривых ликвидуса и солидуса определяются термодинамическими свойствами комлонентов и характером их межатомного взаимодействия в растворе. Несколько моделей (идеалы, правила, другие решения) были предложены для описания металлических решений. Как правило, растворы металлов отличаются от идеальных растворов по своим свойствам: жидкие растворы в меньшей степени, а твердые растворы в большей степени, особенно при более низких температурах.
Из уравнений, описывающих кривые ликвидуса и солидуса различных типов растворов, эти кривые являются более выпуклыми к области жидких (кривые ликвидуса) и твердых (кривые солидуса) растворов. В некоторых системах кривые ликвидуса и солидуса имеют сходные характеристики, и OBV зависает в одном или другом направлении одновременно (не сформировано). 20 (максимум или минимум), т. Е. Выпуклая к поверхности лица / жидкость / твердый раствор. В случае низколегированного (разбавленного) раствора металла кривые ликвидуса и солидуса приближаются к прямой линии или просто являются прямыми при низких концентрациях второго компонента. 3. Например, см. Рис. 2, а).
При температурах выше G этот сплав представляет собой ненасыщенный жидкий раствор для кристаллов и характеризуется случайным распределением составляющих атомов и начальным приближением миграции. Когда температура падает до h, энергия этой кинетики постепенно уменьшается, и вблизи температуры h в жидкости создается условие, благоприятствующее возникновению первого центра кристаллизации. При температуре Fi жидкость насыщается относительно a-кристалла. Небольшое снижение температуры ниже Fi приводит к тому, что первый кристалл становится заметным из жидкой композиции в точке 1, расположенной на кривой ликвидуса.
Очевидно, состав этих кристаллов должен быть таким, чтобы они образовывались. Из фазовой диаграммы видно, что только a-кристалл, имеющий состав точки 2, расположенный на сплошной кривой, начинает плавиться в h. Следовательно, начальная стадия кристаллизации сплава Ni при температуре fi формируется в жидкости точки 2 состава первого а-кристалла состава точки 1, которая является M i- * a2 Поскольку это требует переохлаждения расплава под кривой ликвидуса, в принципе кристаллизация не может начаться при температуре fi, что подчеркивает известные условия этой записи Точнее, когда температура ниже fi at, сначала кристалл высвобождается из жидкости, и состав на ASG отличается от точки 1.
Точно так же состав первого кристалла определяется точкой, отличной от точки 2 на DSA, где C — концентрация жидкости и одного из компонентов в кристалле. At- * 0 — это разница между Asj-0 и Asa- * 0, то есть запись Mi- * A2. Поэтому предлагаемая запись является чисто методическим способом описания фазового превращения. Используя такую запись, необходимо помнить, что для начала кристаллизации и ее течения жидкая фаза ниже кривой жидкой фазы всегда должна быть переохлаждена. Также применяется (см. Главу 3 и т. Д.). ). По своему химическому составу кристаллы А2 отличаются от исходной жидкости J1, — 21 Температура солидуса сплава. Вокруг кристалла A жидкий слой образуется и истощается этим компонентом (или обогащается вторым компонентом B).
Таким образом, начало кристаллизации предшествует разделительной диффузии в жидкой фазе, то есть перераспределению составляющих атомов во фронте кристаллизации, и это различие в составе жидкости и кристаллов Состав кристалла отличается от состава исходного сплава. По мере снижения температуры в области кристаллизации состав а-кристалла, наоборот, становится составом всех более близких исходных сплавов, Состав жидкости, которая затем падает с понижением температуры от G до t3 и изменяется вдоль кривой «-кристалл ликвидус и солидус»: от точки 1 до точки 3 изменение состава этой жидкости и кристалла (компонента Совместное концентрирование с В) возможно только путем изменения их количества, уменьшения доли жидкости,
При некоторой промежуточной температуре t2 жидкая композиция в точке 3 находится в равновесии с кристаллами композиции в точке 4, то есть при охлаждении от T3 до комнатной температуры при фазовом переходе сплава Hz, соответствующем температуре J3 и * конца кристаллизации. (Происходит простое физическое охлаждение a-кристалла) не происходит. Начало кристаллизации наших сплавов приводит к выравниванию диффузии в интервале кристаллизации на обеих стадиях, если предшествует различная диффузия в жидкости.
Эта диффузия в жидкой фазе выравнивает состав исходной жидкости и ее слоя, примыкающего к a-кристаллу, так что жидкий состав в любой момент кристаллизации удовлетворяет кривой жидкой фазы и затвердевает. Процесс кристаллизации сплава р х можно записать как W1-3 5 -a, 2_-4l_-6A или опустить промежуточную стадию, как W J↔t t t2-6 22 где h и t3 — температура в начале и конце кристаллизации, а также индексы 1,2 и 5,6 соответственно, начальная и конечная точки изменения жидкого и кристаллического состава. В каком направлении стрелка между OK1-5I и 2-Buk a z s переходит? Рассматривая процесс кристаллизации сплавов GI, следует отметить, что кривые жидкокристаллического равновесия (кривые ликвидуса и солидуса) мы называем начальной и конечной кривыми кристаллизации.
В принципе это различие отличается Противоречит сущности фазовых диаграмм, изображающих фазовые равновесия (не превращения) в сплавах, которые отличаются по температуре. Читатель должен ясно представить, что в условиях равновесия кристаллизация сплава Di не начинается при температуре h и не заканчивается при t3 (см. Рисунок). 2, а). Чтобы процесс кристаллизации продолжался, рассматриваемая система (сплав l x) всегда должна быть исключена из равновесия, то есть жидкая фаза должна быть переохлаждена под кривой жидкой фазы. Только в этих условиях процесс кристаллизации является реакцией между системой и дисбалансом.
При рассмотрении фазовых диаграмм бинарных систем других типов была принята аналогичная интерпретация линий фазового равновесия как линий начала и конца различных фазовых превращений. Не очень точно, но очень легко анализировать процессы, происходящие в сплавах с температурными изменениями, и их условную запись Вышеизложенное полностью рассматривается во второй части руководства и относится к диаграмме состояний тройной системы (Гл. 8-1 4).
Обратите внимание, что при возврате к сплаву p кривая охлаждения (координата температуры-времени) показывает две критические точки (перегибы), соответствующие начальной и конечной температурам кристаллизации (рис. 2, б). На кривых охлаждения компонента A и компонента B была определена одна критическая точка в виде горизонтальной платформы (упора) при температуре их плавления (кристаллизации). Разница между кривыми охлаждения сплава и компонентов A и B легко объясняется фазовым законом. Согласно этому правилу, равновесие WA (или B) при температуре плавления (или кристаллизации) компонента A (или B) является непостоянным (8 = Kf) + 1 = 1-2 + 1 = 0) П
оэтому такое равновесие возможно только при постоянной температуре. Поэтому на кривых охлаждения компонента А и компонента В их температура плавления (кристаллизации) достигается путем остановки. Подобное равновесие W-a сплава P1 является моновариантным (8 = K-f + 1 = 2-2 + 1 = 1) 23i реализуется с интервалами кристаллизации. Поэтому на кривой охлаждения сплава Gy нет остановки, но есть два изгиба. При анализе кривых охлаждения необходимо обратить внимание на разные наклоны этих разных участков. Верхняя часть кривой охлаждения сплава L1 (см. Рис. 2, б) Жидкая фаза имеет крутой наклон (высокая скорость охлаждения) по сравнению с нижней частью кривой для твердой фазы (низкая скорость охлаждения)
Скорость), остальные равны, поэтому чем меньше разница температур между этим сплавом и скоростью охлаждения, тем ниже скорость охлаждения и наклон кривой охлаждения в направлении оси времени. По этой причине наклон кривой охлаждения постепенно уменьшается, и кривая асимптотически приближается к оси времени. Средняя (выпуклая) часть кривой охлаждения, связанная с преобразованием Wa в интервале кристаллизации, обусловлена выделением скрытой теплоты кристаллизации. После медленного охлаждения (в условиях, которые делают диффузию в кристалле однородной), кристаллы более или менее уравновешенного твердого раствора выглядят как структура сплава под микроскопом (рис. 3).
И B не может отличить равновесную структуру раствора сплава от чистого металла. Из рассмотрения процесса кристаллизации сплава L1, чтобы определить состав его равновесной фазы при заданной температуре в интервале кристаллизации, жидкостными переходами через пропорциональные точки сплава являются жидкость и кристалл, соответственно. Состав показан. Например, при температуре t2 (см. Диаграмму 2, а) жидкость композиции в точке 3 находится в равновесии с a-кристаллом композиции в точке 4. Точки равновесного фазового состава горизонтальных сегментов типа 34, связанные при разных температурах, называются конодами. Можно сказать, что Conode соединяет два узла, а узел — это точка, представляющая одну композицию сбалансированной фазы. Используйте правило рычага (или сегмент) для определения доли жидкости и кристаллов при любой температуре интервала кристаллизации. Вывод этого правила основан на уравнении SOS-
Мы опускаем сплав 24tava, то есть состав одного материального баланса ингредиентов через его фазовый состав. Если Conode34 является рычагом, то доля кристаллов A4 при температуре t2 в сплаве Ni является сегментом P3 / 34, то есть дуга рычага, смежная с кривой ликвидуса для всего рычага. Это запись о состоянии механического равновесия рычага. Соотношение соотношения жидкости W3 и кристалла из сплава L1 при температуре a4-t2 определяется отношением сегмента PZ / P4, что означает, что соотношение жидкости выше, чем соотношение кристаллов Умножение соотношения сегментов P3 / 34 и P4 / 34 на 100% дает относительное количество, выраженное в процентах от массы сплава, а не пропорции равновесной фазы.
При нахождении пропорции фазы равновесия Плой, масса сплава мы считаем равной единице, а при нахождении относительного количества −1 0 0%. Правило рычага применяется не только к кристаллизуемым сплавам, но в целом к любому двухфазному сплаву (независимо от их химического состава, а также фазового состава и свойств равновесной фазы). Необходимо применять это правило. Условием является знание состава равновесной фазы (при условии, что состав сплава известен). Оценивая долю равновесной фазы сплава t в начале и в конце кристалла (рис. 2, а), при температуре G доля ас-кристалла все еще равна нулю (необходимо принять отношение точки 1 к сегменту 12)
Адоль исходной жидкости J1-one (сегмент, наоборот, при температуре t3, доля жидкости J5 равна нулю, а доля кристаллов A6 равна единице. Поэтому процесс кристаллизации сплава L1 сопровождается аналогичным изменением состава жидкости и a-кристалла, в нашем случае — концентрации более легкоплавкого компонента B (состав этой жидкости и кристалла). Как мы уже видели, он изменяется в соответствии с правилом рычага в зависимости от кривых ликвидуса и солидуса и количества этих фаз. 4. Скорость кристаллизации сплава Скорость (или сила) кристаллизации характеризуется увеличением количества кристаллов при понижении температуры.
Здесь m — масса кристалла, а t — температура. Скорость кристаллизации не следует путать со скоростью кристаллизации времени дм / дх. Из правила рычага, будет иметь свою собственную четко определенную степень целостности кристаллизации для каждого сплава при любой температуре интервала кристаллизации. Правила рычага отличаются, когда разные сплавы имеют разные скорости кристаллизации, например, когда температура падает из-за одинаковой пропорции интервалов кристаллизации разных сплавов. Например, х (рис. 4, а) кристаллизуется при температуре около 75% (a / a / ABZ) и общее количество z-кристаллов сплава y- и t3 сплава от t2 до около 50% (B ^ / S b).
Кристаллизуют примерно при 30% масс. (CjCj / cca). Температуры tx, t2 и t3 соответствуют средней точке интервала кристаллизации сплава. Таким образом, сплавы x, y и z в рассматриваемый момент кристаллизации имеют разные скорости кристаллизации. Понятно, что скорость кристаллизации сплава х превышает скорость кристаллизации сплава у, а скорость кристаллизации сплава у превышает скорость кристаллизации сплава z. Рис для Возможные системы включают такие сплавы (например, y), скорость кристаллизации которых практически не зависит от температуры. В этом сплаве увеличение количества кристаллов пропорционально уменьшению температуры интервала кристаллизации. Скорость кристаллизации объясняет, почему кривые охлаждения разных сплавов не позволяют четко различать разные критические точки одинаково (рис. 4, б).
Другие равны (та же масса сплава и скорость охлаждения, значение близости для потенциальной кристаллизации и т. Д.). В сплаве, имеющем высокую скорость кристаллизации в начальный момент затвердевания, верхняя критическая точка (сплав х) обнаруживается более четко, и, наоборот, нижняя критическая точка по существу не обнаруживается. В сплавах, где скорость кристаллизации высока в последний момент затвердевания (сплав z), наоборот, нижняя критическая точка четко зафиксирована, 26верная — раскрыта так четко. Наконец, в сплаве с почти постоянной скоростью кристаллизации (сплав y) обе критические точки были идентифицированы практически одинаково.
Смотрите также:
Методические указания по материаловедению
| Диаграммы состояния систем с точками экстремума на кривых ликвидуса и солидуса | Ситаллы |
| Диаграмма состояния системы с бинодальной кривой | Классификация двойных систем |

