Оглавление:
Электролиз растворов и расплавов электролитов. Законы электролиза
Пример 100
Записать уравнения процессов, происходящих при электролизе расплава 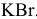
Решение:
В расплавленной массе происходит термическая ионная диссоциация этого вещества:
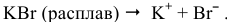
Процессы, происходящие на электродах, следующие:

Пример 101
Описать процессы, происходящие при электролизе расплава 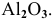
Решение:
Его термическая ионная диссоциация:
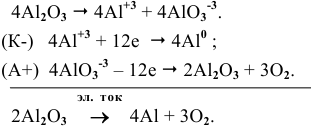
Пример 102
Как протекает электролиз раствора 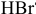 ?
?
Решение:
При электролизе растворов следует учитывать диссоциацию воды. Электролитическая диссоциация 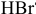 :
:
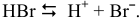
Электролитическая диссоциация воды:
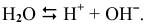
Положительно заряженные частицы (катионы) направляются к катоду, а отрицательно заряженные частицы (анионы) — к аноду:
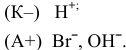
На катоде происходит восстановление катионов 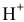 , а на аноде — окисление той частицы, восстановительные свойства которой наиболее сильные, т.е. частицы, обладающей самым низким потенциалом разложения. Такой частицей является
, а на аноде — окисление той частицы, восстановительные свойства которой наиболее сильные, т.е. частицы, обладающей самым низким потенциалом разложения. Такой частицей является 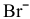 , так как
, так как
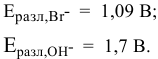
Таким образом, окисляются ионы 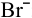 :
:
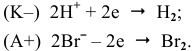
Суммарный процесс — 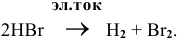
Пример 103
Написать уравнения процессов, происходящих при электролизе раствора 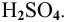
Решение:
Частицы в растворе следующие:
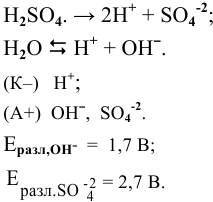
Окисляться на аноде должны анионы 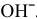 , но так как их концентрация в сильнокислой среде очень низкая, то реально окисляются молекулы воды:
, но так как их концентрация в сильнокислой среде очень низкая, то реально окисляются молекулы воды:
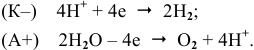
Суммарный процесс — 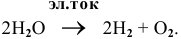
Пример 104
Написать уравнения процессов, происходящих при электролизе раствора 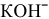 .
.
Решение:
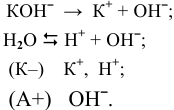
На катоде происходит восстановление той частицы, окислительные свойства которой наиболее сильные, т.е. частицы, обладающей самым высоким потенциалом разложения.
Обычно потенциал разложения на катоде определяют в каждом конкретном случае, учитывая концентрацию частиц и перенапряжение, которое зависит от многих факторов и, в частности, от материала электрода.
Перенапряжение выделения металлов мало 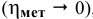 , за исключением
, за исключением 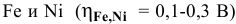 . Предполагая концентрацию ионов
. Предполагая концентрацию ионов 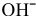 равной
равной 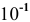 моль/л, находим, что в исследуемом случае в водном растворе щелочи концентрация ионов
моль/л, находим, что в исследуемом случае в водном растворе щелочи концентрация ионов 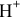
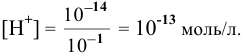
Определяем электродный потенциал гальванической пары 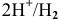 :
:
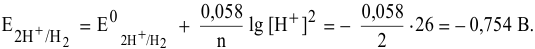
Даже с учетом самого большого перенапряжения выделения водорода на свинце 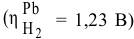 при использовании свинцового катода потенциал разложения водорода будет следующим:
при использовании свинцового катода потенциал разложения водорода будет следующим:
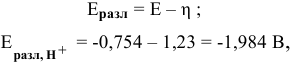
где Е — электродный потенциал.
Стандартный электродный потенциал калия 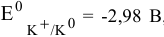 , его потенциал разложения будет близок к стандартному потенциалу из-за ничтожной величины перенапряжения.
, его потенциал разложения будет близок к стандартному потенциалу из-за ничтожной величины перенапряжения.
Таким образом, на катоде будет восстанавливаться ион водорода.
В общем случае при электролизе с учетом перенапряжения выделения водорода водород может находиться в ряду напряжений металлов между 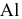 и
и 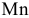 , поэтому из водных растворов не могут быть восстановлены металлы, стоящие в начале ряда напряжений металлов (щелочные и щелочно-земельные металлы до
, поэтому из водных растворов не могут быть восстановлены металлы, стоящие в начале ряда напряжений металлов (щелочные и щелочно-земельные металлы до 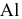 включительно).
включительно).
Из-за низкой концентрации ионов водорода восстановлению подвергаются в реальности молекулы воды:
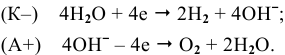
Суммарный процесс — 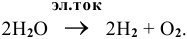 .
.
Пример 105
Написать уравнения процессов, происходящих при электролизе водного раствора 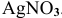 .
.
Решение:
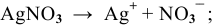
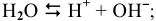
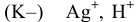 — восстановлению подвергается ион серебра, так как его потенциал разложения выше, чем у водорода:
— восстановлению подвергается ион серебра, так как его потенциал разложения выше, чем у водорода:
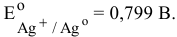
Для нейтральной среды 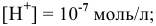
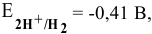
если учесть перенапряжение, то потенциал разложения будет еще ниже.
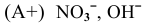 — должны подвергаться электролизу анионы
— должны подвергаться электролизу анионы 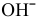 , так как
, так как
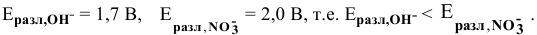
В действительности окисляются молекулы 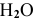 из-за низкой концентрации анионов
из-за низкой концентрации анионов 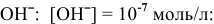
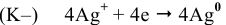 — восстановление;
— восстановление;
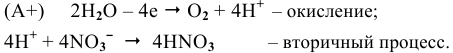
Суммарный процесс — 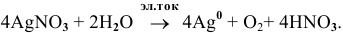
Пример 106
Написать уравнения процессов, происходящих при электролизе водного раствора 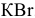 .
.
Решение:
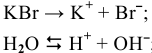
(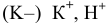 — восстанавливается
— восстанавливается 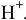 , так как
, так как 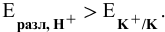
В реальности восстанавливаются молекулы 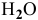 из-за низкой концентрации ионов
из-за низкой концентрации ионов 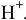 в воде.
в воде.
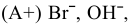 так как
так как 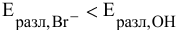 , то окисляются анионы
, то окисляются анионы 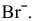
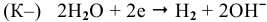 — восстановление;
— восстановление;
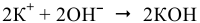 — вторичный процесс;
— вторичный процесс;
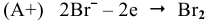 -окисление.
-окисление.
Суммарный процесс — 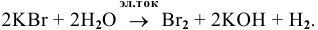 .
.
Пример 107
Написать уравнения процессов, происходящих при электролизе водного раствора 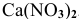 .
.
Решение:
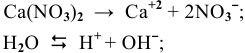
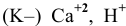 так как
так как 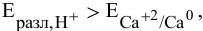 то должны восстанавливаться ионы
то должны восстанавливаться ионы 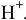 , но в воде из-за их низкой концентрации электролизу подвергаются молекулы воды.
, но в воде из-за их низкой концентрации электролизу подвергаются молекулы воды.
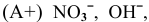
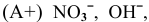 , так как
, так как 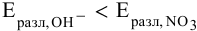 , поэтому разлагаются ионы
, поэтому разлагаются ионы 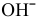 , а точнее, молекулы
, а точнее, молекулы 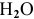 по причине, изложенной ранее.
по причине, изложенной ранее.
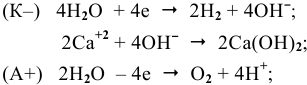
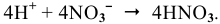
Суммарный процесс —
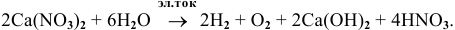
Пример 108
Написать уравнения процессов, происходящих при электролизе водного раствора 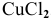 .
.
Решение:
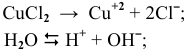
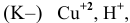 электролизу, безусловно, подвергаются катионы
электролизу, безусловно, подвергаются катионы 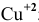 ;
;
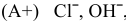 , электролизу подвергаются анионы
, электролизу подвергаются анионы 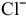 ;
;
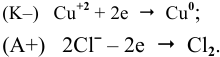
Суммарный процесс — 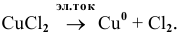
Пример 109
Записать уравнения электродных процессов, протекающих при электролизе водного раствора 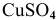 с медным анодом.
с медным анодом.
Решение:
В водном растворе 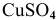 имеем:
имеем:
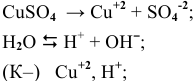
(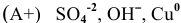 (частицы материала анода).
(частицы материала анода).
На катоде происходит восстановление меди:
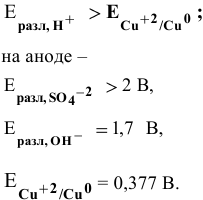
У меди самый низкий электродный потенциал, таким образом, окисляется медь:
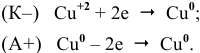
Изученный процесс электролиза является промышленным методом рафинирования меди.
Пример 110
Рассчитать теоретическое напряжение разложения 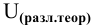 0,01 М раствора
0,01 М раствора 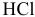 .
.
Решение:
Теоретическое напряжение разложения — это ЭДС гальванического элемента, образующегося в ходе электролиза, с направлением тока, противоположным току от внешнего источника. Электродные процессы при электролизе 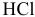 следующие:
следующие:
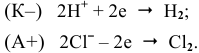
Таким образом, имеет место образование гальванического элемента:
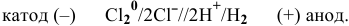
Рассчитаем редокс-потенциалы каждой гальванической пары:
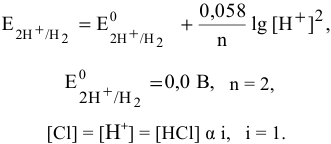
Для упрощения принимаем 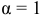 .
.

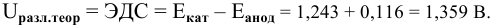
Пример 111
Рассчитать действительное напряжение разложения 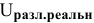 воды на гладких платиновых электродах (предполагаем плотность тока при электролизе равной
воды на гладких платиновых электродах (предполагаем плотность тока при электролизе равной 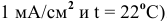 .
.
Решение:
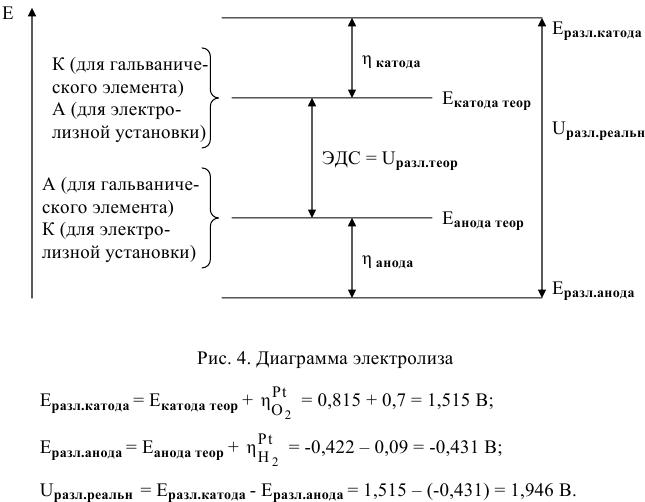
Считаем, прежде всего, теоретические потенциалы разложения на катоде и на аноде, а это и есть электродные потенциалы на катоде и на аноде гальванического элемента, образующегося в результате электролиза воды.
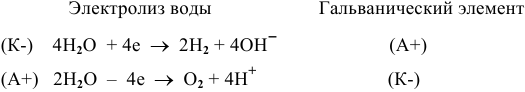
Для обеих электродных реакций определяем стандартные редокс-потенциалы по таблицам:
анод гальванического элемента — 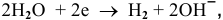
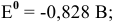
катод гальванического элемента — 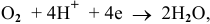
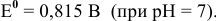
Для катода найденное в таблице значение стандартного редокс-потенциала при pH = 7 является значением теоретического потенциала разложения на катоде:
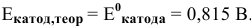
Определяем теоретический потенциал разложения на аноде по формуле Нернста:
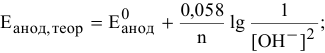
в воде 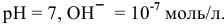
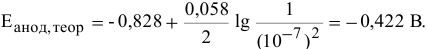
Определяем потенциалы разложения на катоде и на аноде с учетом того, что
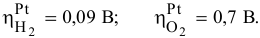
А затем определим действительное напряжение разложения воды.
Воспользуемся удобной для этих целей потенциальной диаграммой электролиза (рис.2).
Задача № 5. Провести расчеты по законам электролиза.
Пример 112
Через водный раствор хлорида меди (II) пропускают постоянный ток силой ЗА в течение 6 ч. Определить массу меди, осажденную на катоде, и объем хлора, выделенного на аноде (н.у.), если выход по току равен 75 %.
Решение:
Электродные процессы электролиза 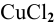 :
:
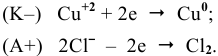
Согласно объединенной формуле законов Фарадея
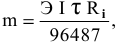
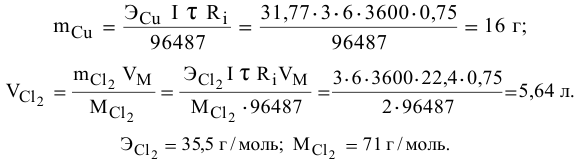
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

