Оглавление:
Электролитическая диссоциация
Задача 53
Указать электролиты среди следующих веществ: 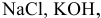
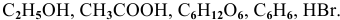
Решение:
К электролитам относятся основания, кислоты и соли. Среди вышеперечисленных веществ электролитами являются: КОН — основание, 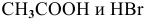 — кислоты и NaCl — соль.
— кислоты и NaCl — соль.
Задача 54
Среди следующих электролитов указать сильные и слабые электролиты: 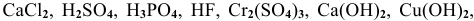
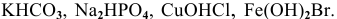 Написать уравнения электролитической диссоциации.
Написать уравнения электролитической диссоциации.
Решение:
При написании уравнений электролитической диссоциации пользуются следующими правилами:
1. Для сильных электролитов условно пишем одну стрелку 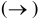 .
.
Например: 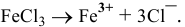 .
.
2. Для слабых и средних электролитов пишем две стрелки в обратных направлениях 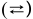 . Диссоциация этих электролитов протекает ступенчато.
. Диссоциация этих электролитов протекает ступенчато.
Например:
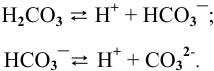
Диссоциация кислых и основных солей происходит следующим образом:
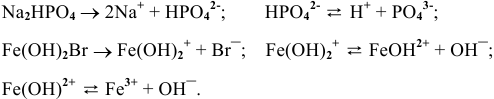
Задача 55
Написать математическое выражение констант диссоциации следующих веществ: 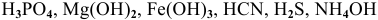
Решение:  .
.
Диссоциация 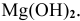 протекает ступенчато. Для каждой ступени запишем выражение константы диссоциации:
протекает ступенчато. Для каждой ступени запишем выражение константы диссоциации:
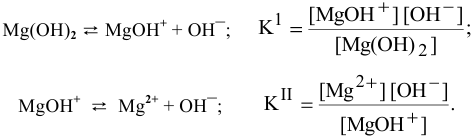
Для суммарного уравнения диссоциации слабого электролита 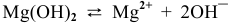 выражение константы диссоциации будет следующим:
выражение константы диссоциации будет следующим:
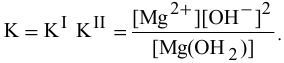
Задача 56
Какова концентрация ионов 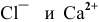 в 0,1 М растворе
в 0,1 М растворе 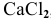 , если степень диссоциации
, если степень диссоциации 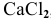 0,65 (65 %)?
0,65 (65 %)?
Решение:
Степень диссоциации определяется по формуле
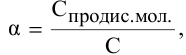
где С — молярная концентрация растворенных молекул,
отсюда
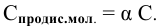
Концентрация ионов определяется по формуле
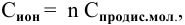
где n — число ионов, образующихся из 1 молекулы. Таким образом,
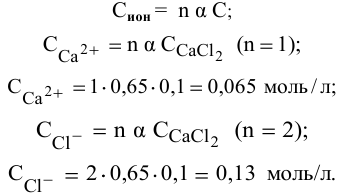
Задача 57
Рассчитать концентрацию раствора 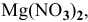 зная, что степень диссоциации равна 0,60, а концентрация ионов
зная, что степень диссоциации равна 0,60, а концентрация ионов 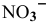 равна 0,16 моль/л.
равна 0,16 моль/л.
Решение:
Воспользуемся формулой
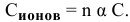
Отсюда 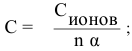
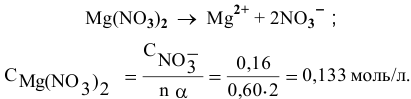
Раствор 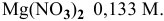
Задача 58
В каком из растворов концентрация ионов водорода выше: 0,001 М раствор 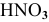 , 1 М раствор
, 1 М раствор 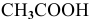 ?
?
Решение:
Для сильных электролитов расчет концентрации ионов производят по степени диссоциации. В справочнике по химии находим степень диссоциации 0,001 М раствора 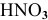 :
:
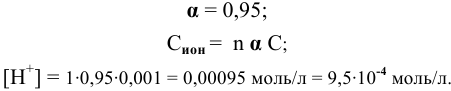
Для слабых электролитов расчет концентрации ионов производят по константе диссоциации.
В справочнике по химии находим константу диссоциации уксусной кислоты:
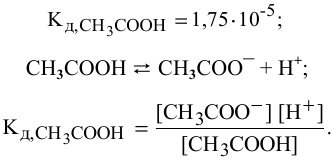
Так как 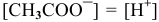 (молекула
(молекула 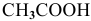 дает равное количество ионов), то
дает равное количество ионов), то
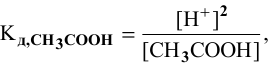
где [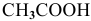 ] — равновесная концентрация непродиссоциированных молекул.
] — равновесная концентрация непродиссоциированных молекул.
Но так как константа диссоциации — очень малая величина, то концентрацией продиссоциированных молекул можно пренебречь и принять концентрацию непродиссоциированных молекул равной концентрации растворенного вещества, т.е. концентрации молекул, внесенных в раствор.
Из предыдущей формулы находим:
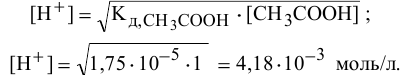
Таким образом, в данном растворе уксусной кислоты, несмотря на то, что она слабая, концентрация ионов 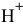 выше, чем в данном растворе
выше, чем в данном растворе 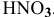 .
.
Задача 59
Рассчитать концентрацию ионов 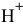 в 0,4 М растворе
в 0,4 М растворе 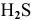 .
.
Решение:
Диссоциация 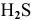 происходит в два этапа:
происходит в два этапа:
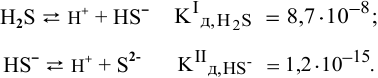
Концентрация ионов водорода, создаваемая по первой стадии диссоциации, во много раз выше концентрации ионов, создаваемой по второй стадии, так как по первой стадии диссоциация намного интенсивнее, чем по второй (см. величины констант диссоциации). По этой причине расчет концентрации ионов производят по константе диссоциации первой стадии:
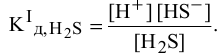
Если пренебречь тем фактом, что незначительная часть ионов  диссоциирует по второй стадии, в результате чего концентрация ионов
диссоциирует по второй стадии, в результате чего концентрация ионов  незначительно уменьшается, а концентрация ионов
незначительно уменьшается, а концентрация ионов 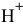 незначительно увеличивается, т.е.
незначительно увеличивается, т.е. 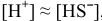 , то можно записать:
, то можно записать:
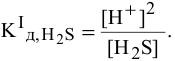
Отсюда
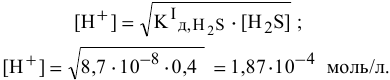
Задача 60
Рассчитать константу диссоциации HCN, зная степень ее диссоциации, равную 0,00007 в 0,1 М растворе.
Решение:
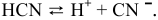
Согласно уравнению 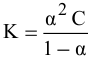 находим значение константы диссоциации:
находим значение константы диссоциации:
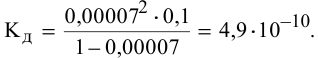
Задача 61
Во сколько раз уменьшится концентрация ионов водорода, если добавить 41 г ацетата натрия в 1 л 0,1 М раствора уксусной кислоты (увеличением объема раствора при добавлении ацетата натрия можно пренебречь) ?
Решение:
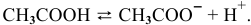
Выражение константы электролитической диссоциации уксусной кислоты —
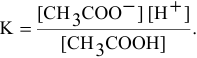
Находим в справочнике значение константы диссоциации уксусной кислоты:
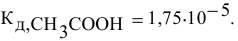
Прежде всего, вычисляем концентрацию ионов водорода в исходном растворе уксусной кислоты.
Так как 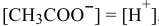 , имеем:
, имеем:
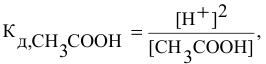
отсюда
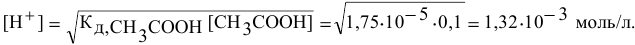
Когда растворяют ацетат натрия, концентрация ионов 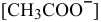 значительно увеличивается, так как ацетат натрия является сильным электролитом:
значительно увеличивается, так как ацетат натрия является сильным электролитом: 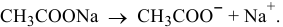
Молярная концентрация ацетата натрия, в предположении, что объем раствора остается равным 1 л, будет следующей:
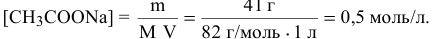
В справочнике находим степень электролитической диссоциации 0,5 М раствора ацетата натрия:
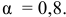
Определяем концентрацию ионов 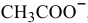 , полученных в результате
, полученных в результате
диссоциации ацетата натрия:
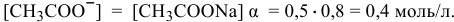
Концентрация ионов 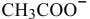 в исходном растворе уксусной кислоты
в исходном растворе уксусной кислоты 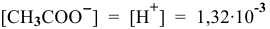 моль/л, намного меньше, чем концентрация ионов
моль/л, намного меньше, чем концентрация ионов 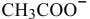 , полученных при диссоциации ацетата натрия, поэтому ею можно пренебречь. В выражение константы диссоциации уксусной кислоты подставляем величину концентрации ионов
, полученных при диссоциации ацетата натрия, поэтому ею можно пренебречь. В выражение константы диссоциации уксусной кислоты подставляем величину концентрации ионов 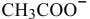 , равную 0,4 моль/л.
, равную 0,4 моль/л.
Находим концентрацию ионов водорода для вновь установившегося равновесия:
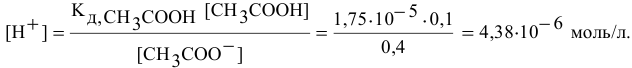
Таким образом, после добавления в раствор уксусной кислоты ацетата натрия концентрация ионов водорода становится равной 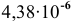 моль/л, а значит, она уменьшается в
моль/л, а значит, она уменьшается в
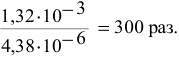
Задача 62
Написать молекулярные и ионные уравнения следующих ионообменных реакций:
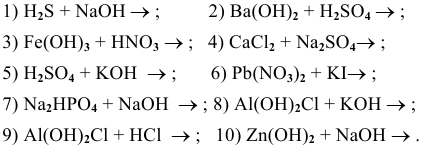
Решение:
Вначале записывается уравнение реакции в молекулярном виде.
Для написания уравнения ионообменной реакции в ионном виде малодиссоциируемые молекулы или ионы, а также молекулы нерастворимых в воде и газообразных веществ записывают как единое целое, тогда как молекулы сильных электролитов записывают в виде ионов, из которых они состоят. Записанное в таком виде уравнение ионообменной реакции представляет собой полное ионное уравнение.
Исключив из этого уравнения ионы, не участвующие в самом ионообменном процессе, получают краткое ионное уравнение ионообменной реакции.
Краткое ионное уравнение ионообменной реакции является выражением реального процесса, происходящего в растворе.

Задача 63
Рассчитать энтальпию растворения электролита 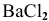 , если энтальпия кристаллической решетки
, если энтальпия кристаллической решетки 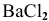 равна
равна 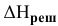 =468 ккал/моль, а энтальпии гидратации ионов равны:
=468 ккал/моль, а энтальпии гидратации ионов равны:
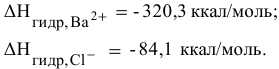
Решение:
Определяем энтальпию гидратации 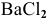 :
:

Определяем энтальпию растворения 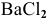 :
:

Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

