Соли. Краткие теоретические сведения
Соли — это продукты взаимодействия кислот с основаниями. Соль — это продукт замещения атомов водорода в кислороде на металл или продукт замещения гидроксильных групп в основании на кислотные остатки.
Общая формула соли — 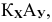
где К — катион; А — анион.
Классификация солей. Соли подразделяются на средние (нормальные) соли, которые являются продуктами полного замещения водорода кислоты на металл и полного замещения гидроксильных групп на кислотный остаток; кислые соли, которые являются продуктами неполного замещения водорода кислоты на металл, и основные, которые являются продуктами неполного замещения гидроксильных групп на кислотный остаток.
Номенклатура средних солей. Название средней соли дается следующим образом: для кислородсодержащего кислотного остатка называется кислотный остаток с окончанием «ат» для высшей валентности центрального атома с добавлением названия катиона и с окончанием «ит» — для низшей валентности центрального атома; для бескислородного кислотного остатка — окончание «ид». Если металл проявляет переменную валентность, то ее указывают римскими цифрами в скобках.
Например:

Рекомендую самостоятельно привести несколько примеров солей и дать им название.
Приведем несколько графических формул солей. Они подобны графическим формулам кислот, в которых атомы водорода замещены на атомы металла:
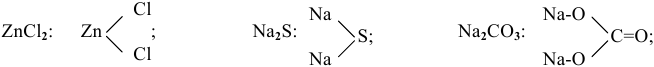
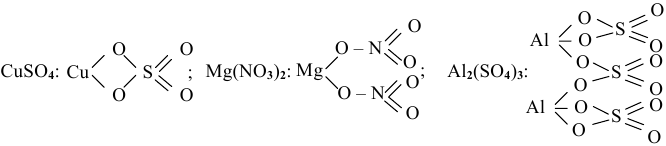
Когда атом металла в средней соли связан с двумя различными кислотными остатками, такие соли называют смешанными, например хлорная известь:
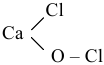
Если атомы водорода многоосновной кислоты замещены двумя различными металлами, то такую соль называют «двойной», например:
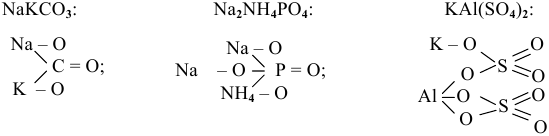
Кислые соли — это продукты неполного замещения атомов водорода в многоосновной кислоте на металл, например:
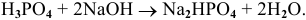
В название кислой соли добавляется перед кислотным остатком приставка гидро- или дигидро-.
Например:

Основные соли — это продукты неполного замещения гидроксильных групп в многокислотном основании, например:
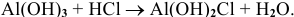
Название основной соли происходит от названия средней соли с добавлением приставки гидрокси-, дигидрокси, тригидрокси-, например:

Графические формулы нескольких основных солей:
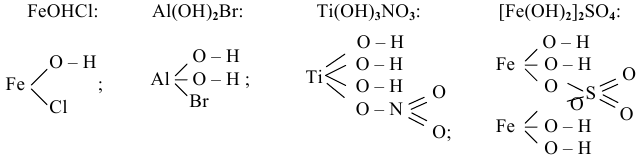
Основные соли могут терять воду, образующиеся соединения называются оксосолями, они также имеют основный характер, например:
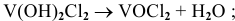
дихлорид ванадила
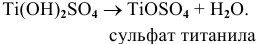
Рекомендую привести примеры кислых и основных солей, дать им название, привести графические формулы.
Получение солей. Соли получаются:
1) Взаимодействием металла с неметаллом:
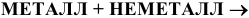
Например: 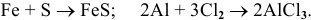
2) Взаимодействием кислоты с любым основанием:

3) Взаимодействием кислоты с основным или амфотерным оксидом:
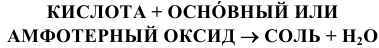
4) Взаимодействием основных или амфотерных оксидов с кислотными оксидами:
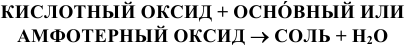
(См. подразадел 1.4).
5) Взаимодействием металла с кислотой:
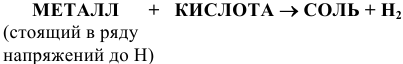
6) Взаимодействием металла с раствором соли:
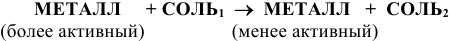
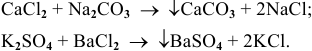
7) Взаимодействием двух солей:
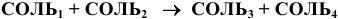
Эта реакция возможна лишь в случае образования малорастворимой соли, например:
8) Взаимодействием соли с кислотой:
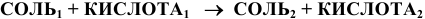
Эта реакция возможна лишь в случае образования нерастворимой соли или летучей, нерастворимой или слабодиссоциируемой кислоты, например:
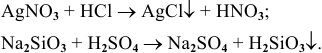
9) Взаимодействием соли со щелочью:
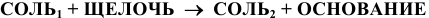
Эта реакция возможна лишь в случае образования нерастворимой соли или нерастворимого основания, например:
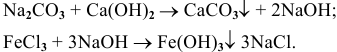
10) Взаимодействием кислотного или амфотерного оксида со щелочью:
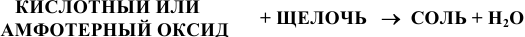
Например:
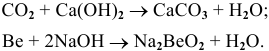
11) Взаимодействием основного оксида с амфотерным:
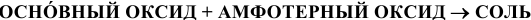
12) Взаимодействием амфотерного основания со щелочью
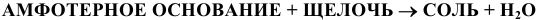
13) Кислые соли получают действием щелочи в недостатке на кислоту, или действием кислот в недостатке на нормальные соли
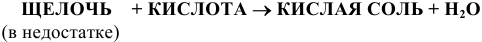
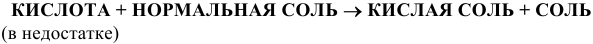
Например:
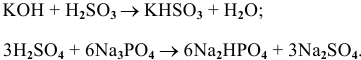
14) Основные соли получают действием кислоты в недостатке на основание или действием щелочи в недостатке на нормальную соль
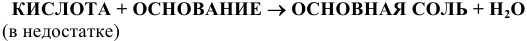
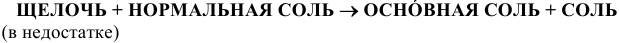
Например:
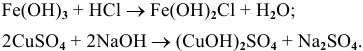
Рекомендую самостоятельно привести по нескольку примеров каждого способа получения солей и запомнить все общие схемы получения солей.
Химические свойства солей:
а) Взаимодействие солей со щелочами:
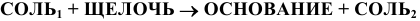
Кислые соли при взаимодействии со щелочами образуют нормальные соли:
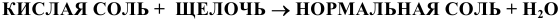
Например: 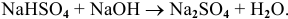
Основные соли при взаимодействии со щелочами образуют основания:
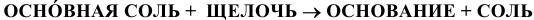
Например: 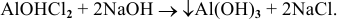
б) Взаимодействие солей с кислотами:
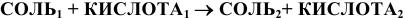
Основные соли реагируют с избытком кислоты с образованием нормальной соли
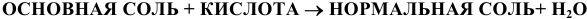
Например: 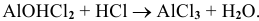
Кислая соль реагирует с избытком кислоты, образуя кислоту и соль:
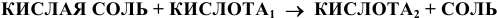
Например: 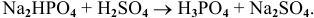
в) Взаимодействие соли с солью
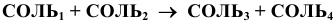
г) Взаимодействие соли с металлом
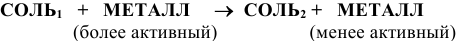
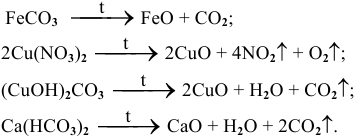
д) Термическое разложение солей
При нагревании карбонаты, нитраты и другие соли разлагаются, образуя, чаще всего, кислотный и основный оксиды (см. методы получения оксидов).
Например:
Эта теория взята со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Основания в химии. Краткие теоретические сведения |
| Кислоты в химии. Краткие теоретические сведения |
| Металлы в химии. Краткие теоретические сведения |
| Неметаллы в химии. Краткие теоретические сведения |

