Кислоты. Краткие теоретические сведения
Кислотами называются соединения, содержащие атомы водорода, способные давать катионы 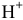 и замещаться атомами металлов или группами атомов (
и замещаться атомами металлов или группами атомов (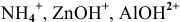 и т.д.).
и т.д.).
Общая формула кислоты — 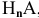 , где n — валентность кислотного остатка А.
, где n — валентность кислотного остатка А.
По числу атомов водорода (п) определяется основность кислоты (кислоты бывают одноосновными, двух-, трех- и четырехосновными).
Рекомендую привести примеры кислот разной основности.
В графических формулах атомы водорода, как и в основаниях, связаны с центральным атомом через кислород в кислородсодержащих кислотах, непосредственно с атомом — кислотным остатком в бескислородных кислотах, например:
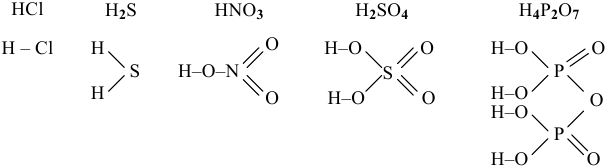
Рекомендую привести примеры бескислородных и кислородсодержащих кислот и их графические формулы.
Номенклатура кислот. Бескислородные кислоты называются следующим образом:
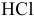 — хлороводородная кислота;
— хлороводородная кислота;
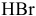 — бромоводородная кислота;
— бромоводородная кислота;
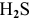 — сероводородная кислота;
— сероводородная кислота;
HCN — циановодородная кислота.
В название кислородсодержащих кислот входит название центрального атома с окончанием «ая», если центральный атом имеет высшую валентность. Если центральный атом имеет низшую валентность, то добавляется суффикс «ист», например:
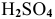 — серная кислота;
— серная кислота;
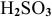 — сернистая кислота;
— сернистая кислота;
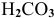 — угольная кислота;
— угольная кислота;
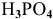 — фосфорная кислота;
— фосфорная кислота;
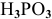 — фосфористая кислота;
— фосфористая кислота;
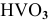 — ванадиевая кислота.
— ванадиевая кислота.
Рекомендуется дать название следующим кислотам: 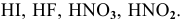
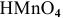 и запомнить правила номенклатуры кислот.
и запомнить правила номенклатуры кислот.
Способы получения кислот
1) Кислородсодержащие кислоты получают действием воды на соответствующие кислотные оксиды (ангидриды)
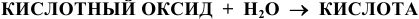
(См. свойства кислотных оксидов).
2) Кислота (кислородсодержащая или бескислородная) получается реакцией обмена между ее солью и другой кислотой, если в результате реакции образуется летучая или малорастворимая или малодиссоциируемая кислота:

Например:
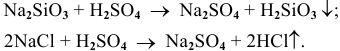
3) Бескислородные кислоты получают по реакции синтеза водорода с неметаллом:
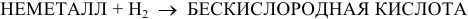
Например: 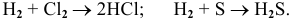
Рекомендую самостоятельно привести по нескольку примеров получения кислот разными способами и запомнить общие схемы.
Химические свойства кислот
а) Электролитическая диссоциация. Кислоты подвергаются электролитической диссоциации с образованием катиона 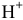 , что обусловливает окраску индикаторов: метилоранжа — в розовый цвет, лакмуса — в красный.
, что обусловливает окраску индикаторов: метилоранжа — в розовый цвет, лакмуса — в красный.

Например: 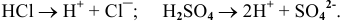
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
б) Взаимодействие с металлами
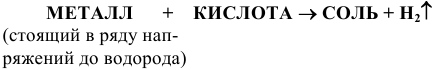
(См. подраздел 1.2).
в) Взаимодействие с основными и амфотерными оксидами:
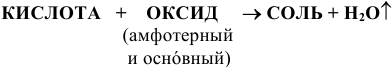
(См. подраздел 1.4).
г) Взаимодействие с основаниями:
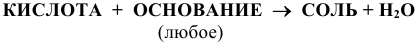
(См. подраздел 1.5).
д) Взаимодействие с солями:
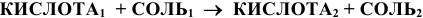
(См. подраздел 1.6). Такая обменная реакция в водных растворах возможна, если в результате ее образуются осадки, летучие вещества или малодиссоциируемые вещества.
е) Разложение кислот. Некоторые кислоты разлагаются при нагревании (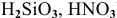 ), а некоторые — при комнатной температуре.
), а некоторые — при комнатной температуре.
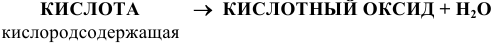
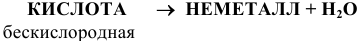
Например:
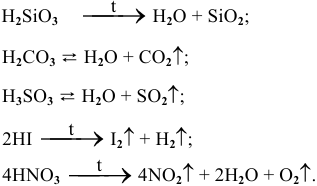
Рекомендую запомнить примеры разложения кислот.
Эта теория взята со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Оксиды в химии. Краткие теоретические сведения |
| Основания в химии. Краткие теоретические сведения |
| Соли в химии. Краткие теоретические сведения |
| Металлы в химии. Краткие теоретические сведения |

