Оксиды. Краткие теоретические сведения
Оксидами называются соединения, состоящие из двух элементов, один из которых кислород.
Общая формула оксида — 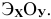
В оксидах атомы кислорода соединяются непосредственно с атомами другого элемента. Примеры графических формул:
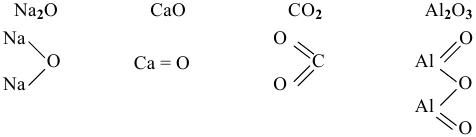
Рекомендую самостоятельно привести несколько примеров графических формул.
Номенклатура оксидов. Название оксида состоит из слова оксид плюс название элемента плюс в скобках римскими цифрами валентность элемента, например: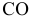 — оксид углерода (II),
— оксид углерода (II),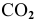 — оксид углерода (IV),
— оксид углерода (IV),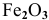 — оксид железа (III),
— оксид железа (III),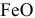 — оксид железа (II),
— оксид железа (II),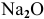 — оксид натрия.
— оксид натрия.
В последнем случае валентность элемента не ставится, т.к. Na проявляет только валентность I. Рекомендую самостоятельно привести несколько примеров.
Классификация оксидов. Оксиды подразделяются на основные, кислотные, амфотерные и безразличные (см. рис.1).
К основным оксидам относятся оксиды типичных металлов с низкой валентностью I и II.
Например: 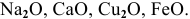
К кислотным оксидам относятся все оксиды неметаллов, а также оксиды металлов с высокой валентностью V, VI, VII и VIII.
Например: 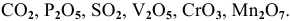
Кислотные оксиды называют еще ангидридами.
К амфотерным оксидам относятся оксиды металлов со слабо выраженными металлическими свойствами. В каждом периоде такой металл находится перед переходными элементами.
Например: 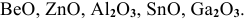
Все вышеперечисленные оксиды называются солеобразующими.
Существует также небольшая группа безразличных или индифферентных оксидов: 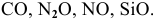
Рекомендую далее самостоятельно привести по нескольку примеров основных, кислотных и амфотерных оксидов.
Способы получения оксидов
Получают оксиды различными способами, из которых важнейшими являются следующие:
а) Горение и окисление простых веществ.
Например: 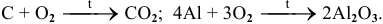
б) Горение и окисление сложных веществ.
Например:
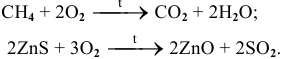
в) Разложение некоторых сложных кислородсодержащих веществ (нерастворимых оснований, кислот, солей) при нагревании.
Например: 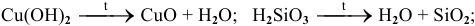
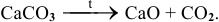
г) Взаимодействие металлов с водой при нагревании.
Например: 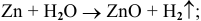
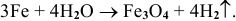
Рекомендую самостоятельно привести по нескольку примеров получения оксидов различными способами.
Химические свойства основных оксидов
а) Взаимодействие с водой
С водой взаимодействуют только оксиды щелочных и щелочно-земельных металлов по схеме:
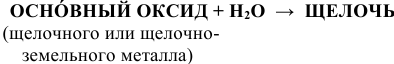
Например: 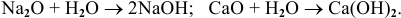
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
б) Взаимодействие с кислотными оксидами
Реакция протекает по схеме:
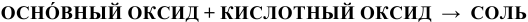
Примеры: 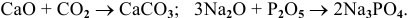
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
в) Взаимодействие с кислотами
Реакция протекает по схеме:
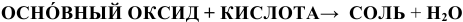
Примеры: 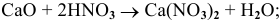
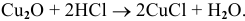
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
Химические свойства кислотных оксидов
а) Взаимодействие с водой
С водой взаимодействует подавляющее большинство кислотных оксидов (не взаимодействует 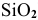 ) с образованием кислородсодержащей кислоты:
) с образованием кислородсодержащей кислоты:
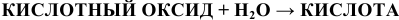
Примеры: 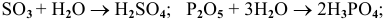
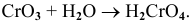
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
б) Взаимодействие с основными оксидами (см. свойства основных оксидов).
в) Взаимодействие с основаниями
Реакция протекает по схеме:
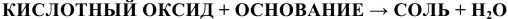
Примеры: 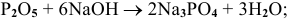
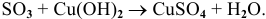
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
Химические свойства амфотерных оксидов
Амфотерность означает проявление двойственной природы в отношении кислотно-основных свойств. Таким образом, амфотерные оксиды должны проявлять как свойства основных оксидов, так и свойства кислотных оксидов.
а) Взаимодействие с кислотными оксидами
В данном случае амфотерный оксид ведет себя как основный. Реакция протекает по схеме:
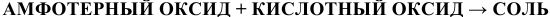
Примеры: 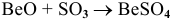 ;
;
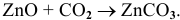
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
б) Взаимодействие с кислотами
В этом случае амфотерный оксид также ведет себя как основный. Реакция протекает по схеме:
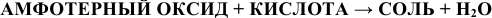
Примеры: 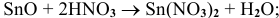
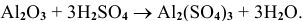
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
в) Взаимодействие с основными оксидами
В данном случае амфотерный оксид ведет себя как кислотный. Реакция протекает по схеме:
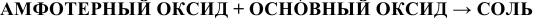
Примеры: 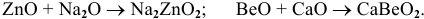
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
г) Взаимодействие с основаниями
Амфотерный оксид ведет себя как кислотный:
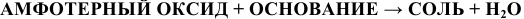
Примеры: 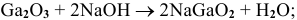 ;
;
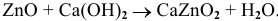
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
Безразличные оксиды по отношению как к основным соединениям, так и к кислотным остаются инертными.
Эта теория взята со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Основания в химии. Краткие теоретические сведения |
| Кислоты в химии. Краткие теоретические сведения |
| Металлы в химии. Краткие теоретические сведения |
| Неметаллы в химии. Краткие теоретические сведения |

