Оглавление:
Расчеты результатов анализа в титриметрии
Расчетные формулы определения массы вещества 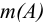 для разных приемов и способов титрования, при различных способах выражения концентрации рабочего раствора, приведены в таблице 8.3. Прежде чем приступать к вычислениям, следует представить уравнения протекающих реакций, определить прием и способ титрования, а также, с учетом протекающих реакций, найти молярную массу эквивалента определяемого вещества.
для разных приемов и способов титрования, при различных способах выражения концентрации рабочего раствора, приведены в таблице 8.3. Прежде чем приступать к вычислениям, следует представить уравнения протекающих реакций, определить прием и способ титрования, а также, с учетом протекающих реакций, найти молярную массу эквивалента определяемого вещества.
Приведенные формулы легко дополняются необходимыми множителями для вычисления содержания компонента А в анализируемой пробе.

Например, от массы определяемого компонента 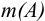 можно перейти к его массовой доле
можно перейти к его массовой доле 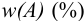 через отношение
через отношение 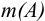 к массе навески
к массе навески 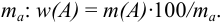
Пример 8.15.
Определить массу железной проволоки, которую растворили в серной кислоте, а на титрование полученного раствора израсходовали 40,00 мл рабочего раствора 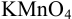 с
с 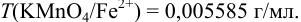
Решение:
Титрование прямое, способ — отдельных навесок.
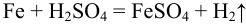 (растворение),
(растворение),
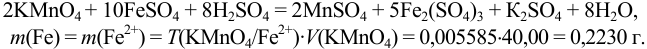
Пример 8.16.
Навеска кальцинированной соды массой 0,1267 г растворена в воде и оттитрована в присутствии индикатора метилового оранжевого 22,65 мл 0,1002 н. раствора 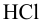 . Вычислить массовую долю
. Вычислить массовую долю 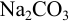 в образце.
в образце.
Решение:
Проведено прямое титрование по реакции
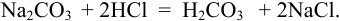
Индикатор метиловый оранжевый имеет переход окраски в кислой среде, что указывает на оттитровывание не одного, а двух эквивалентов 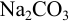 ) (см. пример 8.13).
) (см. пример 8.13).
Пример 8.17.
Навеску 3,017 г пестицида, содержащего 20,86 % формальдегида обработали 50,00 мл 1,0 М 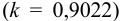 раствора
раствора 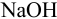 в присутствии пероксида водорода:
в присутствии пероксида водорода:
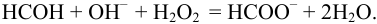
Избыток щелочи оттитровали раствором 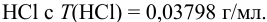 Какой объем
Какой объем 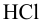 израсходован на титрование?
израсходован на титрование?
Решение:
В данном примере использован прием обратного титрования по способу отдельных навесок. Учитывая условие задачи, найдем массу 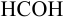 в навеске пестицида:
в навеске пестицида:
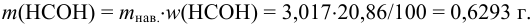
Поскольку содержание 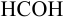 определялось обратным титрованием, то согласно табл. 8.3 справедливо:
определялось обратным титрованием, то согласно табл. 8.3 справедливо:
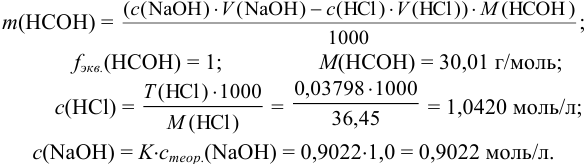
Преобразуем выражение для расчета 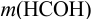 относительно
относительно 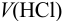 :
:

Пример 8.18.
1,1622 г поваренной соли растворили в воде и раствор разбавили до 200,0 мл. К 20,00 мл этого раствора прибавили 25,00 мл 0,1000 н. раствора 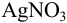 . На титрование избытка
. На титрование избытка 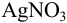 израсходовали 5,080 мл 0,0900 н. раствора NH4SCN. Определить массовую долю хлорида натрия в образце соли.
израсходовали 5,080 мл 0,0900 н. раствора NH4SCN. Определить массовую долю хлорида натрия в образце соли.
Решение:
Проведено обратное титрование способом вот. Для расчета используем (табл. 8.3) уравнение:
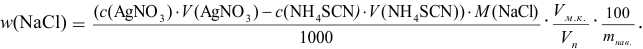
В соответствии с уравнением реакции (см. пример 8.14):
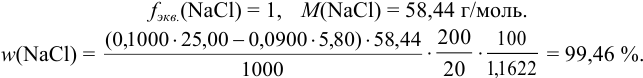
Пример 8.19.
Из 25,00 мл раствора свинец осадили в виде 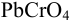 , осадок отфильтровали, растворили в кислоте и добавили избыток
, осадок отфильтровали, растворили в кислоте и добавили избыток 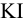 . На титрование выделившегося иода израсходовали 31,50 мл 0,1010 и. раствора
. На титрование выделившегося иода израсходовали 31,50 мл 0,1010 и. раствора 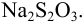 Рассчитайте количество свинца в растворе (г) и молярную концентрацию ионов свинца в исходном растворе.
Рассчитайте количество свинца в растворе (г) и молярную концентрацию ионов свинца в исходном растворе.
Решение:
В данном примере проведено определение ионов 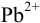 приемом титрования заместителя согласно реакциям :
приемом титрования заместителя согласно реакциям :
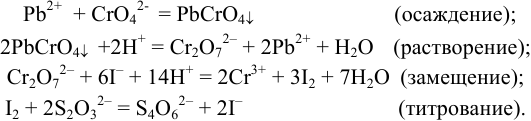
По закону эквивалентов (см. также пример 8.8):
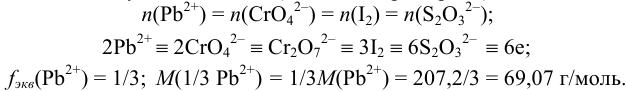
Для расчета содержания свинца при титровании по заместителю можно использовать формулу (см. табл. 8.3):
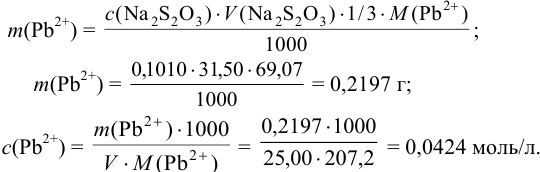
Пример 8.20.*
При получении экстракционной фосфорной кислоты из фосфоритной муки протекают следующие основные реакции:
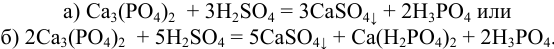
От направления процесса зависит состав реакционной массы. Контроль процесса осуществляется методом кислотно-основного титрования.
Для анализа взяли 5,00 мл фильтрата реакционной массы и разбавили в мерной колбе до 250,0 мл. На титрование аликвоты 25,00 мл с индикатором метиловым оранжевым (м.о.) израсходовано 20,10 мл раствора 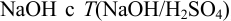 , равным 0,004901 г/мл. На титрование такого же объема с фенолфталеином (ф.ф.) израсходовано 35,80 мл того же раствора
, равным 0,004901 г/мл. На титрование такого же объема с фенолфталеином (ф.ф.) израсходовано 35,80 мл того же раствора 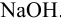 . Интервал pH перехода окраски м.о. 3,1 — 4,4; ф.ф. 8,2 — 9,8.
. Интервал pH перехода окраски м.о. 3,1 — 4,4; ф.ф. 8,2 — 9,8.
Установите, при избытке или недостатке 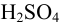 проводился процесс, в результате которого получена указанная реакционная масса. Вычислите концентрации каждого из компонентов в реакционной массе (г/л).
проводился процесс, в результате которого получена указанная реакционная масса. Вычислите концентрации каждого из компонентов в реакционной массе (г/л).
Решение:
Возможные реакции титрования (см. разделы 8.5, 8.6):
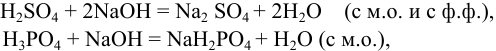
поскольку 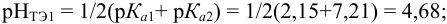
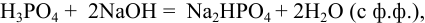
поскольку 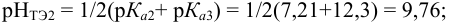
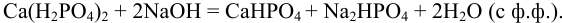
Для случая a) 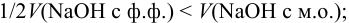 для случая б)
для случая б) 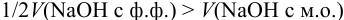 .
.
По данным анализа: 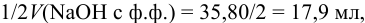 что
что 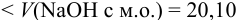 мл, следовательно, реакционная масса содержит
мл, следовательно, реакционная масса содержит 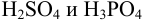 .
.
Найдем расход щелочи на 1 эквивалент 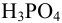 :
:
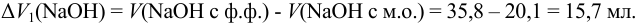
Найдем расход щелочи на 2 эквивалента 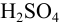 :
:

Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

