Оглавление:
Методы, приемы и способы титрования
В титриметрии используют реакции всех типов: с переносом протона, электрона, электронной пары, осаждения. В соответствии с типом реакции, титриметрические методы разделяют на 4 большие группы, в каждой из которых выделяют группы по названию применяемых титрантов (табл. 8.1).
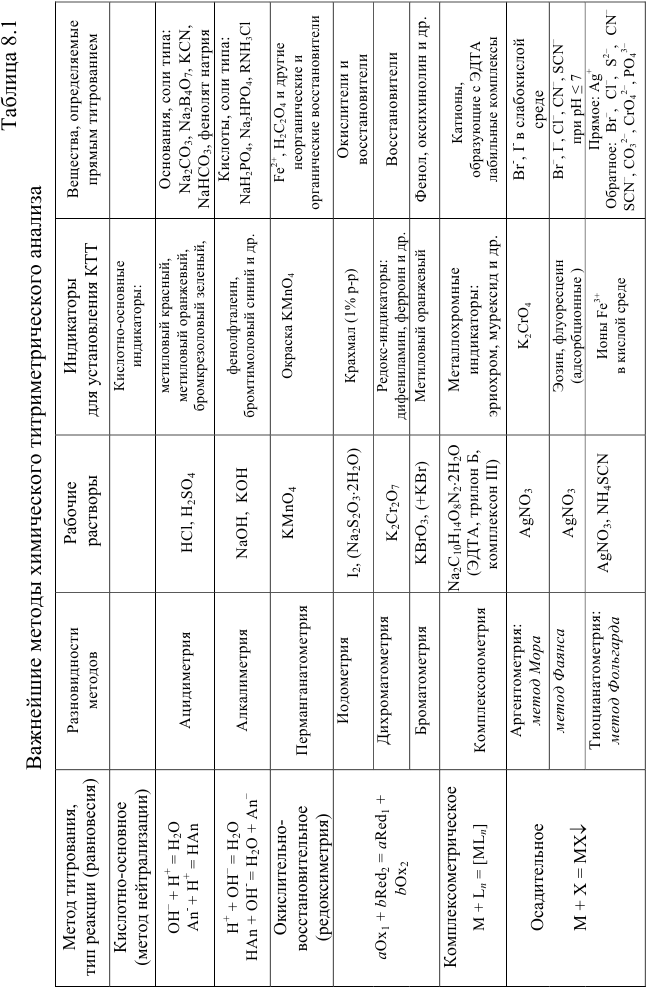
По приемам титрования различают прямое, обратное и титрование заместителя (табл. 8.2). При прямом титровании титрант В непосредственно добавляют из бюретки к титруемому веществу А. Такой прием применим только при выполнении всех требований к реакции титрования. В случае их несоблюдения или для практической целесообразности используют прием обратного титрования, для осуществления которого необходимы два рабочих раствора титрант 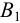 и титрант
и титрант 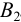 . Первый добавляется к определяемому веществу А в избытке для доведения реакции до конца, затем избыток
. Первый добавляется к определяемому веществу А в избытке для доведения реакции до конца, затем избыток 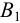 оттитровывается титрантом
оттитровывается титрантом 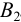 для определения количества не прореагировавшего с веществом А титранта В\ Закон эквивалентов для обратного титрования можно представить следующим уравнением (см. также табл. 8.3):
для определения количества не прореагировавшего с веществом А титранта В\ Закон эквивалентов для обратного титрования можно представить следующим уравнением (см. также табл. 8.3):
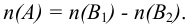
Пример 8.1.
Ион 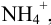 являющийся в воде очень слабой кислотой
являющийся в воде очень слабой кислотой 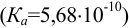 , нельзя оттитровать рабочим раствором
, нельзя оттитровать рабочим раствором 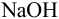 приемом прямого титрования из-за высокой обратимости реакции. Поэтому к пробе, содержащей соль аммония, добавляют определенный объем титрованного раствора
приемом прямого титрования из-за высокой обратимости реакции. Поэтому к пробе, содержащей соль аммония, добавляют определенный объем титрованного раствора 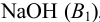 , обеспечивающий избыточное количество щелочи по отношению к ионам аммония, после чего удаляют аммиак и избыток
, обеспечивающий избыточное количество щелочи по отношению к ионам аммония, после чего удаляют аммиак и избыток 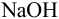 титруют рабочим раствором
титруют рабочим раствором 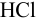
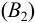 , т. е. последовательно выполняются две реакции:
, т. е. последовательно выполняются две реакции:
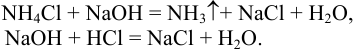
Тогда: 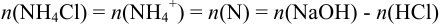 .
.
Пример 8.2.
Стехиометрическая реакция
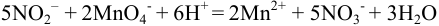
осложняется реакцией разложения азотистой кислоты в кислой среде:
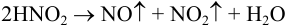
и поэтому из-за летучести оксидов азота теряется определяемое вещество. В связи с этим применяют обратное титрование: к анализируемому нитриту добавляют избыток 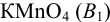 , подкисляют и после окончания реакции оттитровывают оставшийся перманганат рабочим раствором
, подкисляют и после окончания реакции оттитровывают оставшийся перманганат рабочим раствором 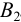 — щавелевой кислоты или соли Мора
— щавелевой кислоты или соли Мора 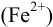 . В этом случае:
. В этом случае: 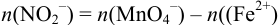 .
.
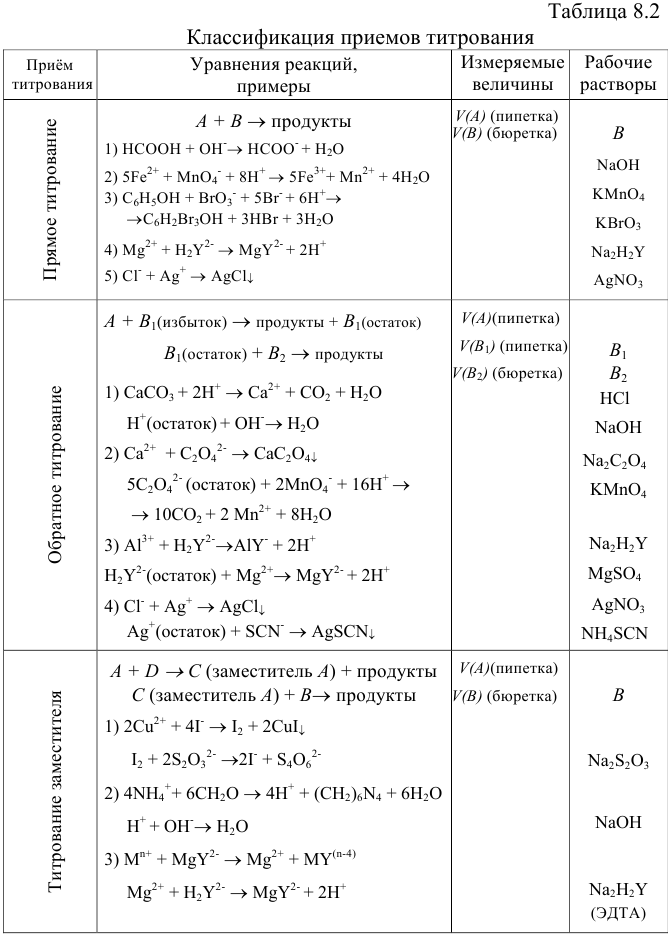
Титрование заместителя используют при отсутствии подходящего индикатора, при несоблюдении стехиометричности или при медленном протекании реакции. В этих случаях к определенному объему вещества А добавляют вспомогательный реагент, количественно взаимодействующий с Л, а получающийся продукт реакции (в количестве, эквивалентном А) оттитровывают подходящим титрантом В. Закон эквивалентов при титровании заместителя имеет выражение как при прямом титровании: 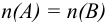 .
.
Пример 8.3.
При определении иона 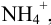 можно провести реакцию с формальдегидом, в результате которой выделяется эквивалентное количество протонов, являющихся заместителями
можно провести реакцию с формальдегидом, в результате которой выделяется эквивалентное количество протонов, являющихся заместителями 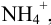 .
.
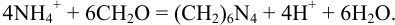
Ионы 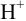 оттитровывают раствором NaOH. При этом справедливо:
оттитровывают раствором NaOH. При этом справедливо:
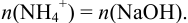
Пример 8.4.
При определении свинца проводят последовательно несколько стехиометрических реакций:
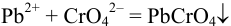 (осаждение),
(осаждение),
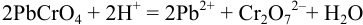
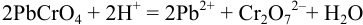 (растворение),
(растворение),
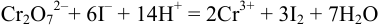 (получение заместителя),
(получение заместителя),
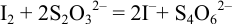 (титрование).
(титрование).
Выделившийся в эквивалентном количестве иод титруют рабочим раствором тиосульфата натрия. В результате:
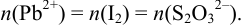
Обычно в титриметрии проводят несколько параллельных титрований. При этом используют один из двух способов: способ отдельных навесок и способ пипетирования (аликвот). Использование в расчетах — в табл. 8.3. В способе пипетирования пробу (навеска сухого вещества или объем раствора), содержащую определяемое вещество А, переводят в мерную колбу вместимостью 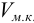 , а на титрование отбирают пипеткой равные объемы
, а на титрование отбирают пипеткой равные объемы 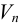 — аликвоты. В способе отдельных навесок пробу помещают в колбу для титрования, при этом навеску вещества там же растворяют в небольшом объеме растворителя, затем проводят титрование, измеряя объем израсходованного титранта
— аликвоты. В способе отдельных навесок пробу помещают в колбу для титрования, при этом навеску вещества там же растворяют в небольшом объеме растворителя, затем проводят титрование, измеряя объем израсходованного титранта 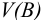 . Метод пипетирования является более экспрессным и менее трудоемким, но и менее точным, чем метод отдельных навесок.
. Метод пипетирования является более экспрессным и менее трудоемким, но и менее точным, чем метод отдельных навесок.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

