Оглавление:
Вычисление растворимости малорастворимого электролита
Растворимостью малорастворимого электролита 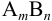 называют его общую концентрацию в насыщенном растворе, которая обозначается как S (моль/л). В случае преобладания в системе осадок — раствор равновесия 1 (стр. 75), т. е. ионной растворимости, S может быть выражена через общие концентрации ионов А и В.
называют его общую концентрацию в насыщенном растворе, которая обозначается как S (моль/л). В случае преобладания в системе осадок — раствор равновесия 1 (стр. 75), т. е. ионной растворимости, S может быть выражена через общие концентрации ионов А и В.
Если в 1 л раствора перешло S моль электролита 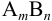 в реакции Г), то, в отсутствие избытка какого-либо из ионов, уравнение реакции растворения можно представить следующими обозначениями концентраций ионов через величину растворимости S:
в реакции Г), то, в отсутствие избытка какого-либо из ионов, уравнение реакции растворения можно представить следующими обозначениями концентраций ионов через величину растворимости S:
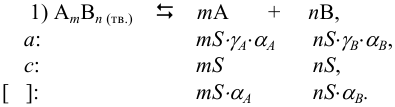
Соответственно 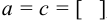 , если для ионов
, если для ионов 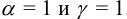 .
.
Подставляя в выражение (6.1) эти обозначения, получаем для 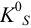 малорастворимого электролита
малорастворимого электролита 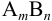 уравнение в общем виде:
уравнение в общем виде:
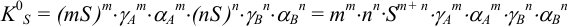
и выражение для растворимости электролита 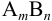 :
:
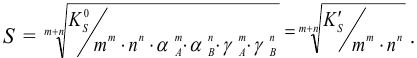
При отсутствии побочных реакций 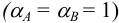 и при
и при 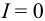 выражение упрощается, и растворимость определяется только природой электролита и температурой (через величину
выражение упрощается, и растворимость определяется только природой электролита и температурой (через величину 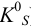 ):
):
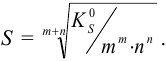
В присутствии избытка одноименного иона, например В с концентрацией 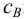
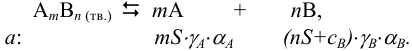
Поскольку одноименный ион уменьшает растворимость, смещая равновесие влево, в расчетах часто пренебрегают величиной 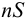 в сумме
в сумме 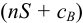 . Тогда для приближенного расчета растворимости в присутствии одноименного аниона справедливы выражения:
. Тогда для приближенного расчета растворимости в присутствии одноименного аниона справедливы выражения:
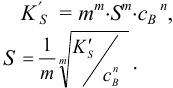
Аналогично, в присутствии избытка катиона (здесь — ион 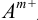 ) с введенной концентрацией сА для приближенного расчета растворимости справедливо выражение:
) с введенной концентрацией сА для приближенного расчета растворимости справедливо выражение:
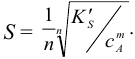
Таким образом, согласно выражениям (6.3, 6.7 и 6.8), растворимость малорастворимого электролита зависит от его природы и температуры; от побочных реакций ионов; от ионной силы раствора, создаваемой посторонними электролитами («солевой эффект «); от присутствия одноименных с осадком ионов.
В обратной задаче может быть вычислена константа растворимости малорастворимого электролита, если известна величина его растворимости.
Пример 6.7.
Вычислить 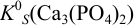 , если в 1 л растворяется
, если в 1 л растворяется 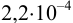 граммов фосфата кальция.
граммов фосфата кальция.
Решение:
Найдем растворимость 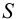 (моль/л) соли в воде:
(моль/л) соли в воде:
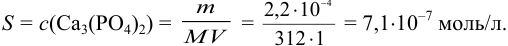
При такой низкой концентрации ионов в растворе величиной ионной силы можно пренебречь и считать 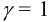 . Пренебрегая побочной реакцией гидролиза аниона, можно считать
. Пренебрегая побочной реакцией гидролиза аниона, можно считать 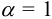 . Равновесие в системе описывается уравнением:
. Равновесие в системе описывается уравнением:
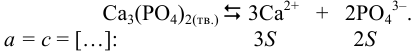
Вычисляем 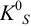 в соответствии с выражениями (6.1) и (6.2):
в соответствии с выражениями (6.1) и (6.2):
Пример 6.8.
Определить растворимость сульфата бария в воде. Сколько граммов этой соли растворяется в 1 л воды, если 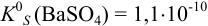 ?
?
Решение:
Поскольку в растворе отсутствуют посторонние электролиты, пренебрежем влиянием ионной силы. Побочных реакций не происходит. Как в примере 6.6 при 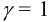 и
и 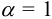 по выражению (6.4) рассчитаем растворимость
по выражению (6.4) рассчитаем растворимость 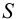 :
:
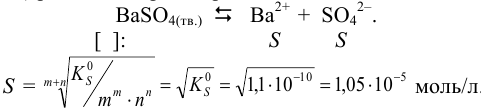
Тогда растворимость в г/л будет соответствовать массе соли m в 1 л раствора: 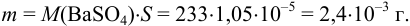 .
.
Пример 6.9.
Определить растворимость сульфида висмута в воде, если 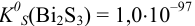 (без учета гидролиза).
(без учета гидролиза).
Решение:
Равновесие в системе выражается уравнением:
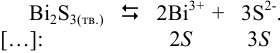
Вычисления проводим аналогично предыдущему примеру, используя выражение (6.4) (ионная сила мала):
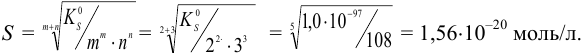
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

