Оглавление:
Влияние pH раствора на величину потенциала
Влияние pH на величину потенциала проявляется для полуреакций, протекающих с участием «ионов среды» — 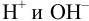 , причем оно может быть настолько значительным, что способно изменить направление (пример 5.7) окислительно-восстановительной реакции.
, причем оно может быть настолько значительным, что способно изменить направление (пример 5.7) окислительно-восстановительной реакции.
Пример 5.6.
Рассчитайте равновесный и формальный потенциалы пары 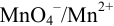 (строго говоря, пары
(строго говоря, пары 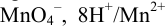 ), если
), если 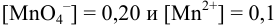 моль/л при pH = 5 и pH = 1.
моль/л при pH = 5 и pH = 1.
Решение:
Записываем уравнение полуреакции:
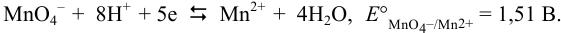
С учетом вывода, сделанного в примере 5.5, и ввиду отсутствия данных о составе раствора, будем считать I = 0, а  ионов равными 1. Тогда равновесный потенциал пары
ионов равными 1. Тогда равновесный потенциал пары  можно вычислить по уравнению Нернста вида (5.4) или (5.5), а по уравнению, подобному (5.6) — формальный.
можно вычислить по уравнению Нернста вида (5.4) или (5.5), а по уравнению, подобному (5.6) — формальный.
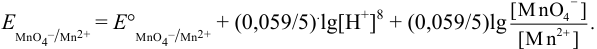
При pH = 5 или 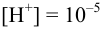 моль/л, в отсутствие побочных реакций
моль/л, в отсутствие побочных реакций 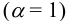 :
:
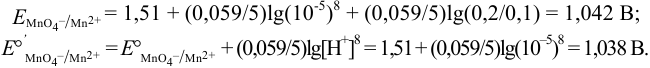
При pH = 1 или 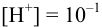 моль/л, в отсутствие побочных реакций
моль/л, в отсутствие побочных реакций 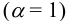 :
:
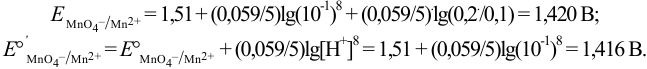
Сравнивая 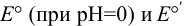 для пары
для пары  при различных pH, можно видеть сильную зависимость окислительной способности формы
при различных pH, можно видеть сильную зависимость окислительной способности формы 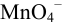 от pH, проявляющуюся в её увеличении с ростом кислотности раствора.
от pH, проявляющуюся в её увеличении с ростом кислотности раствора.
Пример 5.7.
Определите направление реакции взаимодействия иода с арсенитом натрия при pH =0, pH = 4 и pH = 8.
Решение:
Реакция взаимодействия иода с арсенит-ионом:
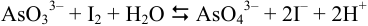
Полуреакции и стандартные потенциалы пар:
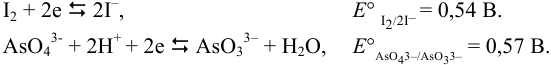
Сравнение 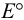 данных пар показывает, что арсенат-ион является более сильным окислителем, чем иод. Если, как это предполагается по реакции, окислителем считать иод, то:
данных пар показывает, что арсенат-ион является более сильным окислителем, чем иод. Если, как это предполагается по реакции, окислителем считать иод, то:
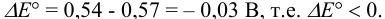
Следовательно, в стандартных условиях 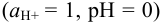 равновесие данной реакции будет смещено влево, иод не будет окислять арсенит.
равновесие данной реакции будет смещено влево, иод не будет окислять арсенит.
Вычислим формальные потенциалы пары 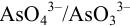 с учетом pH по формуле (5.6) (
с учетом pH по формуле (5.6) (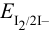 от pH не зависит). При pH = 4:
от pH не зависит). При pH = 4:
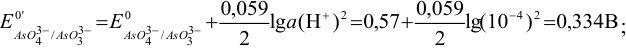
при pH = 8:
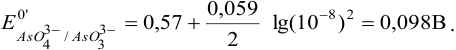
Сравнивая 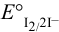 с полученными значениями
с полученными значениями 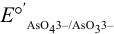 , видим, что с ростом pH формальный потенциал пары
, видим, что с ростом pH формальный потенциал пары 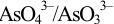 уменьшается,
уменьшается, 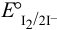 становится значительно больше, чем
становится значительно больше, чем 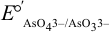 , значит арсенит будет окисляться иодом и реакция пойдет в прямом направлении.
, значит арсенит будет окисляться иодом и реакция пойдет в прямом направлении.
При pH 4: 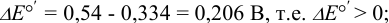 при pH 8:
при pH 8: 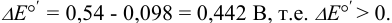
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

