Оглавление:
Вычисление потенциала в реальных условиях. Уравнение Нернста
В реальных условиях химического равновесия величина потенциала зависит от температуры и активностей окисленной и восстановленной форм. Количественно эта зависимость равновесного потенциала пары (Е) выражается уравнением Нернста:
для полуреакции 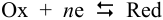
уравнение Нернста 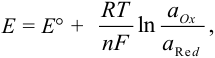
где: R — универсальная газовая постоянная (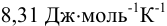 );
);
F — число Фарадея (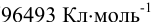 );
);
Т- абсолютная температура (К);
Е — равновесный потенциал.
После подстановки постоянных величин и переходя к десятичным логарифмам, получаем коэффициенты 0,059 при 25°С и 0,058 при 20°С.
Тогда уравнение Нернста при 25°С можно записать так:
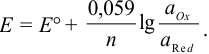
Обычно вместо активностей в расчетах используют концентрации окисленной и восстановленной форм, пренебрегая различием в величинах коэффициентов активностей обеих форм, которые при близких значениях сокращаются в уравнении (5.3).
Пример 5.4 .
Вычислить 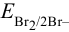 , если
, если 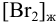 = 0,21 моль/л, а
= 0,21 моль/л, а 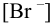 = 0,012 моль/л.
= 0,012 моль/л.
Решение:
Записываем уравнение полуреакции:

Записываем уравнение Нернста для данной полуреакции:
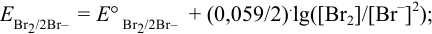
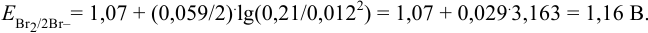
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

