Оглавление:
Оценка окислительно-восстановительной способности веществ и направления окислительно-восстановительной реакции
Окислительно-восстановительная реакция протекает с изменением степеней окисления элементов, входящих в ту или иную форму реагирующих веществ. Направление окислительно-восстановительной реакции (3) и глубина ее протекания, как и в других химических равновесиях, могут быть определены по константе равновесия, являющейся произведением констант (раздел 2.3) полуреакции восстановления (1) и полуреакции окисления (2).
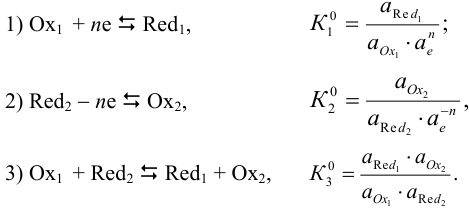
Окисленная и восстановленная формы вещества представляют собой сопряженную пару  или редокс- пару, подобно паре кислота — сопряженное основание в кислотноосновном равновесии. Подобие этих систем проявляется также в невозможности осуществления в растворе полуреакций приема и отдачи электронов, как и полуреакций приема и отдачи протона (основанием и сопряженной кислотой — глава 3).
или редокс- пару, подобно паре кислота — сопряженное основание в кислотноосновном равновесии. Подобие этих систем проявляется также в невозможности осуществления в растворе полуреакций приема и отдачи электронов, как и полуреакций приема и отдачи протона (основанием и сопряженной кислотой — глава 3).
Чаще направление окислительно-восстановительной реакции и глубину ее протекания оценивают, сравнивая стандартные 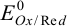 потенциалы, а в реальных условиях — формальные потенциалы
потенциалы, а в реальных условиях — формальные потенциалы 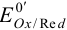 (примеры 5.5 — 5.8).
(примеры 5.5 — 5.8).
Стандартные потенциалы 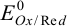 измеряют в гальваническом элементе (рис. 5.1) относительно стандартного водородного электрода,
измеряют в гальваническом элементе (рис. 5.1) относительно стандартного водородного электрода, 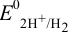 которого принят за нуль при любой температуре. Их приводят в справочных таблицах (табл. 5 приложения) для полуреакций восстановления. В стандартных условиях активности всех участников полуреакции равны 1, т. е.
которого принят за нуль при любой температуре. Их приводят в справочных таблицах (табл. 5 приложения) для полуреакций восстановления. В стандартных условиях активности всех участников полуреакции равны 1, т. е. 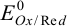 не зависит от ионной силы раствора и концентрации реагентов. Чем больше
не зависит от ионной силы раствора и концентрации реагентов. Чем больше 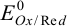 тем более сильным окислителем является окисленная форма пары и более слабым восстановителем — ее восстановленная форма.
тем более сильным окислителем является окисленная форма пары и более слабым восстановителем — ее восстановленная форма.
Для определения направления реакции в близких к стандартным условиях необходимо сравнить 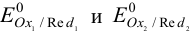 полуреакций и найти
полуреакций и найти 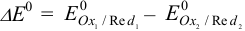 . Это соответствует вычитанию из одной полуреакции восстановления другой полуреакции восстановления. При
. Это соответствует вычитанию из одной полуреакции восстановления другой полуреакции восстановления. При 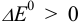 реакция окисления-восстановления протекает слева направо (пример 5.1), а при
реакция окисления-восстановления протекает слева направо (пример 5.1), а при 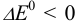 — в обратном направлении (пример 5.7).
— в обратном направлении (пример 5.7).
Использование для оценки окислительно-восстановительной способности веществ удобной термодинамической характеристики, которой является окислительно-восстановительный (электродный, редокс-) потенциал, связано с отличительной особенностью полуреакций окисления и восстановления — возможностью их разделения в пространстве. Полуреакции можно осуществить в виде катодного (восстановление) и анодного (окисление) процессов в гальваническом элементе — электрохимической ячейке, служащей источником тока. Электрический ток возникает при переносе электронов, т. е. энергия химической реакции преобразуется в электрическую (рис. 5.1).
Для этого компоненты полуреакций помещаются в отдельные сосуды, которые соединяют солевым мостиком. Им может быть стеклянная трубочка, заполненная инертным гелем, пропитанным сильным электролитом, не участвующим в редокс- реакциях (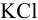 на рис. 5.1). В каждый сосуд, погружается проволочка (пластинка) либо из инертного металла, либо из металла, участвующего в полуреакции. Металл и компоненты полуреакции составляют полуэлемент или электрод. Электроды подсоединяют к гальванометру или потенциометру — внешней цепи. При замыкании цепи гальванометр покажет наличие тока.
на рис. 5.1). В каждый сосуд, погружается проволочка (пластинка) либо из инертного металла, либо из металла, участвующего в полуреакции. Металл и компоненты полуреакции составляют полуэлемент или электрод. Электроды подсоединяют к гальванометру или потенциометру — внешней цепи. При замыкании цепи гальванометр покажет наличие тока.
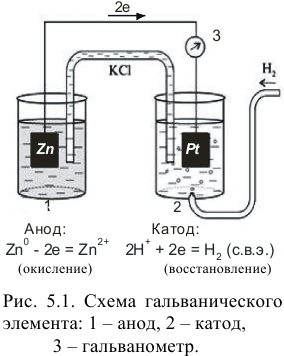
На рис. 5.1 один полуэлемент состоит из цинковой пластинки, погруженной в раствор 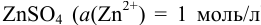 ) (цинковый электрод). Другой — из платиновой пластинки, покрытой губчатой
) (цинковый электрод). Другой — из платиновой пластинки, покрытой губчатой  (для лучшей адсорбции
(для лучшей адсорбции 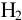 , который подается под давлением 101,3 кПа), погруженной в раствор с
, который подается под давлением 101,3 кПа), погруженной в раствор с 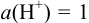 моль/л — стандартный водородный электрод (с.в.э.). При замыкании цепи электроны от цинка будут переходить к ионам
моль/л — стандартный водородный электрод (с.в.э.). При замыкании цепи электроны от цинка будут переходить к ионам 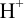 и начнется суммарная реакция до установления равновесия, которая протекала бы и в растворе между
и начнется суммарная реакция до установления равновесия, которая протекала бы и в растворе между 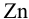 и кислотой:
и кислотой:
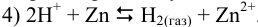
Измеренная при этом ЭДС близка к величине:
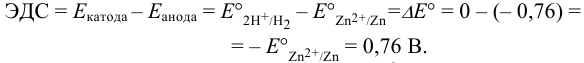
Если вместо электродной пары 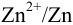 в левый сосуд поместить пару
в левый сосуд поместить пару 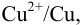 , при замыкании цепи стрелка гальванометра отклонится в другую сторону, поскольку электроны от водорода (анода) будут переходить к ионам
, при замыкании цепи стрелка гальванометра отклонится в другую сторону, поскольку электроны от водорода (анода) будут переходить к ионам 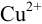 , в результате чего медь из раствора будет осаждаться на медном электроде (катоде), что соответствует суммарной реакции:
, в результате чего медь из раствора будет осаждаться на медном электроде (катоде), что соответствует суммарной реакции:
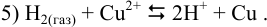
Тогда: 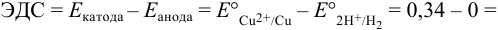
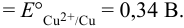
Различие в направлении отклонения стрелки измерительного прибора в этих двух случаях указывает на различие в направлении самопроизвольно протекающей в гальваническом элементе химической реакции. Сила окислителя уменьшается в ряду: 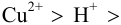
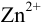 , а сила восстановителя уменьшается в ряду:
, а сила восстановителя уменьшается в ряду: 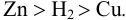
Схематически гальванический элемент представляют, указывая слева направо: анод (присваивают знак «-»); границу раздела фаз (вертикальная черта); электролиты в анодном полуэлементе; границу раздела полуэлементов (две вертикальные черты); электролиты в катодном пространстве; границу раздела фаз (вертикальная черта); катод (присваивают знак «+»). Для гальванического элемента рис. 5.1 границей раздела полуэлементов ( катода и анода) в растворе служит солевой мостик с 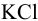 .
.
Упомянутые гальванические элементы (см. также примеры 5.21-5.23):
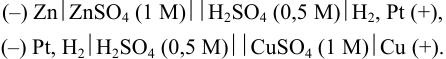
На практике для измерения потенциалов вместо с.в.э. используют электрод сравнения с известной величиной потенциала, чаще всего хлорсеребряный или насыщенный каломельный (пример 5.23).
Пример 5.1.
В каком направлении протекает реакция между 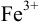 и
и 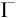 ?
?
Решение:
Табличные значения 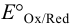 для полуреакций:
для полуреакций:
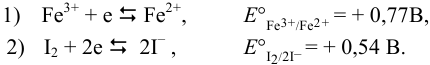
Уравнивая число электронов и вычитая из полу реакции восстановления (1) (с участием предполагаемого окислителя) полу реакцию восстановления (2)(с участием предполагаемого восстановителя) и меняя знаки в уравнении на положительные, получаем:
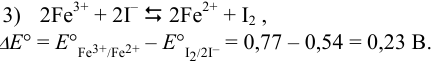
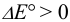 , поэтому реакция 3) протекает в прямом направлении.
, поэтому реакция 3) протекает в прямом направлении.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

