Оглавление:
Направление химических реакций. Способы выражения констант равновесия. Ступенчатые и общие константы равновесия
Термодинамические (табличные) константы 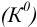 простых равновесий пригодны для расчетов при условии, что поведение исходных и конечных продуктов не осложняется электростатическими или конкурирующими химическими взаимодействиями. При расчетах равновесий с использованием термодинамических констант получаются активности компонентов.
простых равновесий пригодны для расчетов при условии, что поведение исходных и конечных продуктов не осложняется электростатическими или конкурирующими химическими взаимодействиями. При расчетах равновесий с использованием термодинамических констант получаются активности компонентов.
Поэтому в реальных условиях удобнее пользоваться реальными (концентрационными) константами (К), которые выражаются через равновесные концентрации, а также условными 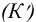 , которые связаны с общими концентрациями.
, которые связаны с общими концентрациями.
Для реакции: 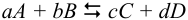
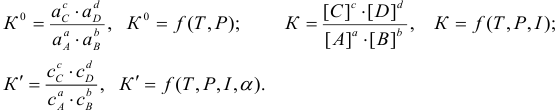
Все три константы связаны между собой через соответствующие, рассмотренные выше, коэффициенты:
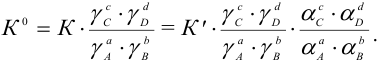
Таким образом, при расчетах равновесных (или общих) концентраций в реальных системах необходимо оценить меру различных влияний и через указанные коэффициенты и 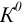 рассчитать значения К (или
рассчитать значения К (или 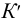 ). При этом следует помнить, что химические факторы оказывают более сильное влияние, чем электростатические, поэтому при наличии конкурирующих реакций, как правило, принимают ионную силу
). При этом следует помнить, что химические факторы оказывают более сильное влияние, чем электростатические, поэтому при наличии конкурирующих реакций, как правило, принимают ионную силу 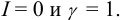
Химическая реакция может протекать только в том случае, когда она термодинамически возможна и константа равновесия её больше единицы. По величине константы равновесия можно оценить направление, полноту протекания реакции и возможность её регулирования. При 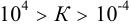 равновесие реакции можно сместить в нужную сторону, например избытком реагента. При
равновесие реакции можно сместить в нужную сторону, например избытком реагента. При 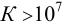 реакция протекает в прямом направлении практически до конца (такие реакции применимы в количественном анализе); при
реакция протекает в прямом направлении практически до конца (такие реакции применимы в количественном анализе); при 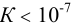 реакция практически не идет.
реакция практически не идет.
Любая химическая реакция может быть представлена как совокупность ступенчатых процессов, а общая константа равновесия такой реакции может быть выражена как произведение ступенчатых констант.
Пример 2.7.
Рассчитайте константу равновесия реакции, описывающей растворение 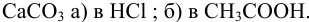
Решение:
Представляем уравнения реакций в молекулярной и ионно-молекулярной форме:
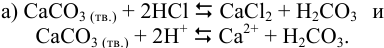
Записываем уравнения ступенчатых реакций, описывающих распад или образование слабых и малорастворимых электролитов и соответствующие им константы:
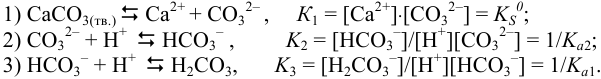
Составляем выражение общей константы равновесия и подставляем табличные значения соответствующих констант:
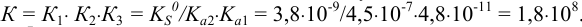
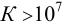 , значит
, значит 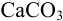 растворится в
растворится в 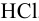 даже без избытка кислоты,
даже без избытка кислоты,
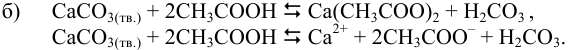
Уравнения и константы ступенчатых процессов:
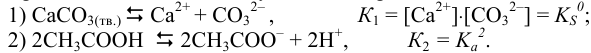
Ступени 3) и 4) те же, что 2) и 3) в примере 2.7а,
т.е. 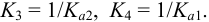
Рассчитываем общую константу равновесия:
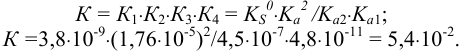
Вычисленное значение К указывает на смещение равновесия влево, в сторону исходных веществ. Однако поскольку 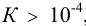 , можно сместить равновесие вправо избытком уксусной кислоты и провести растворение
, можно сместить равновесие вправо избытком уксусной кислоты и провести растворение 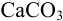 .
.
Пример 2.8.
Определите возможность растворения 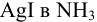 .
.
Решение:
Для ответа на вопрос рассчитаем общую константу равновесия согласно схеме, использованной в примере 2.7.
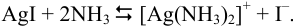
Ступенчатые процессы:
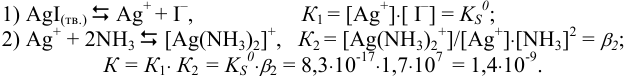
Поскольку полученное значение 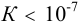 , можно сделать вывод о том, что осадок
, можно сделать вывод о том, что осадок 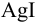 не растворится даже в избытке аммиака.
не растворится даже в избытке аммиака.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

